2021-08-31 京都大学iPS細胞研究所
ポイント
- 自己由来がんスフェロイド注1)を用いることで、ヒト大腸がん由来の腫瘍浸潤リンパ球注2)より腫瘍特異的T細胞注3)を選択する方法を考案した。
- iPS細胞を用いてマルチクローナル注4)な状態での腫瘍浸潤リンパ球の再生を実現した。
- 再生に伴う腫瘍浸潤リンパ球の質的・機能的向上をin vitro(生体外)ならびにin vivo(生体内)モデルで確認した。
1. 研究の背景
腫瘍浸潤リンパ球(tumor infiltrating lymphocytes: TIL)は腫瘍抗原注5)特異的リンパ球を高頻度に含むポリクローナル注6)な集団であり、主に抗原量の多いがん腫に対する養子細胞移注療法注7)に用いられてきました。移注される細胞の質および量は、治療効果と相関することが報告されており、大量の腫瘍特異的T細胞を分化の浅い状態で準備することが重要です。しかしながら、TILはすでに分化段階が進み、老化状態にあることが多いため、理想的な細胞調製は課題とされてきました。
iPS細胞をつかった再生T細胞では、抗原特異性が保存されるだけでなく、若返りに伴う機能改善が報告されています。そこで、TILの抱える問題点を克服する手段として、iPS細胞を介したT細胞再生技術の応用が想起されました。本研究ではTIL由来の腫瘍特異的T細胞を再生すると共に、複数抗原を標的にするためマルチクローナルな状態での再生にも取り組みました。
2. 研究結果
1) 腫瘍浸潤リンパ球からの腫瘍特異的T細胞の選択
ヒト大腸がんの原発巣からTILを採取すると同時に、自己由来スフェロイドを樹立しました。がんスフェロイドとの共培養を行うことで、腫瘍反応性をもった腫瘍浸潤-細胞傷害性T細胞注8)(TI-CTL :tumor infiltrating-cytotoxic T lymphocytes) へと濃縮しました (図1a) 。がんスフェロイドに対するTI-CTLの反応性を各T細胞受容体注9)β鎖可変領域注10)(TCR Vβ:T cell receptor Vβ)毎に観察するとともに、T細胞受容体-HLAクラスⅠ注11)(TCR-HLA class I )依存性についても評価しました (図1b)。このような工程を経ることで、腫瘍特異的TI-CTLを選択するとともに、TCR-HLA class Iに依存しない反応性集団を排除しました。
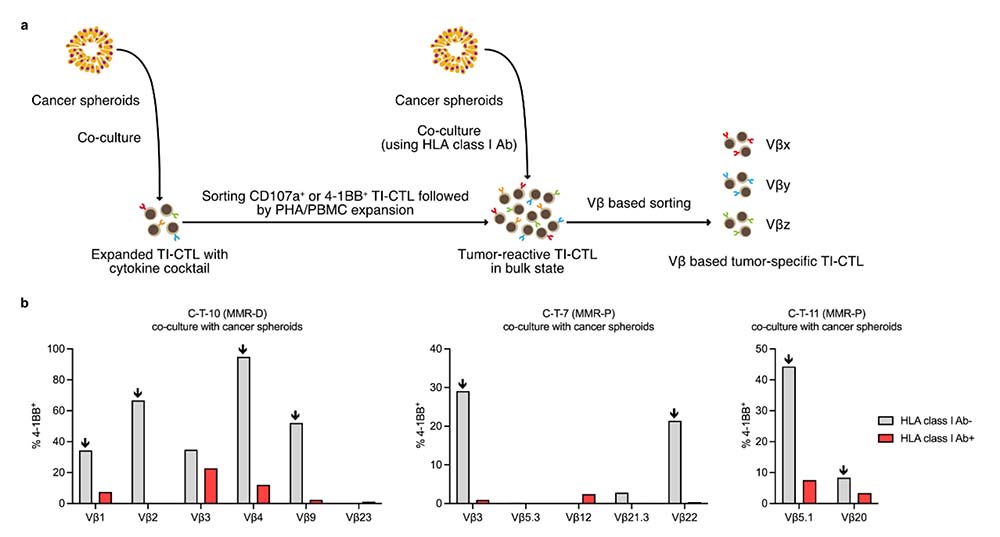
図1:がんスフェロイドを用いた腫瘍特異的TI-CTLの選択
(a) 自己由来がんスフェロイドとTI-CTLの共培養を通し、腫瘍反応性TI-CTLへと濃縮した。濃縮された腫瘍反応性TI-CTLより、各TCR Vβ毎に腫瘍特異的クローンを分取した。
(b) 各TCR Vβ毎にTCR-HLA依存的な腫瘍反応性を示した。HLA class I ブロッキング抗体によって反応性が抑制されるTCR Vβクローンを腫瘍特異的クローンと想定して分取した。
2) マルチクローナルな状態でのTI-CTL再生
腫瘍特異的TI-CTLを各TCR Vβ毎にクローン化した後、iPS細胞の樹立 (TIL-iPSC) およびT細胞分化誘導を行いました(図2a)。選択した全TCR VβクローンからTIL-iPSCは樹立でき、10例中9例でT細胞再生 (TIL-iPS-T) に成功しました (図2b)。
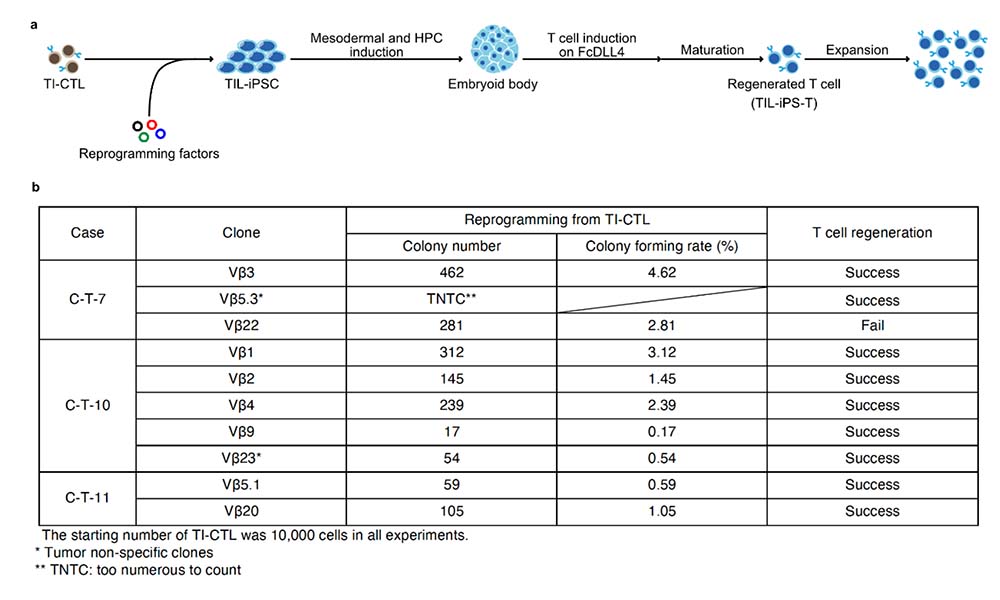
図2:TI-CTLからのiPS細胞樹立とT細胞分化誘導
(a) 図1で選択した各TCR Vβクローンに初期化因子を導入してTIL-iPSCを樹立し、フィーダーフリー培養法注12)でT細胞分化誘導を行った。
(b) 全TCR VβクローンからTIL-iPSC樹立に成功した。また、TIL-iPSCから高確率で再生T 細胞 (TIL-iPS-T) が得られた。
3) 再生に伴う腫瘍浸潤リンパ球の質的・機能的向上
TIL-iPS-Tにおいて、親クローンであるTI-CTLとの比較を通して解析を行いました。ナイーブT細胞注13)に関連した特徴を有するだけでなく、増殖能の改善、テロメア注14)の伸長などの質的向上が観察されました (図3)。さらに、in vitroにおける腫瘍傷害活性の向上が確認されるとともに、がんスフェロイドを皮下移植した担がんマウス注15)(patient derived spheroids xenograft: PDSX)における生体内生存期間の延長が観察されました (図4)。
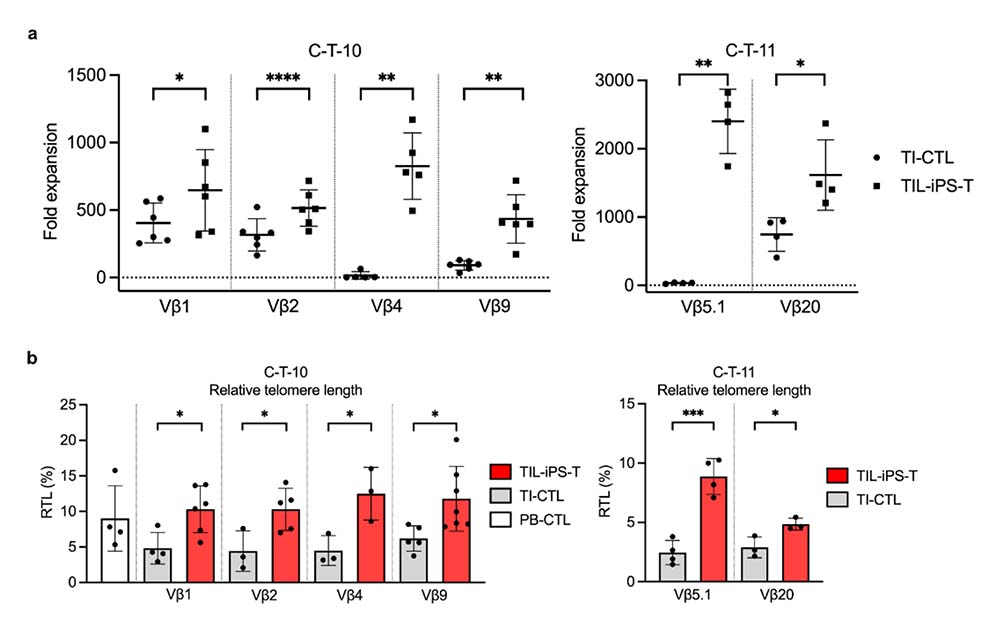
図3:再生T細胞 (TIL-iPS-T) と親クローン (TI-CTL) の比較
(a) フィトヘマグルチニン注16)-P (PHA)/PBMC刺激に伴う細胞増殖能を比較し、全クローンでTIL-iPS-Tの増殖能向上が確認された。増殖能が著しく低下したクローンにおいても、増殖能がリセットされる点は特筆すべき変化である。
(b) 比較した全クローンにおいて、再生に伴うテロメア伸長が確認された。
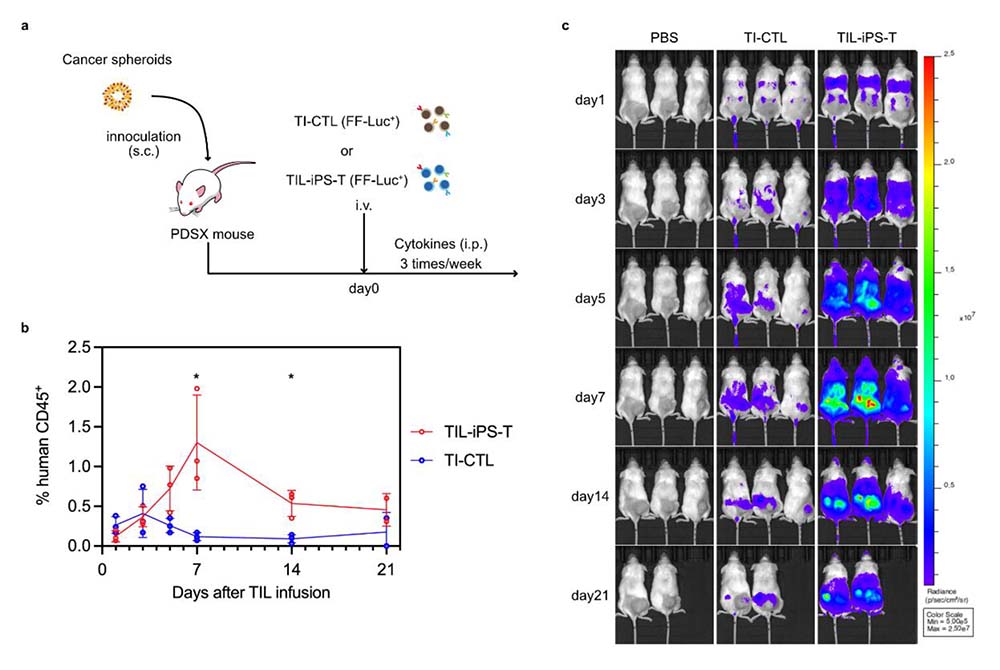
図4:PDSXマウスを用いた体内動態の評価
(a) がんスフェロイドをNSGマウス注17)の皮下移植することでPDSXマウスを樹立した。移注したT細胞が体内で追跡できるよう、ホタルルシフェラーゼ注18)(firefly-luciferase (FF-Luc+))を導入した。
(b) マウス末梢血中の移注細胞 (human CD45+) 含有率を経時的に解析した。
(c) 移注細胞の体内分布について、in vivo イメージングシステム(IVIS) で評価した。TIL-iPS-Tは腫瘍局所に多く集積し、さらに長く留まることが分かった。
3. 本研究の意義と今後の展望
自己由来がんスフェロイドを用いることで、ヒト大腸がんから複数クローンの腫瘍特異的TI-CTLの選択が可能であることが示されました。加えて、選択された腫瘍特異的TI-CTLより、iPS細胞を介したマルチクローナルなTIL-iPS-T再生も実現可能であることが示されました。また、再生に伴う若返りにより、TILの質的・機能的向上が確認されました。PDSXマウスを用いたTIL-iPS-Tの治療能評価を継続するとともに、免疫チェックポイント阻害剤注19)などとの併用療法の可能性、遺伝子編集などによるTIL-iPS-Tの機能増強や賦与についても、更なる検討が望まれます。
4. 論文名と著者
- 論文名
The therapeutic potential of multiclonal tumoricidal T cells derived from tumor infiltrating lymphocyte-derived iPS cells - ジャーナル名
Communications Biology - 著者
Takeshi Ito1,2*, Yohei Kawai1, Yutaka Yasui1,3, Shoichi Iriguchi1, Atsutaka Minagawa1, Tomoko Ishii1, Hiroyuki Miyoshi4, M. Mark Taketo4, Kenji Kawada2, Kazutaka Obama2, Yoshiharu Sakai5 and Shin Kaneko1** - 著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
- 京都大学医学部 消化管外科
- サイアス株式会社
- 京都大学医学部附属病院 先端医療研究開発機構 (iACT)
- 大阪赤十字病院
5. 本研究への支援
- 日本学術振興会 (JSPS) 科研費 [18H02641]
- サイアス株式会社
6. 用語説明
注1) スフェロイド
細胞を3次元培養することにより球形に組織化させたもの。
注2) 腫瘍浸潤リンパ球
腫瘍の中に浸潤するリンパ球の総称。腫瘍浸潤リンパ球の中には、腫瘍を認識する腫瘍抗原特異的リンパ球が多く存在する。
注3) 腫瘍特異的T細胞
腫瘍を特異的に攻撃するT細胞。
注4) マルチクローナル
2クローン以上など、複数のクローンを含んだ状態。
注5) 腫瘍抗原
正常細胞や組織には発現せず、腫瘍に限定的に発現する抗原。免疫系を刺激して抗腫瘍反応を誘発させる。
注6) ポリクローナル
多数のクローンを含んだ状態。マルチクローナルよりも、多くのクローンを含む。
注7) 養子細胞移注療法
体外で抗腫瘍効果のもった免疫細胞を培養し、増幅した後に患者体内に戻す治療法。
注8) 細胞傷害性T細胞
T細胞の一種で、宿主にとって異物になる細胞を認識して破壊する。キラーT細胞とも呼ばれる。
注9) T細胞受容体
T細胞の細胞膜上に発現している抗原受容体分子であり、α鎖とβ鎖からなる。可変領域のV・(D)・Jの遺伝子断片の再編成がα鎖とβ鎖で行われ、多様な抗原を認識する。
注10) T細胞受容体β鎖可変領域
T細胞受容体のβ鎖の可変領域を指す。
注11) HLAクラスⅠ
HLAはヒトの主要組織適合遺伝子複合体(MHC)であるヒト白血球型抗原(Human Leukocyte Antigen)の略で、細胞の自他を区別する型。ヒトの免疫に関わる重要な分子として働く。HLAクラスⅠは、抗原をキラーT細胞に提示する。
注12) フィーダーフリー培養法
フィーダー細胞(目的の細胞を培養する際、培養条件を整える補助的な役割をもつ細胞)を用いない培養法。
注13) ナイーブT細胞
抗原と一度も遭遇したことのない未熟なT細胞。
注14) テロメア
染色体の末端部の構造。繰り返し配列を持つDNAとさまざまなタンパク質から構成される。細胞老化とともにテロメアが短縮する。
注15) 担がんマウス
がんを体内に持っているマウス。
注16) フィトヘマグルチニン
T細胞活性化因子。
注17) NSGマウス
重度複合免疫不全マウス。
注18) ホタルルシフェラーゼ
ホタル体内で化学発光を触媒する発光酵素。
注19) 免疫チェックポイント阻害剤
T細胞の活性化を抑制するシステムは免疫チェックポイントと呼ばれ、同システムを阻害することでT細胞免疫を賦活化させる薬剤。