2022-01-06 京都大学 iPS細胞研究所
ポイント
- マイクロRNA(miRNA)注1)に応答してタンパク質を生産させるmRNA注2)スイッチ(miRNA応答ONスイッチ)を開発した。
- 2つのmRNAスイッチを組み合わせることによって、純度の高い細胞選別システムを確立した。HeLa細胞注3)、293FT細胞注4)、iPS細胞、心筋細胞の純化を確認した。
- 本手法を用いることで、移植細胞を安全に大量に安価に供給できることが期待できる。また、がん細胞などをターゲットとしたmRNA医薬品の開発にもつながる。
1. 要旨
iPS細胞は様々な細胞に分化できますが、分化誘導後は目的の細胞以外の細胞も含まれているため、細胞表面の抗原を識別して細胞を選別する操作(フローサイトメーター注5)を使った純化)が行われることが一般的です。しかし、フローサイトメーターを用いる場合、細胞一つ一つを選別する操作中に目的外の細胞や不純物が混じる可能性があり、費用もかかる上、移植に必要な量の細胞を用意するのに数時間から数日かかることもあります。また、目的細胞に特異的な抗原を同定することが困難な場合も多いことが知られています。
これに対し、細胞種特有の小さなRNA(マイクロRNA:miRNA)を識別し、遺伝子発現を制御可能なmRNAスイッチ技術は、目的の細胞のゲノムを傷つけることがなく、安全性が高い技術です。さらにこの技術は、不要な細胞に細胞死を誘発できるので、大量の目的細胞を一度に純化可能です。今回、藤田祥彦助教(CiRA未来生命科学開拓部門)、齊藤博英教授(CiRA同部門)らの研究グループは、miRNAに応答して遺伝子を発現させるmRNAスイッチ(miRNA応答ONスイッチ)を開発しました。このようなmiRNAに応答してmRNAからのタンパク質の生産を活性化させるしくみの開発に世界で初めて成功しました。
これまでに開発した、miRNAに応答して遺伝子の発現を抑制させるmiRNA応答OFFスイッチと組み合わせることで、より純度の高い、多様な細胞種を純化することが可能になります。本手法を用いて、HeLa細胞、293FT細胞、iPS細胞、iPS細胞から分化した心筋細胞の純化が可能であることを確認しました。
本手法は、神経細胞やインスリン産生細胞など、様々な細胞へ拡張することも可能と考えられ、移植用の細胞を安全で、大量かつ安価に供給できるようにすることで、細胞移植医療が一般的な治療方法として選択され、広く普及することを目指します。また、標的とする特定の細胞でのみ細胞死を誘発することができるため、がん細胞などをターゲットとしたmRNA医薬品の開発にもつながると考えられます。
本研究成果は2022年1月6日(日本時間)に米国科学雑誌「Science Advances」でオンライン公開されました。
2. 研究の背景
これまで齊藤博英教授らの研究グループは、miRNAに応答して遺伝子の発現をOFFにするスイッチ(miRNA応答OFFスイッチ)を開発してきました(CiRAニュース:2015年5月22日「マイクロRNAをつかった細胞の選別方法の開発〜高純度な心筋細胞の作製に成功〜」)。しかし、このスイッチでは、スイッチとmiRNAの結合が弱い場合、遺伝子の発現を完全にOFFにすることができず少量の遺伝子が発現し(リーク発現)、細胞の種類によっては純化が困難な場合がありました。そのため、miRNA応答OFFスイッチにアポトーシス注6)を引き起こす遺伝子であるBimを用いることで90%程度の効率で心筋細胞を選別することに成功していましたが、必要以上の細胞死を防ぐためにはBim遺伝子の発現量を厳密に調整する必要がありました。
今回、miRNA応答OFFスイッチとは逆の反応となるよう、miRNAに応答して遺伝子の発現(タンパク質の産生)をONにするスイッチ(miRNA応答ONスイッチ)を新たに開発しました。ONスイッチ開発のために、mRNAのポリA鎖注7)の下流に人工配列を挿入するという、これまでの研究にはない独自の手法を見出しました。新しく開発したONスイッチとmiRNA応答OFFスイッチを組み合わせることで、リーク発現の問題を克服し、フローサイトメーター等の機器を用いることなく、多様な細胞種を純化することができると考えられます。
3. 研究結果
1)miRNA応答ONスイッチの設計
研究グループは、まず目的のmiRNAがある場合に反応するmiRNA応答ONスイッチの設計を行いました。通常、自然のmRNAには翻訳の方向があり、ポリA鎖と呼ばれる構造において翻訳が終結します。また、ポリA鎖と結合するタンパク質があるとmRNAの翻訳が強化される性質があります。これに着目し、miRNAのポリA鎖の下流にスイッチ機構を組み込み、20塩基程度の変更で任意のmiRNAを検出して任意の遺伝子を発現させることが可能なmiRNA応答ONスイッチを設計しました(図1)。実際にHeLa細胞と293FT細胞を使った実験を行い、このシステムが機能することを確認しました。
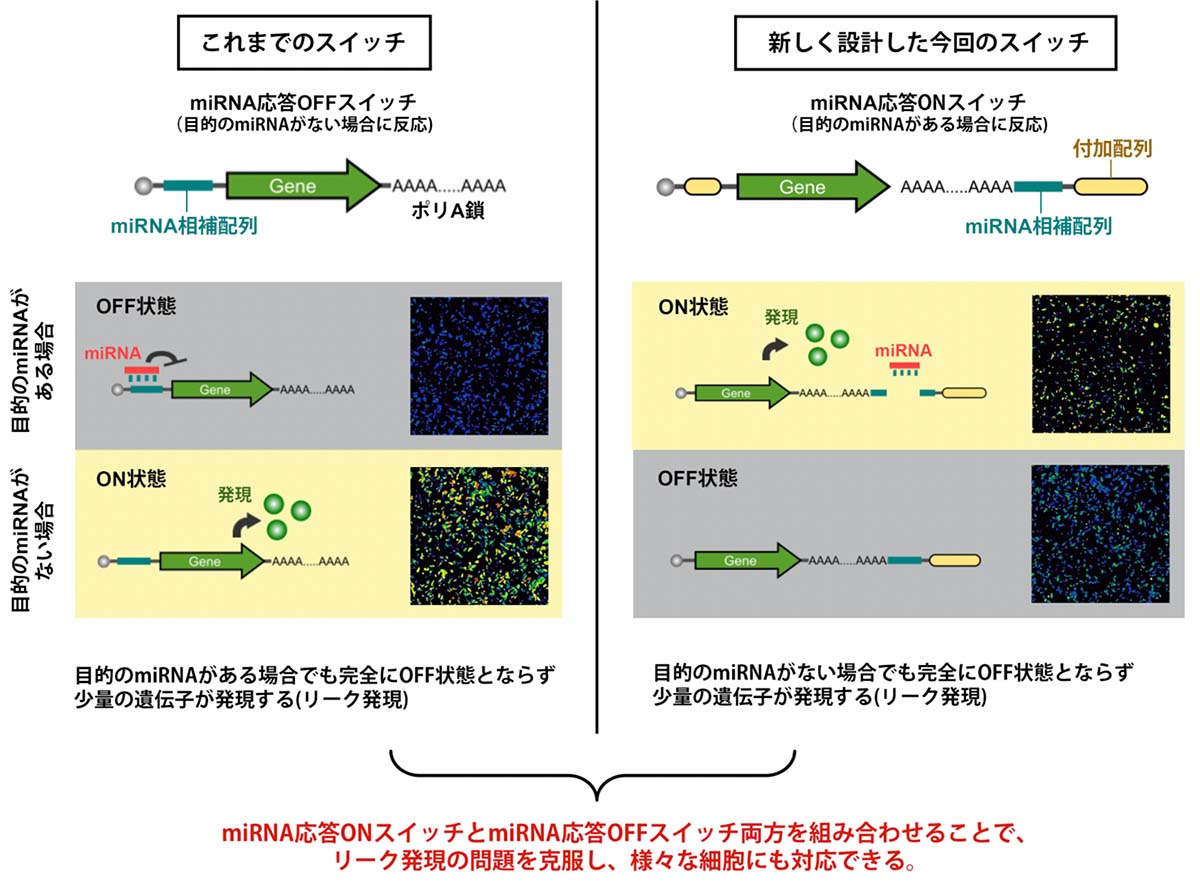
図1:これまでのmiRNA応答OFFスイッチと今回設計したmiRNA応答ONスイッチの概念
2)2つのRNAスイッチを組み合わせ、任意の細胞(HeLa細胞, 293FT細胞)を純化する
次に、2つのmiRNA応答ONスイッチとmiRNA応答OFFスイッチを活用した純化システムを確立するために、細胞死を引き起こす致死性リボヌクレアーゼ注8)のBarnase(Bn)と、Bnを阻害するタンパク質Barstar(Bs)を発現させる遺伝子をそれぞれのスイッチに組み込みました。相反するBnとBsをONとOFFスイッチそれぞれに組み込むことで、単一のスイッチで反応しきれず漏れた細胞をもう一つのスイッチでカバーすることができます。
実際に、HeLa細胞と293FT細胞が混ざった細胞群を用いて実験を行いました。まず、miR-21という特有のmiRNAを持ったHeLa細胞を純化するため、miR-21に応答するmiRNA応答OFFスイッチにBnを組み込み、miRNA応答ONスイッチにBsを組み込んで細胞群へ導入させました。すると、miR-21を持つHeLa細胞はmiRNA応答ONスイッチによりBnを阻害するBsタンパク質が生成されます。一方、miR-21を持たない293FT細胞はmiRNA応答OFFスイッチによりBnが生成され、細胞死します。結果、HeLa細胞のみが生き残り、純化されました(図2(A))。
次に、293FT細胞を純化するため、miRNA応答OFFスイッチにBsを組み込み、miRNA応答ONスイッチにBnを組み込んで細胞群へ導入させました。すると、miR-21を持たない293FT細胞はmiRNA応答OFFスイッチによりBnを阻害するBsタンパク質が生成されます。一方、miR-21を持つHeLa細胞はmiRNA応答ONスイッチによりBnが生成され、細胞死します。結果、293FT細胞のみが生き残り、純化されました(図2(B))。
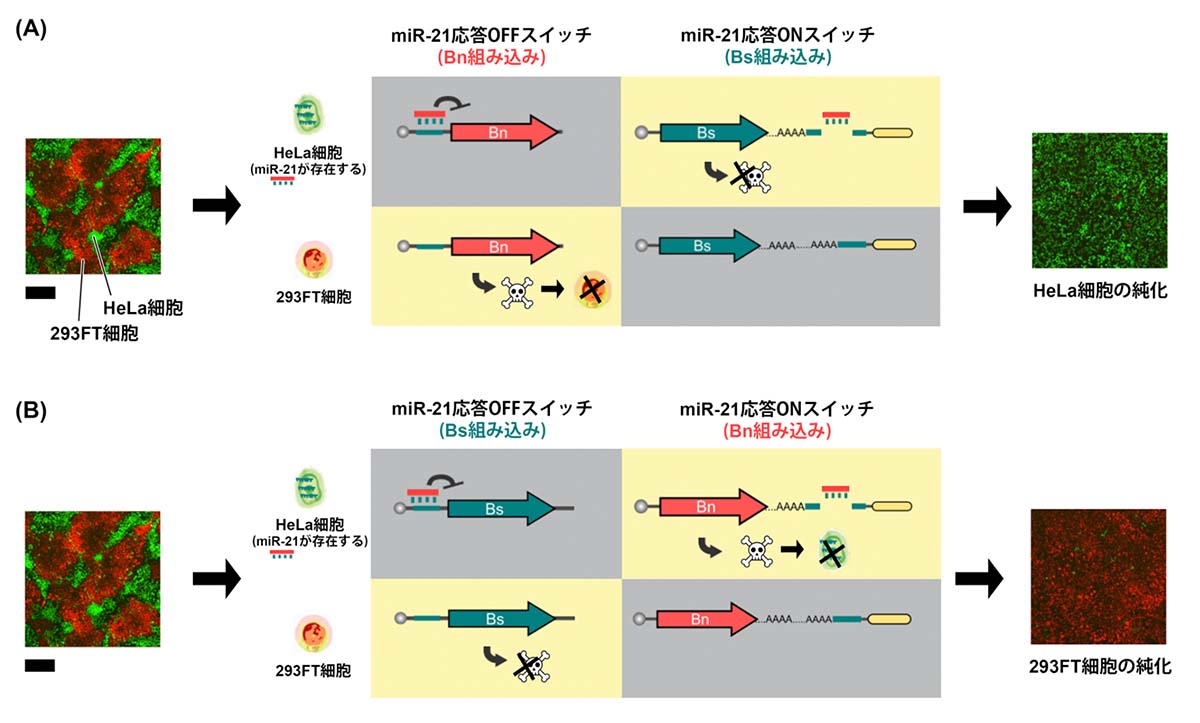
図2:2つのmRNAスイッチを使ったHeLa細胞と293FT細胞の純化
(A) HeLa細胞を純化する場合、miR-21に応答するmiRNA応答OFFスイッチにBnを組み込み、miRNA応答ONスイッチにBsを組み込んで導入した。miR-21を持つHeLa細胞はmiRNA応答ONスイッチによりBnを阻害するBsタンパク質が生成され、miR-21を持たない293FT細胞はmiRNA応答OFFスイッチによりBnが生成され、細胞死する。
(B) 293FT細胞を純化する場合、miR-21に応答するmiRNA応答OFFスイッチにBsを組み込み、miRNA応答ONスイッチにBnを組み込んで導入した。miR-21を持たない293FT細胞はmiRNA応答OFFスイッチによりBnを阻害するBsタンパク質が生成され、miR-21を持つHeLa細胞はmiRNA応答ONスイッチによりBnが生成され、細胞死する。
スケールバーは200μmを示す。
純化後のHeLa細胞と293FT細胞の割合を調べると、HeLa細胞も293FT細胞も95%以上の割合で純化されていることが分かりました(図3)。特に、アポトーシスに耐性がある293FT細胞をBnを用いて効率よく除去し、HeLa細胞を純化できたことは特筆すべきことです。
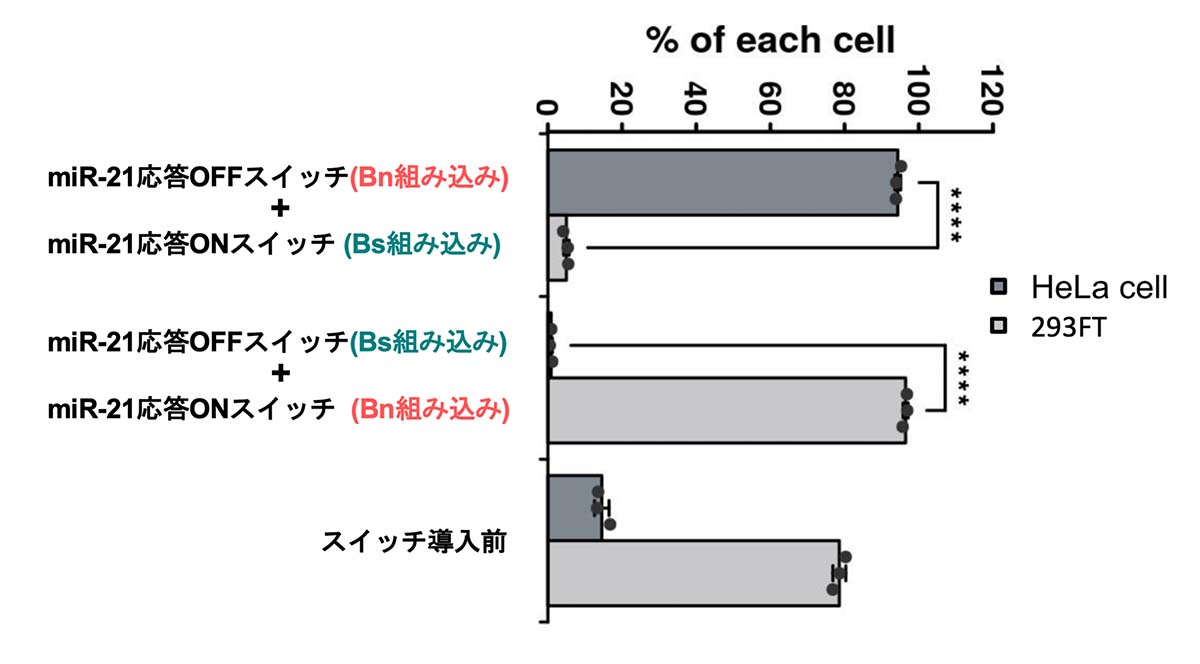
図3:純化後のHeLa細胞と293FT細胞の割合
2つのmRNAスイッチを導入した場合、純化後のHeLa細胞と293FT細胞の割合は95%以上となることが計測できた。****P<0.0005
3)2つのmRNAスイッチを組み合わせ、iPS細胞とiPS細胞から分化した心筋細胞を純化する
さらに、2つのmRNAスイッチを組み合わせてiPS細胞を純化する実験を行いました。iPS細胞にはmiR-302aというmiRNAが存在することが分かっているので、miR-302aに応答するmiRNA応答OFFスイッチにBnを組み込み、miRNA応答ONスイッチにBsを組み込んでHeLa細胞とiPS細胞が混ざった細胞群へ導入させました。すると、miR-302aを持つiPS細胞はmiRNA応答ONスイッチによりBnを阻害するBsタンパク質が生成されます。一方、miR-302aを持たないHeLa細胞はmiRNA応答OFFスイッチによりBnが生成され、細胞死します。結果、iPS細胞のみが生き残り、純化されました(図4)。
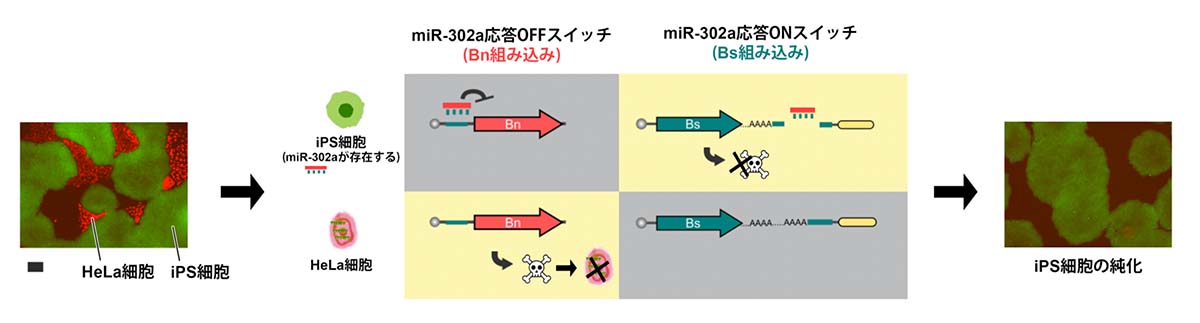
図4:2つのmRNAスイッチを使ったiPS細胞の純化
miR-302aに応答するmiRNA応答OFFスイッチにBnを組み込み、miRNA応答ONスイッチにBsを組み込んで導入した。miR-302aを持つiPS細胞はmiRNA応答ONスイッチによりBnを阻害するBsタンパク質が生成され、miR-302aを持たないHeLa細胞はmiRNA応答OFFスイッチによりBnが生成され、細胞死する。スケールバーは200μmを示す。
純化後のiPS細胞の割合を調べると、2つのスイッチ導入後、iPS細胞は95%以上純化していることが確かめられました(図5)。さらに、継代培養注9)を行うと99%以上に達する純化も可能だということが分かりました。
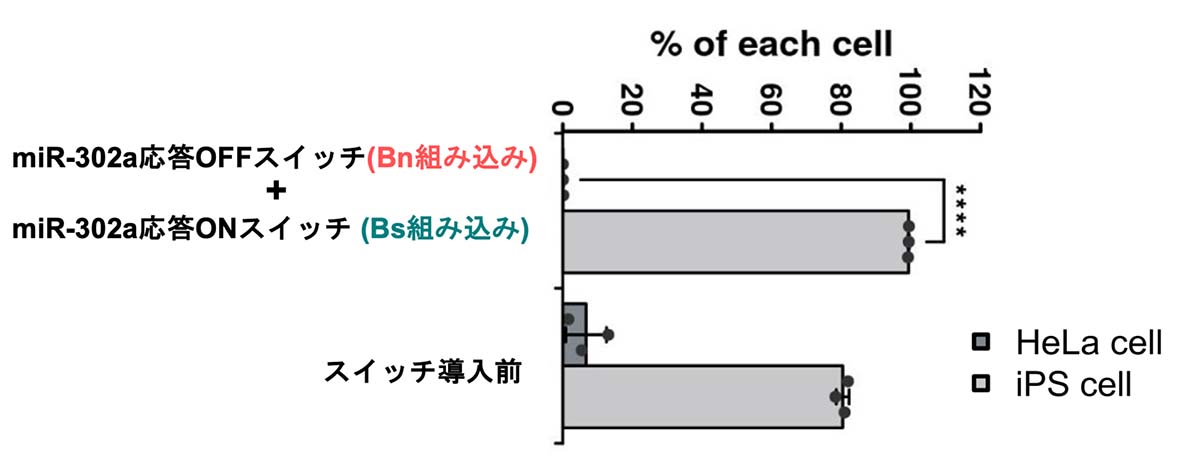
図5:純化後のHeLa細胞とiPS細胞の割合
2つのmRNAスイッチを導入した場合、純化後のiPS細胞はフローサイトメーターにより95%
以上あることが確かめられた。****P<0.0005
同様に、iPS細胞から分化した心筋細胞に2つのスイッチを導入して純化を試みたところ、心筋細胞においてもフローサイトメーターを用いずとも95%程度純化できることが確認できました。
最後に、これまで導入したスイッチによる純化した細胞への影響を調べるため、RNA-seq解析注10)によって遺伝子発現の変化を確認しました。すると、HeLa細胞などの一部の細胞のみにおいて一般的な核酸に対する応答が確認されたのみで、mRNA特有の影響というものは観察されませんでした。また、導入したmRNAの量は3日程度で1/10以下に減少することが確認されました。
4. 本研究の意義と今後の展望
本研究では、フローサイトメーターを用いることなく、純度の高い細胞選別を達成することに成功しました。この手法はいろいろな細胞の純化に応用できます。たとえば、iPS細胞から分化した心筋細胞も純化できました。
2つのmRNAにBnとBsをそれぞれ組み込むことによって、単一のスイッチで反応しきれず選別し損ねた細胞をカバーすることが出来ました。本手法では2つのmRNAスイッチを組み合わせるのみで、導入するmRNAの量を厳密に調整する必要はありません。さらに、標的とする特定の細胞で細胞死を誘発することができるため、がん細胞などをターゲットとしたmRNA医薬品の開発にもつながると考えられます。
また、mRNAはゲノムへの挿入リスクも低いため、移植用の多様な細胞種を純化する手法として実用性が高いといえます。実際に、mRNAスイッチの導入による特有の影響はなく、導入したmRNAスイッチも数日で消滅することが確認されました。このことから安全性も高いことが期待できるため、将来、細胞治療用の移植細胞の純化方法としての普及を目指します。
5. 論文名と著者
- 論文名
A versatile and robust cell purification system with an RNA-only circuit composed of microRNA-responsive ON and OFF switches - ジャーナル名
Science Advances - 著者
Yoshihiko Fujita1,*,**, Moe Hirosawa1, Karin Hayashi1, Takeshi Hatani1, Yoshinori Yoshida1,
Takuya Yamamoto1,2,3, Hirohide Saito1,**
*:筆頭著者、**:共同責任著者 - 著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
- 京都大学高等研究院ヒト生物学高等研究拠点(WPI-ASHBi)
- 理化学研究所 革新知能統合研究センター(AIP)
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会(JSPS)科学研究費用助成事業(JP20H05626)
科学研究費補助金「特別推進研究」:「RNAを基盤とする合成生命システムの創成」 - AMED再生医療実現拠点ネットワークプログラム「iPS細胞研究中核拠点」
- AMED橋渡し研究戦略的推進プログラム「シーズA」
- 新化学技術推進協会(JACI)新化学技術研究奨励賞
7. 用語説明
注1) マイクロRNA(miRNA)
20〜25塩基程度の長さの短いノンコーディング(タンパク質をコードしていない)RNA。相補的な配列を持つmRNA(メッセンジャーRNA)と結合して翻訳を抑制したり、mRNAを分解したりすることで、その遺伝子の発現を抑制する働きをもつと考えられている。
注2) mRNA
メッセンジャー(伝令)RNAのこと。DNA上の遺伝子情報はmRNAに転写された後、mRNAからタンパク質となり(翻訳され)、細胞内で機能する。
注3)HeLa細胞
ヒト由来の最初の細胞株。ヒト子宮頸がんから分離され株化された細胞で、世界中で広く利用されている細胞の1つ。
注4)293FT細胞
ヒト胎児の腎由来の細胞株の一種。細胞実験にてよく用いられる。
注5) フローサイトメーター
細胞一つ一つに対してレーザーを照射し、蛍光を観察することができる流動細胞計測法の装置。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の大きさ、DNA量などを解析することや、細胞の生物学的特徴を識別して細胞を選別することができる。
注6)アポトーシス
細胞死の1つで、細胞内の何らかの異常に反応して起こるプログラムされた細胞死。
注7)ポリA鎖
mRNAには方向があり、タンパクの合成は5’末端から3’末端に進む。3’末端にはポリA鎖(ポリアデニル酸鎖)と呼ばれる、RNA塩基のアデニンのみが繋がった構造が付加される。ポリA鎖はタンパク合成の開始や終結を促したり、mRNAを安定化する役割を持っている。
注8)リボヌクレアーゼ(RNase)
RNAを分解する酵素。
注9)継代培養
培養した細胞を新しい容器に移し替えて、継続して培養を維持すること。死んだ細胞は基本的に浮いて培地交換などで消えていくが、死んでも接着している残骸も存在するため、継代によって張り付いている残骸を取り除くことで純化が増すと考えられる。
注10)RNA-seq解析
高速シーケンサーを用いてRNA のシーケンシング(配列情報の決定)を行い、細胞内で発現するトランスクリプトーム(細胞内の全転写産物・全RNA)の定量を行う解析。