脳室面にくっついた神経細胞の足をDSCAMタンパク質が切り剥がす
2020-09-03 国立精神・神経医療研究センター
国立研究開発法人国立精神・神経医療研究センター(NCNP)神経研究所、病態生化学研究部の有村奈利子リサーチフェロー、星野幹雄部長らの研究グループは、生まれたての神経細胞が旅立つための最初期段階メカニズムとして、「DSCAM1)タンパク質が神経細胞の足の接着を脳室面から切り剥がす働きを持つこと」を発見しました。
哺乳類の脳には、膨大な数の神経細胞が存在し、それぞれの細胞は決まった場所でお互いに連結して神経回路を作っています。神経細胞は脳室(脳脊髄液で満たされた空間)表面に存在するラディアルグリア細胞2)から生まれますが、生まれた直後は神経細胞の足(終足と呼ばれます)が脳室面に接着した状態です。この接着が剥がされてはじめて神経細胞は移動を開始し決められた場所にたどり着くのですが、この過程がうまくいかないと神経発達障害や機能低下、てんかんの原因となります。しかしながら、神経細胞発生の最初期段階ともいえるこの「終足離脱」がどのような分子メカニズムで制御されているのかは、今までよくわかっていませんでした。
本研究グループは、脳発達時期の中脳において、DSCAMタンパク質が神経細胞の終足に濃縮してくることやDSCAMの機能を阻害すると終足が脳室面から剥がれなくなることなどを見出し、DSCAMが終足の離脱に関与していることを明らかにしました。さらに、様々な解析から、DSCAMタンパク質が、RAPGEF2タンパク質と結合することでRAP1タンパク質の活性を低下させ、その結果として終足の接着を維持している細胞接着分子3)Nカドヘリンタンパク質の量を減らすことで、終足の離脱を促進していることが明らかになりました。本研究は、神経細胞発生の最初期段階分子メカニズムを解明しただけでなく、その異常によってもたらされる様々な神経発達障害の理解にも繋がると考えられます。
この研究成果は、日本時間2020年 9月 3日(木)午前 3時(米国東部標準時 2020年 9月 2日午後2時)に科学誌Science Advances オンライン版に掲載されました。
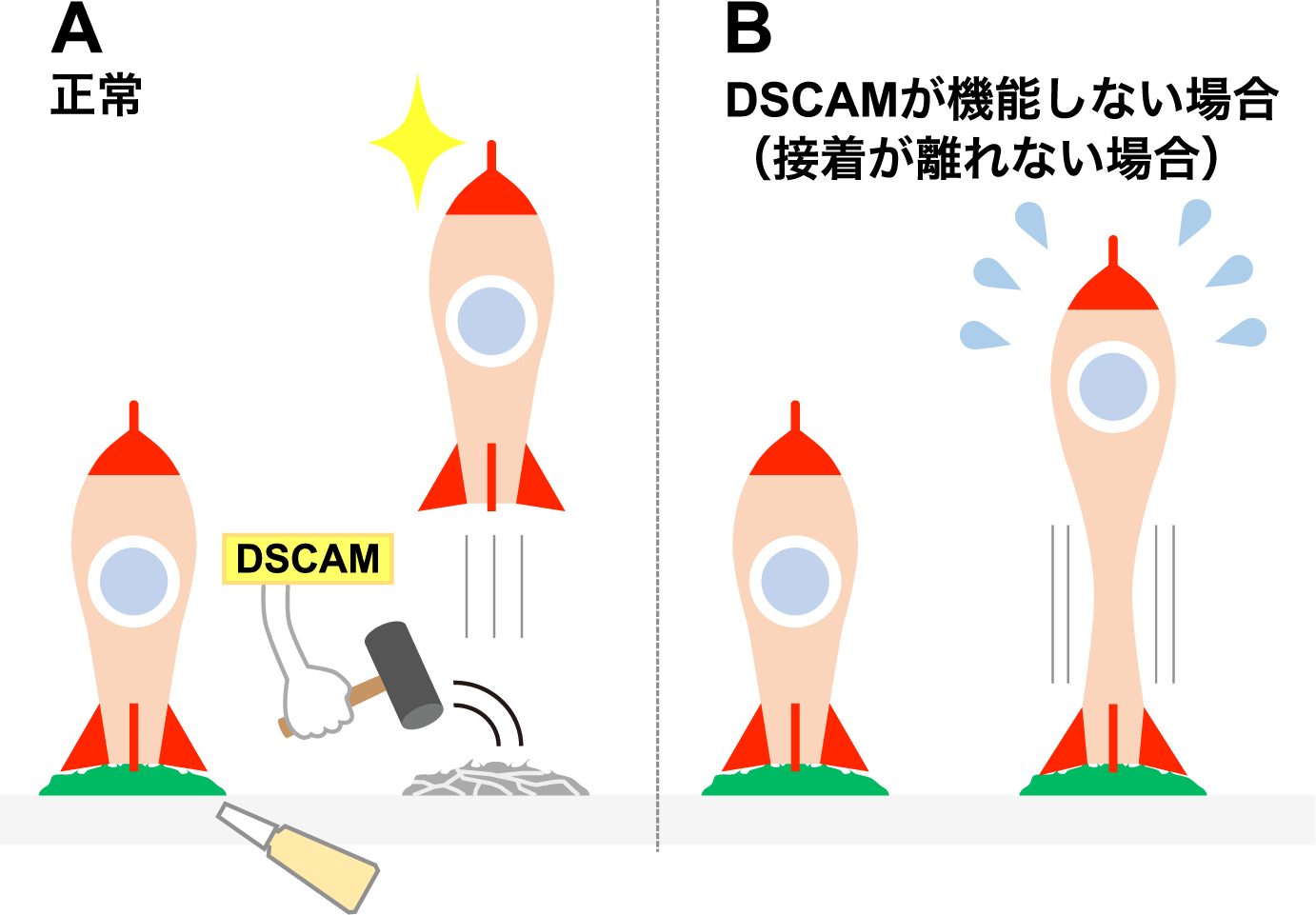
図1:(A) 正常な状態では、生まれたての神経細胞(図中:ロケット)は、脳室面に接着剤(緑)でつなぎとめられているが、ほどなくして接着が壊れ(灰色)、正しい場所へと旅立つ。今回、DSCAMがこの接着剤を壊し、ロケットを剥がす機能を持つことが明らかとなった。(B) DSCAMがうまく機能しないとこの接着材が剥がれずに、神経細胞は正しい場所に移動できない。
研究の背景
脳が発達する時、脳奥深くの脳室面でラディアルグリア細胞が分裂して神経細胞を生み出します。生まれたての神経細胞は「終足 (endfoot・エンドフット)」と呼ばれる足のような構造体を伸ばして脳室表面にぴったり接着しています。この接着部分はほどなく剥がれて、神経細胞は正しい位置へと移動を開始します。この「神経細胞の旅立ち」がうまくいかないと、神経細胞が正しい位置に配置されず、各種精神疾患やてんかんの原因・誘引となると言われています。そのため、この「終足の接着を剥がす」過程は神経発達においてとても重要なステップと考えられて来ており、その背後にある分子メカニズムについて世界中で研究が進められました。その結果、この「足の接着」にはNカドヘリンという「接着剤タンパク質」が働いていることがわかりましたが、「いかにしてこの接着剤を剥がすのか」という、神経細胞の旅立ちの最初期段階のメカニズムについてはほとんど何も明らかにされていませんでした。
研究の内容
(1) 神経細胞だけを可視化し、その形の変化や移動を観察する方法の開発
本研究グループは、大脳に比べて構造と発生が比較的単純でさらに遺伝子導入しやすいという理由から、「中脳」をモデル系として研究することにしました。また、脳室表面にはラディアルグリア細胞と生まれたての神経細胞とが入り乱れて密集しているため、本研究を遂行するためには、神経組織の中で神経細胞だけを色分け標識する必要がありました。そこでまず、子宮内電気穿孔遺伝子導入法4)とCre-LoxPゲノム組換え法を組み合わせることによって、神経細胞だけを色分けする方法を開発しました。さらに、この中脳組織をスライス培養して経時(タイムラプス)動画レコーディングすることによって、生まれたての神経細胞(紫色の構造物)の終足が脳室面に接着する様子や、それを剥がして神経細胞が上方へと移動を開始する様子を詳細に観察することが可能となりました(図2)
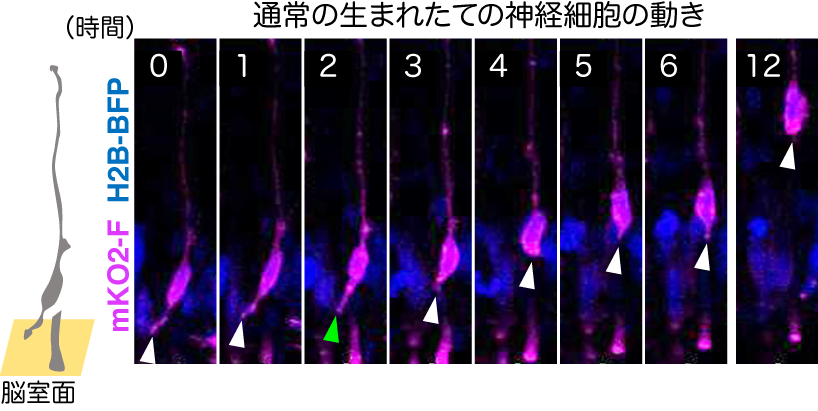
図2:子宮内電気穿孔法とCre-LoxPゲノム組換え法による神経細胞の可視化(紫)。左端の灰色の細胞は、0時間の細胞の形を描き出したもの。脳室面に短い突起が付着している(写真中の白矢印)。ラディアルグリアでは紫色に標識されないが、神経細胞へ分化したらすぐに紫色で標識されるようになる。通常(対照群)は、終足と呼ばれる神経細胞の短い突起(白い矢頭)が脳室面に接着しているが、ほどなくして脳室面から剥がれ、上方へと移動する(緑矢頭)。
(2) DSCAMタンパク質が神経細胞の足を剥がす機能を持つことを発見
この方法を使って神経細胞の終足を可視化し、さらにこの部分に集積するタンパク質について調べたところ、終足の先端部分、つまり接着部分の近傍にDSCAMというタンパク質が濃縮していることを見出しました。次に、子宮内電気穿孔遺伝子導入法を用いてノックダウンベクターを遺伝子導入することでDSCAMタンパク質の機能を阻害(ノックダウン)し、生まれたての神経細胞の振る舞いを動画観察しました(図3A)。すると、DSCAMの機能を阻害した神経細胞では、終足を脳室表面から剥がすことができず(図3A黄矢頭、図3C)、終足が長く引き伸ばされてしまいました(図3B)。この引き伸ばされた終足は、なかなか脳室面から引き剥がされず、結果として神経細胞が上方へと移動できなくなっていることがわかりました。
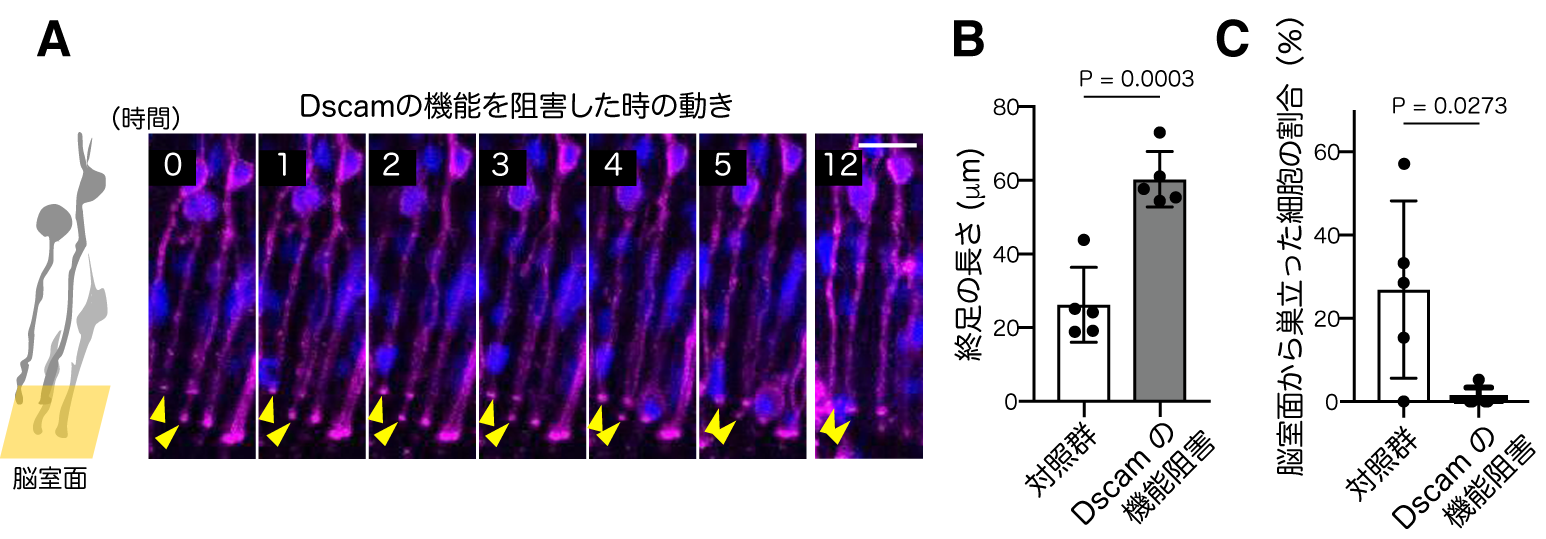
図3 (A) 図2と同様の方法で、DSCAMを機能阻害(ノックダウン)した時の細胞の動き。左端の灰色の細胞は、0時間の細胞の形を描き出したもの。DSCAMの機能阻害によって終足が剥れずに引き伸ばされる。結果として神経細胞の上方への移動が阻害されることになる。(B)終足の長さ。(C)脳室面から旅立った神経細胞の割合(%)。
(3)DSCAMが神経細胞の終足を剥がすための分子メカニズム
これまでの海外の研究により、神経細胞の終足は、Nカドヘリンという接着剤の働きをするタンパク質によって脳室面へと繋ぎ止められている、ということがわかっていました。本研究グループは、DSCAMの機能を阻害すると終足の脳室への接着面におけるNカドヘリンの量が増加することを見出しました。このことから、「DSCAMは、終足の先端に集まり、その場所でのNカドヘリンという接着剤を減らすことで、終足を剥がしているのだろう」ということがわかりました。では、DSCAMはいかにしてその部分におけるNカドヘリンの量を減らしているのでしょうか? 本研究グループはこの謎を調べるために、DSCAMと結合して共に機能する分子をプロテオミクスという手法を用いて探索しました。その結果、RapGEF2という細胞内タンパク質がDSCAMの細胞内部分と結合することがわかりました。RapGEF2は低分子量Gタンパク質Rap1の活性化因子ですが、DSCAMと結合するとそのRap1活性化機能が大きく損なわれることを見出しました。もともとRap1がNカドヘリンの接着剤としての機能を高めることは知られていましたので、「DSCAMがRapGEF2に結合してRap1活性が低下すると、Nカドヘリンという接着剤が減少して、その結果として終足が脳室面から剥がれる」のではないか、と考えられました(図4)。実際に、DSCAMの機能を阻害(ノックダウン)すると終足の離脱障害が生じるわけですが、この障害はさらにNカドヘリンやRapGEF2の機能を阻害する(ダブルノックダウン)ことで解消されるということが観察されました。これは、中脳の実際の神経細胞でも、DSCAMの下流シグナルとしてRapGEF2やNカドヘリンが働き、終足の離脱を調節しているということを意味していました。
以上の我々の研究結果により、(i)新しく生まれた神経細胞の終足の先端部分にDSCAMが集積し、(ii)そこでRapGEF2に結合してその機能を阻害することでRap1の活性を低下させ、(iii) Nカドヘリンの接着剤としての働きを低下させることで、(iv) 終足の離断と神経細胞の移動を開始させる、ということが明らかにされました(図3)。
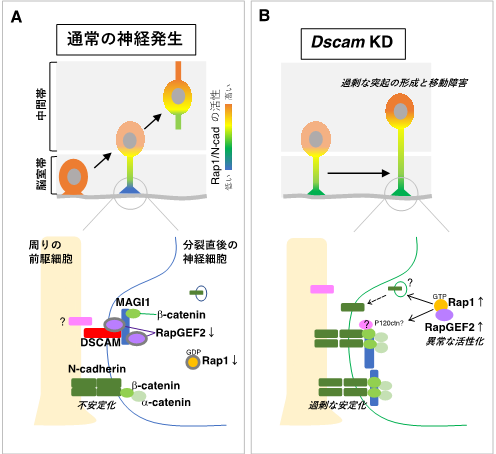
図4 生まれたての神経細胞の足が脳室面から剥がれる仕組み(モデル)
(A) 通常の神経細胞は、ラディアルグリアから生まれた直後には短い突起(終足)を伸ばして脳室面に接着している(灰色丸の部分)。すぐにこの部分にDSCAM(赤棒)が集積し、RapGEF2に結合することでその機能を抑制し、その場所におけるRap1の活性を低下させる。その結果、接着面におけるNカドヘリンの量が減少し、終足の接着が剥がれて、神経細胞は上方へと移動を開始する。 (B) Dscamの機能を阻害(ノックダウン)すると、RapGEF2やRap1への機能抑制ができなくなり、結果としてNカドヘリンの量が減らないために、終足の接着がなかなか剥がれなくなる。神経細胞の細胞体(核とその周りの部分)はそれでも少しは上方へと移動するため、終足が極端に長く伸びることになる。また、結果として神経細胞の移動は大きく損なわれる。
研究の意義と今後の展望
正常な脳神経系を作るためには、神経細胞が正しい場所に配置されることが必要です。今回の研究は、その神経細胞移動という重要な発生過程の最初期段階メカニズムを明らかにしたという点で、大きな意義があります。また、この過程がうまくいかないと様々な自閉症やてんかんの原因となると言われていますので、今回の研究成果は病態の理解や治療法の開発にもつながることが期待されます。
用語解説
1)DSCAM
神経細胞に発現する一回膜貫通型の細胞膜タンパク質。ダウン症の神経症状に関係するという説もあるが、まだよくわかっていない。ショウジョウバエなどの無脊椎動物やマウス、ヒトなどの脊椎動物などで、神経細胞の配置や神経突起・シナプス形成などに関与することが知られている。しかし、神経細胞の脳室面からの離脱に関わるということが示されたのは、今回の研究が初めてである。
2)ラディアルグリア(細胞)
脳室に面した場所で細胞分裂を繰り返すことで神経細胞を生み出す、一種の神経前駆細胞。生み出された神経細胞はそれ以上細胞分裂せず、所定の場所まで移動・定着し、その後、神経回路を構成する。
3)細胞接着分子
細胞膜表面に存在して、細胞と細胞をつなぎ合わせる性質を持つタンパク質。代表的な分子群として、カドヘリンファミリーが知られている。Nカドヘリンはカドヘリンファミリーの一種。
4) 子宮内電気穿孔遺伝子導入法
子宮内の胎児の脳内にDNA溶液を注入し、その後電気ショックを加えることによって、発達期の脳組織に遺伝子導入する方法。マウスを含む哺乳類の脳発生は母体の子宮内で進むため、ある特定の遺伝子の機能を調べるためには、子宮内の胎児組織に遺伝子導入する必要があるため、この方法が用いられる。
原論文情報
・ 論文名: DSCAM regulates delamination of neurons in the developing midbrain
・ 著者: Nariko Arimura, Mako Okada, Shinichiro Taya, Ken-ichi Dewa, Akiko Tsuzuki, Hirotomo Uetake, Satoshi Miyashita, Koichi Hashizume, Kazumi Shimaoka, Saki Egusa, Tomoki Nishioka, Yuchio Yanagawa, Kazuhiro Yamakawa, Yukiko U. Inoue, Takayoshi Inoue, Kozo Kaibuchi, Mikio Hoshino
・ 掲載雑誌: Science Advances
・ DOI: 10.1126/sciadv.aba1693
・ URL:https://www.science.org/doi/10.1126/sciadv.aba1693
助成金
本研究成果は、以下の事業・研究領域・研究課題によって行われました。
― 文部科学省科学研究費補助金新学術領域研究「個性創発脳」(15H01304 、16H06528 )、基盤研究(B)(16H06528、18H02538、19H03536)、基盤研究(C)(17K07126、17J40150)、挑戦的萌芽研究(15K14337)
― 国立精神・神経医療研究センター 精神・神経疾患研究開発費
― 国立研究開発法人 日本医療研究開発機構(AMED)難治性疾患実用化研究事業(20dm0107085h0005)
― 公益財団法人 内藤記念科学振興財団公益財団法人
― てんかん治療研究振興財団
お問い合わせ先
【研究に関するお問い合わせ】
有村 奈利子・星野 幹雄
国立精神・神経医療研究センター神経研究所 病態生化学研究部
【報道に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター
総務課広報係