2024-06-27 国立がん研究センター,日本臨床腫瘍研究グループ
発表のポイント
- 切除可能な進行食道がんの術前化学療法について、日本の標準治療である2剤併用化学療法(CF療法)と、より強力な抗がん剤をCF療法に加えた3剤併用化学療法(DCF療法)、CF療法に放射線治療を加えた欧米の標準治療である化学放射線療法(CF+RT療法)の3つの治療の生存期間を第III相臨床試験で比較しました。
- 本試験の結果、DCF療法がCF療法に対して生存期間を有意に延長することが示され、DCF療法が日本における切除可能な食道がんの術前化学療法の標準治療であると結論付けました。
- CF+RT療法に関しては、CF療法に対する生存期間の延長を示せず、また食道がん以外の他病死を誘発している可能性が示唆されました。
- 研究成果は世界的5大医学誌のひとつである英国学術雑誌「The Lancet」に掲載され、欧米の標準治療に一石を投じ、世界的な食道がん治療の潮流を変えるターニングポイントとなりました。
- さらに2年追跡後の結果を、2024年米国臨床腫瘍学会(ASCO)で報告し、DCF療法がCF療法に対して生存期間を有意に延長したことが、再度確認されました。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)中央病院(病院長:瀬戸 泰之)が中央支援機構(データセンター/運営事務局)を担い支援する日本臨床腫瘍研究グループ(JCOG(ジェイコグ):Japan Clinical Oncology Group)では、科学的証拠に基づいて患者さんに第一選択として推奨すべき治療である標準治療や診断方法等の最善の医療を確立するため、専門別研究グループで全国規模の多施設共同臨床試験を実施しています。
JCOG食道がんグループでは、切除可能な進行食道がん(扁平上皮癌)患者さんに対する術前化学療法について、日本の標準治療であるシスプラチン+5-FU(CF療法)と、より強力な抗がん剤ドセタキセルをCF療法に加えたドセタキセル+シスプラチン+5-FU(DCF療法)、欧米の標準治療であるCF療法+放射線治療(CF+RT療法)を食道切除に加えた治療法の生存期間を比較する第III相臨床試験を実施しました。
本試験の結果、術前化学療法として術前DCF療法を受けた患者さんが術前CF療法を受けた患者さんに比べ生存期間が長く、5年以上の経過観察においても同様の結果であることがわかりました。一方、術前CF+RT療法を受けた患者さんは、術前CF療法と比較し生存期間の延長は認められませんでした。また、術前CF+RT療法は他病死を誘発している可能性が示唆されました。そのため切除可能な進行食道がん患者さんに対しては、術前DCF療法に続く食道がん切除が新たな標準治療であると結論付けました。
本試験の結果は英国時間2024年6月11日(日本時間6月12日)付で世界的5大医学誌のひとつである英国学術雑誌「The Lancet」に掲載され、欧米の標準治療に一石を投じました。今回の試験が、世界的な食道がん治療の潮流を変えるターニングポイントとなっています。
背景
食道がんは食道の粘膜にある細胞ががん化することで発症するがんです。日本における食道がんの組織型としては、食道の粘膜の最も内側に発生する扁平上皮癌が90%弱を占めており、逆流性食道炎によって発生し欧米に多いとされる腺癌は7%程度です。JCOG9907試験の結果から術前CF療法による化学療法が標準治療とされていましたが、食道がんは依然予後の悪いがんであり*、より強力な術前治療の開発が必要とされていました。
一方、欧米においては、外科的治療を避け、より局所的な治療を好む傾向から、化学療法に放射線治療を組み合わせた化学放射線療法が標準治療となっていました。しかし、食道はその構造的な理由から放射線治療を行うと、その周辺臓器である肺や心臓への後発的な副作用が認められることが知られています。
今回の試験では切除可能な進行食道がんに対して、標準治療である術前CF療法と、より強力な細胞傷害性抗がん剤であるドセタキセルをCF療法に加えた術前DCF療法の比較と、日本と欧米の標準治療の比較を目的として計画しました。
*参考…食道がんと他がん種の5年生存割合
| がん種 | I期 | II期 | III期 | IV期 |
|---|---|---|---|---|
| 食道がん | 78.4 | 48.9 | 27.4 | 8.7 |
| 大腸がん | 92.3 | 85.5 | 75.5 | 18.3 |
| 胃がん | 92.8 | 67.2 | 41.3 | 6.3 |
出典:国立がん研究センター院内がん登録2014-2015年5年ネット・サバイバル
研究方法
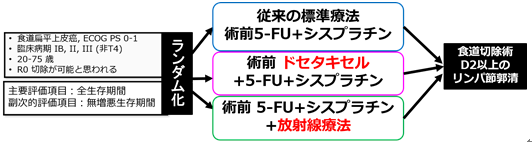
切除可能な進行食道がん患者さんを対象に、標準治療である術前シスプラチン+5-FU(CF療法)に対する、3剤併用術前化学療法(ドセタキセル+シスプラチン+5-FU(DCF療法))と、術前化学放射線療法(シスプラチン+5-FU+放射線療法41.4Gy(CF+RT療法))の優越性をランダム化第III相試験で検討しました。
研究名称
JCOG1109:臨床病期IB/II/III食道がん(T4注1を除く)に対する術前CF療法/術前DCF療法/術前CF+RT療法の第III相比較試験
図1 臨床試験のシェーマ
対象とした患者さん
- 臨床病期IB、IIまたはT4を除くIII期(UICC TNM分類第7版)で、扁平上皮癌、腺扁平上皮癌、類基底細胞癌と診断されている胸部食道がん
- 年齢が20歳以上、75歳以下
- 他のがん種を含め、化学療法、放射線療法、内分泌療法の既往がない
- 適切な臓器機能を有する
- 食道がん根治切除術が可能と判断されている
- 試験参加について本人から同意が得られている
実施期間
2012年12月5日~2018年7月20日
参加人数
601名
治療内訳
- CF療法群:術前CF療法(3週1コース×3コース)
CF療法
シスプラチン 80 mg/m2(day1)、5-FU 800 mg/m2/day(day1-day5)
食道切除術+D2以上リンパ節郭清
- DCF療法群:術前DCF療法(3週1コース×3コース)
DCF療法
ドセタキセル70 mg/m2(day1)、
シスプラチン 70 mg/m2(day1)、5-FU 750 mg/m2/day(day1-day5)
食道切除術+D2以上リンパ節郭清
- CF+RT療法群:術前CF+放射線療法(4週1コース×2コース)
CF+放射線療法
シスプラチン 75 mg/m2(day1)、5-FU 1000 mg/m2/day(day1-day4)、
放射線1回1.8 Gy、1日1回、週5日、計23回、総線量41.4 Gy
食道切除術+D2以上リンパ節郭清
主要評価項目
全生存期間
副評価項目
無増悪生存期間、術前療法における奏効割合、病理組織学的完全奏効割合、有害事象発生割合など
本試験の詳細は、以下よりご確認いただけます。
臨床研究実施計画・研究概要公開システム
- https://jrct.mhlw.go.jp/latest-detail/jRCTs031180202(外部サイトにリンクします)
結果
3つの治療をより正確に評価するために、参加された患者さんを3群にランダムに割り付けました。最終的にCF療法群199名、DCF療法群202名、CF+RT療法群200名の患者さんの治療結果を比較することができました。患者さんの年齢の中央値は64-65歳で3群ともほぼ同等で、病期に関しても明らかな差はみられず、患者さんの背景に大きな違いは認めませんでした。
主要な評価項目である生存期間の中央値は、CF療法群が5.6年、DCF療法群は多くの患者さんが生存されており中央値は未到達、CF+RT療法群が7.0年と、統計学的にDCF療法群がCF療法群に対して生存期間が上回りました[ハザード比(HR)=0.68(95%信頼区間:0.50-0.92)、p=0.006] (図2a)。一方でCF+RT療法群に関しては、CF療法群を上回りませんでした[HR=0.84(95%信頼区間:0.63-1.12、p=0.12)] (図2b)。また3年後に生存されている患者さんの割合は、CF療法群が62.6%、DCF療法群が72.1%、CF+RT療法群が68.3%でした(図2a、図2b)。
また、死亡された患者さんの中で、死因をそれぞれの群別にみると、食道がんの再発に伴う死亡がCF療法群は75.5%、DCF療法群は79.7%なのに対し、CF+RT療法群では64.0%、一方で、肺炎や、心臓疾患などがん以外の他の病気でなくなった(他病死)と判断される患者さんの割合はCF療法群で13.3%、DCF療法群で9.5%、CF+RT療法群では25.8%でした(表1)。
また、観察期間5年終了時の最終解析の結果が2024年の米国臨床腫瘍学会(ASCO)で報告され、CF療法群に対し、DCF療法群は引き続き有意に生存期間が良好でした(HR=0.68(95%信頼区間:0.51-0.91、p=0.004)(5年生存割合51.9% vs. 65.1%)。CF+RT療法群は、引き続き、CF療法群に対する有意差を示すことができませんでした(HR=0.86(95%信頼区間:0.66-1.14、p=0.15)(5年生存割合51.9% vs. 60.2%)。
図2a 術前DCF療法と術前CF療法の全生存期間と3年生存割合の比較
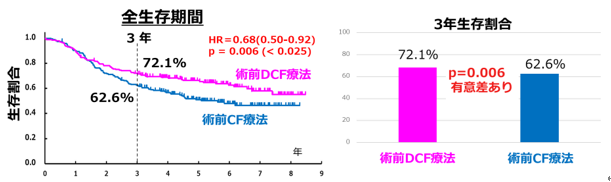
図2b 術前CF+RT療法と術前CF療法の全生存期間の比較と3年生存割合の比較
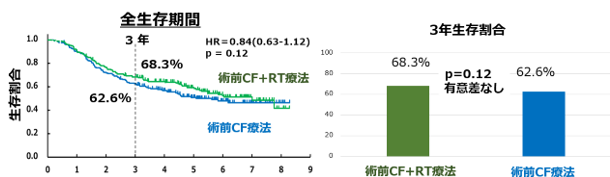
表1 観察期間3年終了後の生存者と死亡者と死因
| 術前CF療法群
(199名) |
術前DCF療法群
(202名) |
術前CF+RT療法群
(200名) |
||
|---|---|---|---|---|
| 生存者 | 101(50.8%) | 128(63.4%) | 111(55.5%) | |
| 死亡者 | 98(49.2%) | 74(36.6%) | 89(44.5%) | |
| 死亡原因 | ||||
| 食道がん | 74(75.5%) | 59(79.7%) | 57(64.0%) | |
| 他病死 | 13(13.3%) | 7(9.5%) | 23(25.8%) | |
| 治療関連死 | 3(3.1%) | 4(5.4%) | 2(2.2%) | |
| その他 | 2(2.0%) | 3(4.1%) | 0(0.0) | |
| 不明 | 6(6.1%) | 1(1.4%) | 7(7.9%) | |
術前治療に関連した副作用については、重篤な好中球減少がCF療法群で23.4%、DCF療法群で85.2%、CF+RT療法群で44.5%でした。発熱性好中球減少症は、CF療法群で1.0%、DCF療法群で16.3%、CF+RT療法群で4.7%と、以前の報告と同様でした。術後の合併症に関しては、肺炎がCF療法群で10.3%、DCF療法群で9.8%、CF+RT療法群で12.9%、吻合部漏出がCF療法群で10.3%、DCF療法群で8.7%、CF+RT療法群で/2.4%、反回神経麻痺がCF療法群で15.1%、DCF療法群で10.4%、CF+RT療法群で9.6%でした。治療関連死はCF療法群で2%、DCF療法群で2%、CF+RT療法群で1%と、いずれも大きな違いは見られず3群とも安全性は許容範囲と考えられました。ただし、術前DCF療法に関しては、重大な副作用である発熱性好中球減少症が他の治療に比べやや多く、特に高齢な患者さんや臓器機能に問題がある患者さんに強く副作用が出ることが分かっており、患者さんと相談しながら注意して治療を行う必要があります。
展望
本試験の結果より、切除可能な進行食道がん(扁平上皮癌、類基底細胞癌、腺扁平上皮癌)患者さんでの術前化学療法は、術前DCF療法が最も生存期間延長効果を期待できる治療で、従来の術前CF療法に替わり標準治療となります。ただし、食道がんの治療では、食事への影響、抗がん剤や手術に伴う副作用、再発の可能性など様々な考慮すべきことがあり、治療法の利点と欠点について、個々の患者さんがよく説明を受けた上で決めることも重要です。
一方で、欧米の標準治療である術前CF+RT療法が、術前CF療法と比べて生存期間を延長できなかったこと、またさらに術前CF+RT療法での心臓病や肺炎など他病死の誘発は、欧米の標準治療に一石を投じる結果となりました。直接の比較ではありませんが、化学療法2剤に対して、局所治療である放射線を併用するよりも、全身治療である抗がん剤を併用した方が、より生存期間を延長することが示唆され、それまで欧米と同じく、術前化学放射線療法が標準治療だった中国でも、食道がん術前治療の標準治療のひとつに術前化学療法が追加されました。また、欧米での検証も進められ、今回の試験結果を追随する結果が出始めています。例えば、食道腺癌に対する術前化学放射線療法と、術前術後に3剤併用化学療法(FLOT療法注2)を行う治療の比較試験(ESOPEC試験注3)が行われ、3剤併用化学療法が有意に生存期間を延長(HR=0.70, 95%信頼区間0.53-0.92、p=0.012)することが、2024年米国臨床腫瘍学会(ASCO)で報告されました。世界的な食道がんの治療法が大きな転換期を迎えており、本試験がそのターニングポイントとなりました。
JCOG食道がんグループでは、現在、術前DCF療法や術前CF療法に、免疫チェックポイント阻害薬であるニボルマブを加えることで、より治療効果を高めることができるかどうかを評価する医師主導治験JCOG1804E「臨床病期T1N1-3M0、T2-3N0-3M0の胸部食道がんに対するCF療法またはDCF療法にニボルマブを併用する術前薬物療法の安全性試験」を行っており、手術の安全性と短期的な治療効果の改善が示されています。また、術前DCF療法後に手術を行い、術後にさらに治療を加えることで予後の改善が可能かを検討するために、JCOG2206「術前化学療法後に根治手術が行われ病理学的完全奏効とならなかった食道扁平上皮癌における術後無治療/ニボルマブ療法/S-1療法のランダム化比較第III相試験」(SUNRISE試験)を開始しています。
発表論文
雑誌名
The Lancet
タイトル
Doublet chemotherapy, triplet chemotherapy, or doublet chemotherapy combined with radiotherapy as neoadjuvant treatment for locally advanced oesophageal cancer (JCOG1109 NExT): a randomised, controlled, open-label, phase 3 trial.
著者
Ken Kato†, Ryunosuke Machida, Yoshinori Ito, Hiroyuki Daiko, Soji Ozawa, Takashi Ogata, Hiroki Hara, Takashi Kojima, Tetsuya Abe, Takeo Bamba, Masaya Watanabe, Hirofumi Kawakubo, Yuichi Shibuya, Yasuhiro Tsubosa, Naoki Takegawa, Takeshi Kajiwara, Hideo Baba, Masaki Ueno, Hiroya Takeuchi, Kenichi Nakamura, Yuko Kitagawa, on behalf of the JCOG1109 investigators (†筆頭著者,責任著者)
掲載日
2024年6月11日(日本時間6月12日)付
DOI
10.1016/S0140-6736(24)00745-1
URL
https://doi.org/10.1016/S0140-6736(24)00745-1(外部サイトにリンクします)
研究費
- 日本医療研究開発機構(AMED)委託研究開発費
革新的がん医療実用化研究事業/局所進行食道癌に対する新しい術前治療を確立する研究 - 国立がん研究センター研究開発費
2020-J-3/成人固形がんに対する標準治療確立のための基盤研究
日本臨床腫瘍研究グループ(JCOG:Japan Clinical Oncology Group)の概要
国立がん研究センター研究開発費、日本医療研究開発機構研究費を主体とする公的研究費によって助成される研究班を中心とする多施設共同臨床研究グループで、がん診療連携拠点病院を中心とした医療機関の研究者で構成される専門分野別研究グループと国立がん研究センターが管轄する中央支援機構(国立がん研究センター中央病院臨床研究支援部門)、各種委員会から構成されており、法人格を有さない任意団体です。
JCOGウェブサイト: http://www.jcog.jp/index.html(外部サイトにリンクします)
用語解説
注1 T4
食道がんの深達度を示します。T1aからT4に分類され、T4はがんが食道周囲の臓器(肺、大動脈、気管など)にまで明らかに広がっている状態で、切除はできません。
注2 FLOT療法
5-FU、ロイコボリン、オキサリプラチン、ドセタキセルを組み合わせた治療です。2週間毎に、4回、術前あるいは術後に投与されます。
注3 ESOPEC試験
ドイツで行われた試験で、食道腺癌、食道胃接合部腺癌438名に対し、術前化学放射線療法を行うCROSS群と、術前術後にFLOT療法を行うFLOT群を比較したランダム化第III相試験です。主要評価項目の生存期間において、FLOT群がCROSS群に比して(HR=0.70(95%信頼区間:0.53-0.92、p=0.012)有意に生存期間を延長しました。3年生存割合はFLOT群が57.4%、CROSS群で50.7%でした。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター
中央病院 頭頸部・食道内科/消化管内科 加藤 健
患者さんからのお問い合わせ
国立研究開発法人国立がん研究センター
中央病院 がん相談支援センター
電話番号:03-3547-5293 (平日9時から16時)
日本臨床腫瘍研究グループに関するお問い合わせ
国立研究開発法人国立がん研究センター
中央病院 臨床研究支援部門 研究企画推進部 多施設研究支援室
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室