2024-07-11 東京大学
越阪部 晃永(生物科学専攻 特任助教)
角谷 徹仁(生物科学専攻 教授)
滝沢 由政(定量生命科学研究所 准教授)
胡桃坂 仁志(定量生命科学研究所 教授)
発表のポイント
- 遺伝子機能を撹乱するトランスポゾンの抑制に関わるタンパク質DDM1とヌクレオソーム複合体構造のクライオ電子顕微鏡解析に成功しました。
- DDM1がヌクレオソームの「閉じた」構造を“ほどいて開く”様子を明らかにしました。
- 本研究成果は、DDM1によるトランスポゾン上の抑制型エピゲノム修飾維持機構の理解を深めるだけでなく、ヒト由来の相同遺伝子の機能不全を原因とする潜性(劣性)遺伝病発症のメカニズムの解明に貢献することも期待されます。
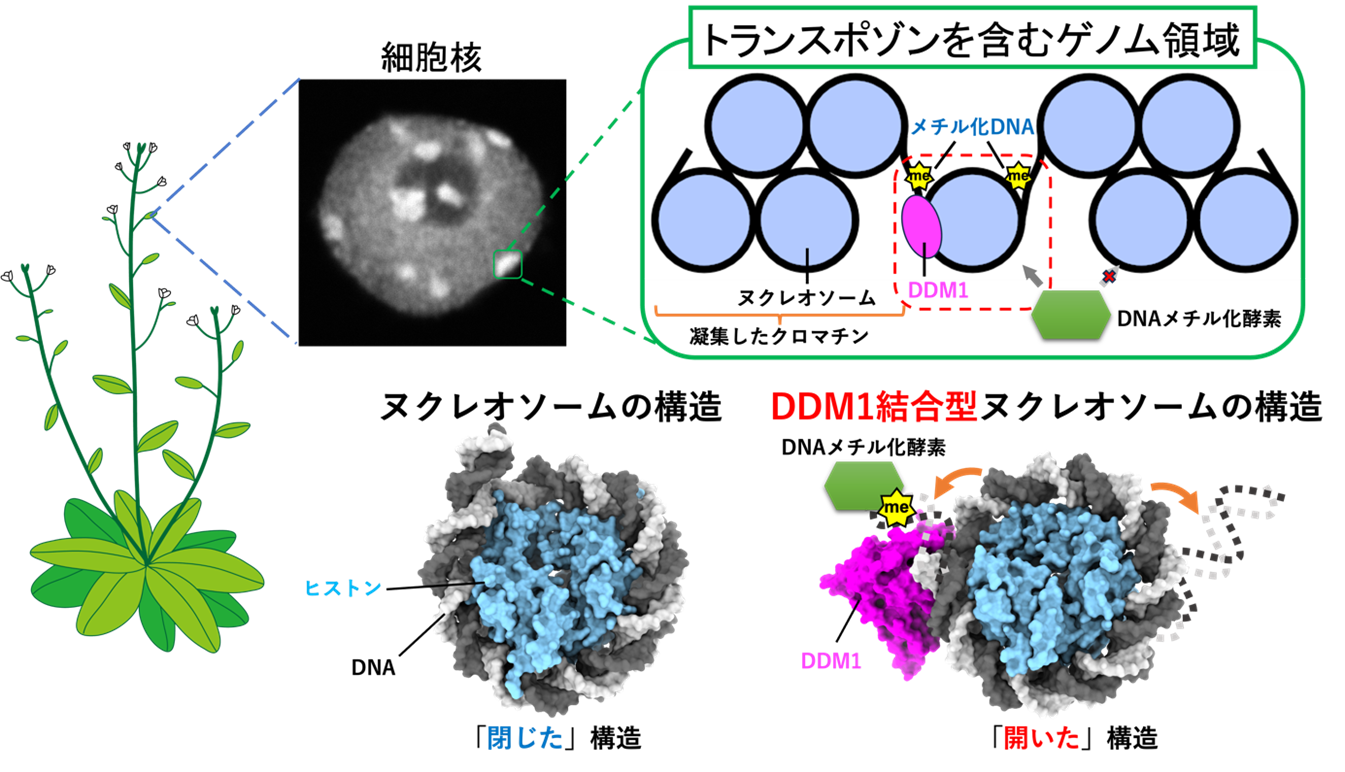
DDM1がヌクレオソームの構造を変換している立体構造を解明
発表概要
東東京大学大学院理学系研究科の越阪部晃永 特任助教、角谷徹仁 教授、同大学定量生命科学研究所の滝沢由政 准教授、胡桃坂仁志 教授らによる研究グループは、トランスポゾン(注1)発現を抑制する、メチル化(注2)DNAなどのエピゲノム(注3)の維持に必要なタンパク質DDM1(Decreased in DNA Methylation 1:注4)がヌクレオソーム(注5)の構造を変換する新規のメカニズムを明らかにしました。
発表内容
研究の背景
動植物の遺伝情報であるゲノムDNAには多くの反復配列が含まれており、その中にはトランスポゾンと呼ばれる可動性遺伝因子が存在します。このトランスポゾンの発現はゲノム進化の原動力となる一方で、隣接する遺伝子の機能を撹乱するリスクも同時にはらんでいます。そのため、生物は、DNAやクロマチン構成因子ヒストンのメチル化、およびヒストンの亜種(注6)などを含む凝集したクロマチン構造(注7)を形成し、トランスポゾンの発現を抑制しています。一方で、クロマチンの基本単位であるヌクレオソームに巻き付いたDNAは、DNAメチル化を触媒する酵素の活性に阻害的であることが報告されています。
変異原処理したモデル植物シロイヌナズナ(注8)を用いたスクリーニングにより、DNAのメチル化維持に必須な因子としてDDM1が角谷徹仁教授を含む研究グループによって30年近く前に同定されました。DDM1の機能を失うことによって、トランスポゾン上のメチル化DNAが失われるだけでなく、大量のトランスポゾンの発現と遺伝子機能の撹乱が観察されていますが、DDM1がどのようにして凝集したクロマチン構造中で機能するかは、長年の謎とされていました。
研究内容
研究グループは、トランスポゾンに蓄積するヒストン亜種の1つであるH2A.Wを含むヌクレオソームを試験管内で再構成し、クライオ電子顕微鏡(注9)によってその立体構造を決定することに成功しました。その結果、H2A.Wに存在する特有の領域が、ヌクレオソーム間を繋ぐリンカーDNAと相互作用して、DNA末端領域を強固にヌクレオソームに巻き込み「閉じた」構造を形成していました。さらに、DDM1との複合体の立体構造もクライオ電子顕微鏡によって決定した結果、H2A.WとリンカーDNAとの相互作用が解消され、ヌクレオソームがほどけて「開いた」構造を形成していたことが今回明らかになりました。
次に、質量分析によってDDM1とヒストンタンパク質との相互作用を網羅的に解析しました。その結果、H2A.Wに特有の領域の結合相手がリンカーDNAからDDM1に変化することで「閉じた」ヌクレオソーム構造がほどけて、ヌクレオソームのDNA末端領域がフレキシブルになった「開いた」構造に変換されることが示唆されました(図1)。
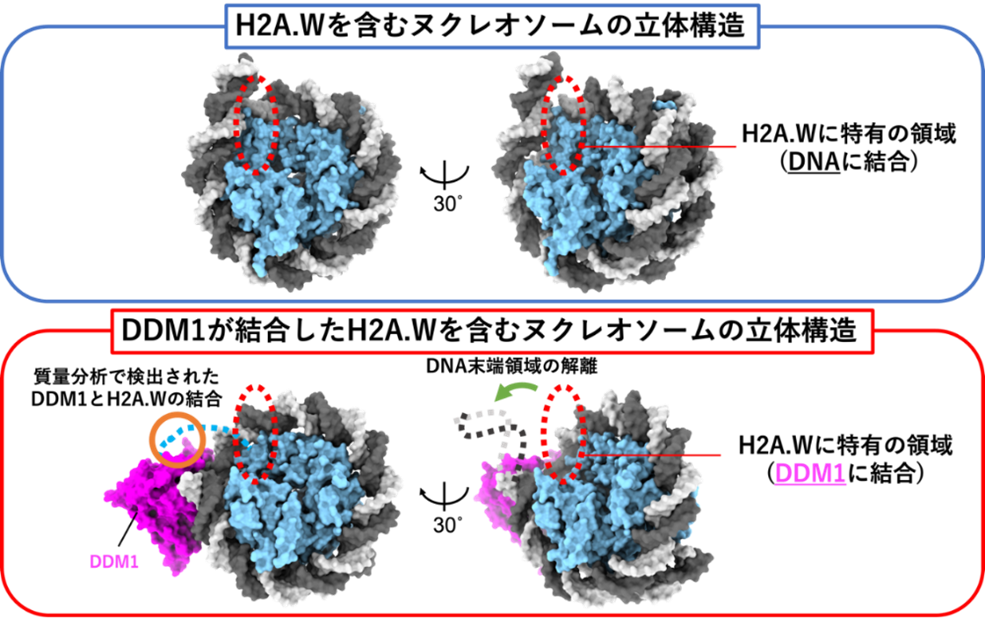
図1:クライオ電子顕微鏡解析および質量分析から明らかになった、DDM1によるヌクレオソーム構造変換機構
本研究で明らかになったDDM1の「ヌクレオソームをほどく」活性は、トランスポゾンを含むDNAのメチル化を触媒する酵素が凝集したクロマチン構造にアクセスするために重要な役割を担っていると考えられます。本研究で解析対象となったDDM1のヒト相同遺伝子として、Helicase, lymphoid specific(HELLS)が存在します。興味深いことに、HELLSも植物由来DDM1と同様に特定のヒストン亜種を標的に機能していることが報告されており、本研究で見出した新規機構は動植物に共通していることが予想されます。特に、HELLSの機能不全が潜性(劣性)遺伝病発症患者で確認されていることから、本研究成果はそのメカニズムの解明にも貢献することが期待されます。
論文情報
- 雑誌名
Nature Communications論文タイトル
Molecular and structural basis of the chromatin remodeling activity by Arabidopsis DDM1著者
Akihisa Osakabe (越阪部晃永) *、Yoshimasa Takizawa(滝沢由政)、Naoki Horikoshi (堀越直樹)、Suguru Hatazawa (畠澤卓)、Lumi Negishi (根岸瑠美)、Shoko Sato (佐藤祥子)、Frédéric Berger (フレデリック・ベルジェ)、Tetsuji Kakutani (角谷徹仁) *、and Hitoshi Kurumizaka (胡桃坂仁志) *
(*責任著者)
研究助成
本研究は、科研費(課題番号:JP21K20628、JP22H05172、JP22H05178、JP22K06098、JP23H05475、JP21H04977、JP23H00365)、日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)(課題番号:JP23ama121009)、The Human Frontier Science Program(HFSP)(課題番号:RGP0025/2021)、科学技術振興機構(JST) 戦略的創造研究推進事業 さきがけ(課題番号:JPMJPR20K3)、戦略的創造研究推進事業 ERATO(課題番号:JPMJER1901)の支援により実施されました。
用語解説
注1 トランスポゾン
自身の配列をコピー&ペーストもしくはカット&ペーストして、ゲノム中で移動することのできるDNA配列のことを指します。バーバラ・マクリントックがトウモロコシを用いた実験によってトランスポゾンを発見し、その功績により1983年にノーベル生理学・医学賞を受賞しました。
注2 メチル化
メチル基がDNA、もしくはリジンやアルギニン残基に付加される化学修飾のことを指します。
注3 エピゲノム
DNAの塩基配列を変えることなく遺伝子の発現を調節する、DNAやヒストンの化学修飾を指します。
注4 DDM1(Decreased in DNA Methylation 1)
シロイヌナズナで同定された変異体に由来し、クロマチン構造の変換に関与するSWI2/SNF2ファミリーに属するタンパク質をコードします。この変異体では、大量のトランスポゾンの活性化とそれにともなう発生異常が観察されます。
注5 ヌクレオソーム
4種類のヒストン(H2A、H2B、H3、H4)がそれぞれ2分子ずつから形成されるヒストン8量体におよそ150塩基対のDNAが巻き付いた円盤状の構造体です。生体内では、このヌクレオソームが数珠状に連なってクロマチンを形成し、遺伝情報であるゲノムDNAを細胞核に収納します。
注6 ヒストン亜種
アミノ酸配列が一部異なり、発現時期、組織、ゲノム上の局在に特異性が観察されるヒストンを指します。
注7 クロマチン構造
ゲノムDNAを細胞の核内に収納するために形成される、核内のタンパク質群とゲノムDNAの複合体を指します。
注8 シロイヌナズナ
アブラナ科シロイヌナズナ属に属する一年草です。そのゲノムのほぼ全ての配列は2000年に解読され、ゲノムサイズの小ささ、世代時間の短さや自殖性であるという特徴から、世界中の研究者が最も多く用いるモデル植物の1つとして知られています。さらに、真核生物のエピゲノムの制御に関わる遺伝子群がほとんど存在することから、シロイヌナズナはエピジェネティクス研究分野で盛んに用いられています。
注9 クライオ電子顕微鏡
凍結試料に-196˚Cの液体窒素冷却下で電子線を照射することで、溶液での状態に近い条件で生体分子の構造を観察することのできる装置を指します。近年の革新的な技術開発により、生体高分子の立体構造を高分解能で決定することが可能になりました。