2024-07-24 東京大学
発表のポイント
- ミトコンドリアをたった1つしか持たない真核生物シゾンを用いることにより、ミトコンドリアへ運ばれるタンパク質が持つ「鍵」と、ミトコンドリア膜タンパク質の「カギ穴」の間にある最もシンプルな関係を明らかにしました。
- 人工的に設計した24個のアミノ酸からなるペプチド配列を用いた細胞実験により、ミトコンドリア移行配列が機能するためには、αへリックス構造のペプチド配列中に1つの塩基性アミノ酸を含むだけで充分であることが明らかになりました。
- ミトコンドリアタンパク質によって行われる代謝反応は多岐に渡り、ミトコンドリアの機能不全は多くの疾患とも関連します。本研究成果は、ミトコンドリアへと運ばれるタンパク質の全貌を解明する糸口となり、基礎生物学のみならずさまざまな医学的研究の基盤を提供します。
ミトコンドリアへ運ぶタンパク質を見極める
発表概要
東京大学大学院理学系研究科の平田莉子大学院生(研究当時)、東山哲也教授、吉田大和准教授らの研究グループは、細胞質からミトコンドリア(注1)へと運ばれるタンパク質を区別する最も基本的なルールを明らかにしました。従来、ミトコンドリアへと運ばれるタンパク質が持つペプチドタグ(注2)が機能するためには、両親媒性(注3)などの物理化学的性質が重要であると考えられていました。しかしミトコンドリアを1つしか持たない単細胞紅藻シゾン(注4)を用いた細胞実験により、ミトコンドリア標的配列が機能するためには、両親媒性ではなくαへリックス(注5)の中に少なくとも1つの塩基性アミノ酸を含むことが重要であることがわかりました。ミトコンドリアへタンパク質を輸送するシステムは、ミトコンドリアというオルガネラの誕生にも関わる極めて重要な分子機構です。本研究は、単純な細胞構造を持つ生物だからこそ明らかにできた、真核細胞(注6)の普遍原理の一端を示します。
発表内容
研究の背景
ミトコンドリアは、もともとは別の生き物として生活していたバクテリアが、今から約25億年前に真核生物の祖先に取り込まれた結果誕生したと考えられています。こうした進化的経緯を持つため、ミトコンドリアには今でもDNAおよび独自の遺伝子発現機構が残っています。しかし、進化の過程で多くのミトコンドリア遺伝子はミトコンドリアDNAから真核生物の細胞核DNAへと移動し、今ではミトコンドリアを構成するタンパク質の99%は細胞核DNAの遺伝子に由来すると言われています。このためミトコンドリアで利用される多くのタンパク質は、細胞質で生産された後にミトコンドリア内へと運ばれる必要があります。無数に存在するタンパク質の中でミトコンドリアへと輸送するタンパク質を見分けるため、タンパク質を構成するアミノ酸配列の先頭部分に特徴的なペプチド配列で構成されたタグ(ミトコンドリア移行配列)が付加されます。このタグを持つタンパク質はミトコンドリア膜上へと運ばれ、膜透過装置と呼ばれる巨大なミトコンドリア膜タンパク質複合体によって識別され、ミトコンドリア内へと取り込まれます。しかしミトコンドリア移行配列には決まった配列パターンがなく、生物種によっても大きく傾向が異なります。このため、「なぜ、細胞内に無数に存在するタンパク質の中から正確に新生ミトコンドリアタンパク質が識別され、適切に輸送されるのか」は未だ十分に明らかではありませんでした。
多くの真核生物では1細胞あたりに多数のミトコンドリアを含み、ミトコンドリアの細胞内位置は常に変化しています。研究グループは、ミトコンドリア移行配列が持つ“暗号情報”は、ミトコンドリアの数や位置のバリエーションが多いほど複雑化するのではないかと考え、本研究ではミトコンドリアを1つしか持たない単細胞紅藻シアニディオシゾン(シゾン)を用いて解析を行いました(図1)。
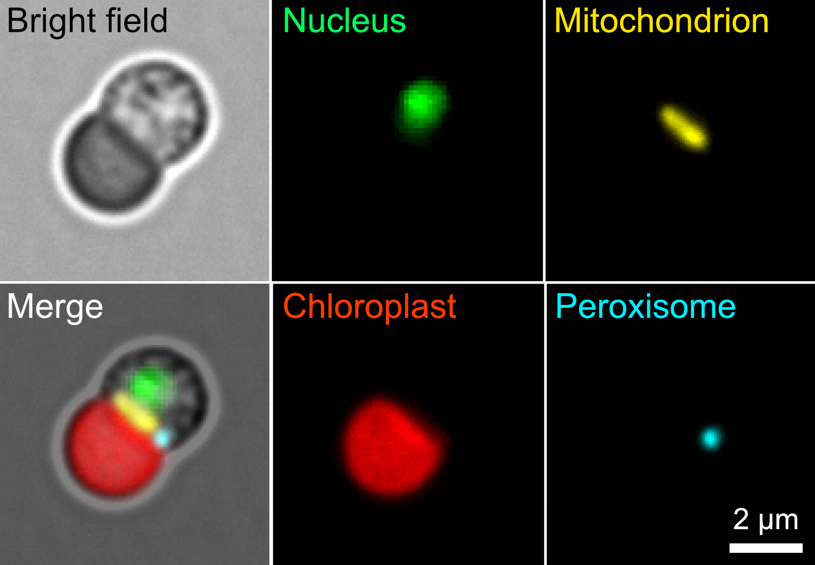
図1:単純な細胞構造からなる真核生物シゾンの蛍光顕微鏡像
研究内容と成果
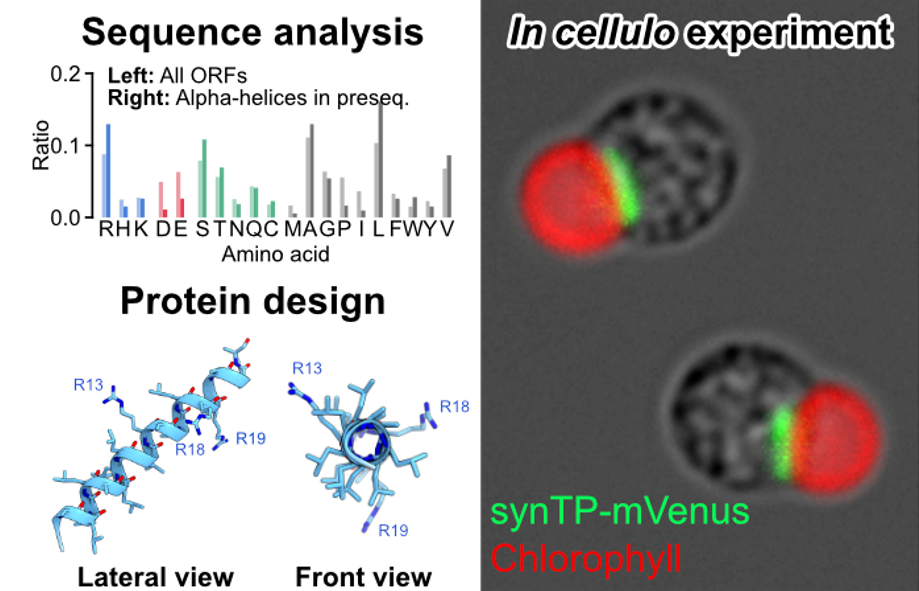
ミトコンドリアタンパク質として良く知られている113タンパク質種の推定ミトコンドリア標的配列を用いた構造シミュレーション解析(注7)により、ミトコンドリア移行配列は1つのαヘリックス構造を含む傾向が確認されました。またヘリックス構造を構成するアミノ酸は全タンパク質の平均アミノ酸組成とは異なっており、アルギニン、セリン、アラニン、ロイシンの割合が多く、逆にアスパラギン酸、グルタミン酸、プロリン、イソロイシンは少ない特徴的なアミノ酸組成となっていました(図2)。
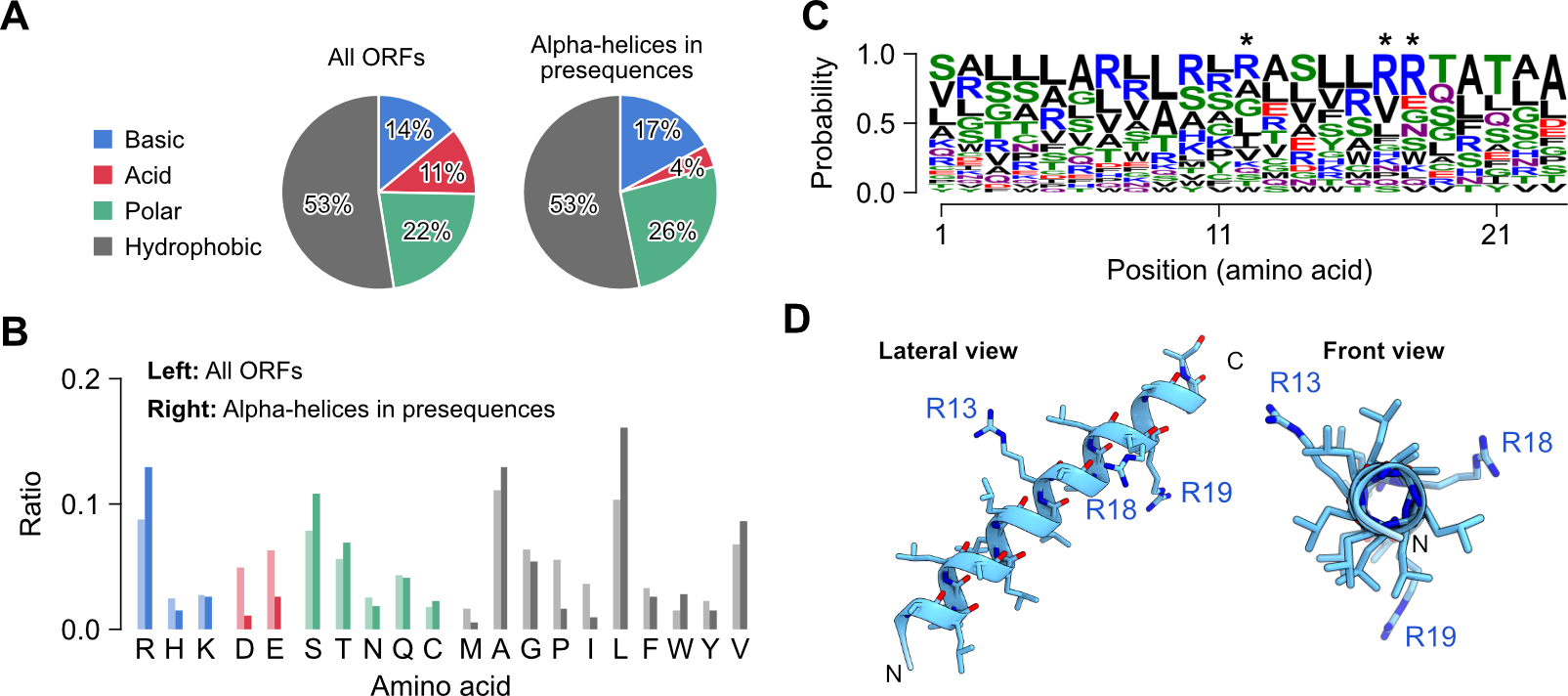
図2:ミトコンドリア標的配列のアミノ酸配列および組成に基づく人工標的配列のデザイン
(AとB)全タンパク質とミトコンドリア標的配列を構成するアミノ酸の性質による分類(A)とアミノ酸の種類毎の分類(B)。(C)ミトコンドリア標的配列における残基位置毎のアミノ酸の出現率。(D)最頻出アミノ酸を基準にして人工設計されたペプチド配列の三次元構造シミュレーション図。ミトコンドリア標的配列における平均的なアルギニン残基数は3個であったため、人工配列においてもアルギニン残基数は同様に3個にしている。
上記の解析結果を基に合成ミトコンドリア標的配列をデザインし、この配列が実際にミトコンドリア標的配列として機能を持つことを確認しました(図3左)。この合成ミトコンドリア標的配列を基準とし、アルギニン残基を段階的に他の残基に置換することでミトコンドリア標的配列における正電荷の重要性を検証した結果、たった1つのアルギニン残基があればミトコンドリアへのターゲティングが可能であることがわかりました。興味深いことにアルギニン1残基型の合成標的配列の正味電荷は0であるにも関わらずミトコンドリア標的配列として機能しました。一方でアルギニン残基を含まない場合はターゲティング機能が失われること、さらにアルギニン残基を同じ塩基性アミノ酸であるリジン残基に置換してもターゲティング機能が維持されることも確認しました(図3)。
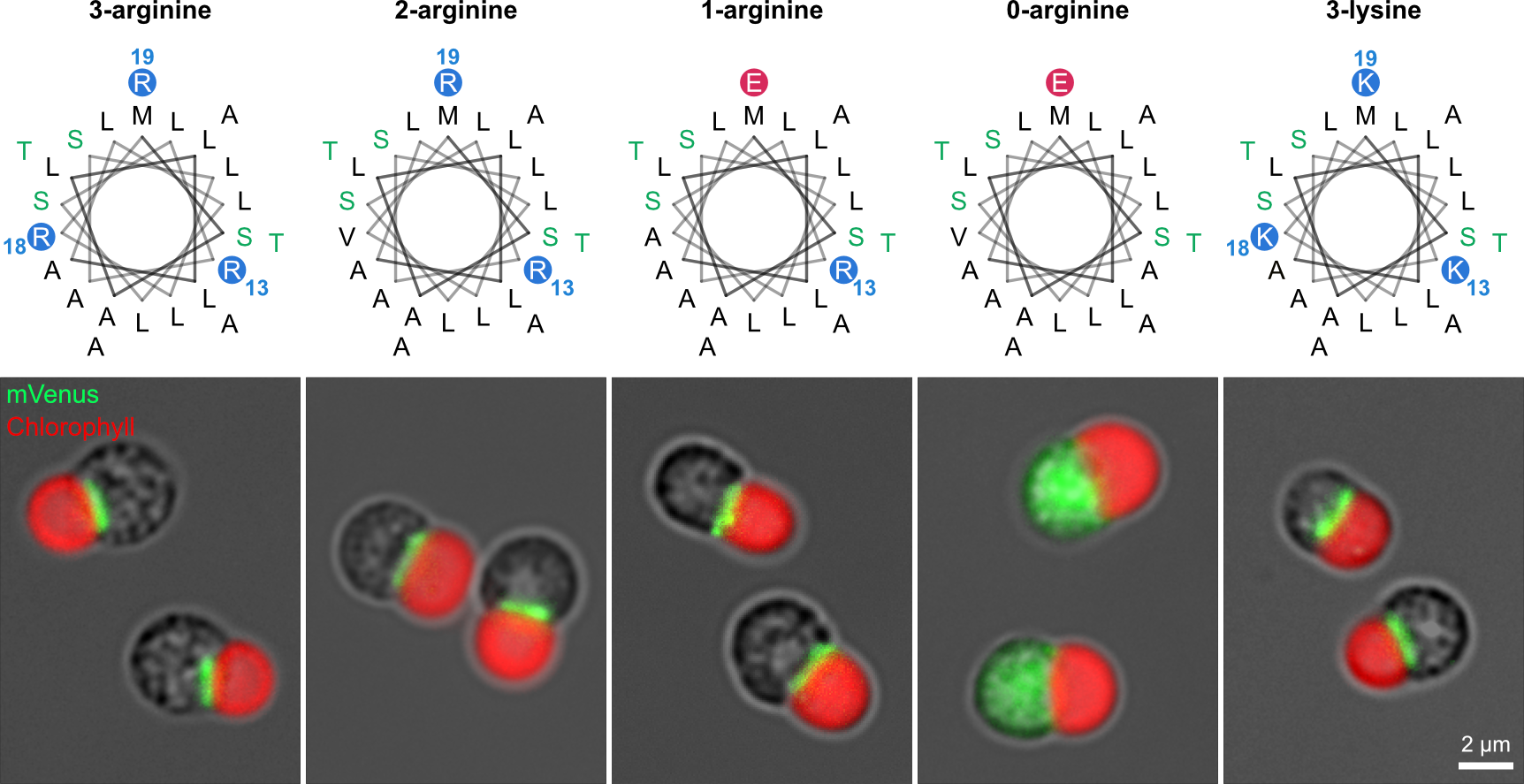
図3:合成ミトコンドリア標的配列を用いた蛍光レポーターアッセイ
合成ミトコンドリア標的配列に含まれる塩基性アミノ酸であるアルギニンを段階的に減らした結果、アルギニンが0個になると標的機能が失われた。アルギニンを同じく塩基性アミノ酸であるリシンに変えても標的機能は維持された。
一連の結果から、単一ミトコンドリア真核生物であるシゾンにおけるミトコンドリア前駆配列の必須条件は、「特定のアミノ酸組成を持つヘリックス構造に少なくとも1つの塩基性残基が存在すること」であることがわかりました。
これまでの酵母やヒト培養細胞を用いた研究から、ミトコンドリア標的配列に含まれるヘリックス構造の疎水性領域がTOM20によって認識され、次に正電荷領域がTOM22の負電荷領域によって認識される「二段階」のプロセスによって捕捉され、ミトコンドリア内へ送り込まれると考えられています。しかしシゾンゲノムDNAにはTOM20をコードする遺伝子は存在しません。またシゾンのTOM22の負電荷領域は非常に小さく、僅かに数個の酸性残基が偏って形成する“酸性側面”があるだけです。このことからシゾンにおいては、TOM20による“疎水性部位”の認証は省略され、標的配列の数個の塩基性残基とTOM22の僅かな酸性残基間の静電相互作用による「一段階」の認証によって、ミトコンドリアタンパク質が認識されている可能性が示唆されました(図4)。
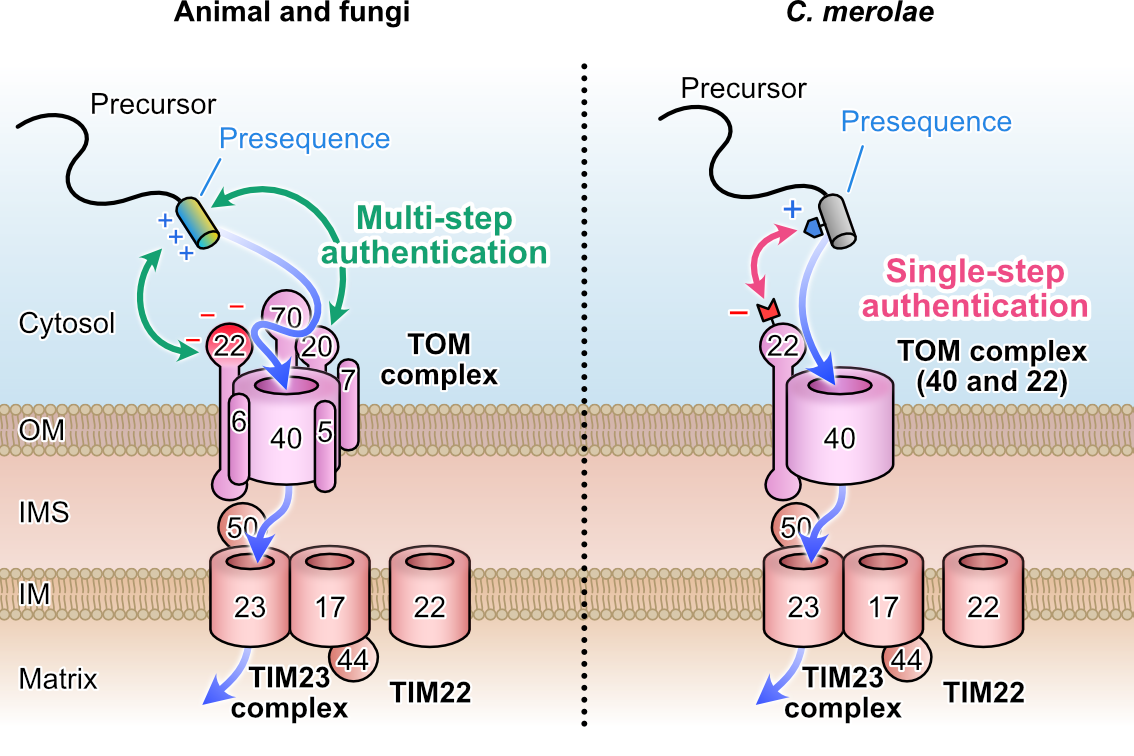
図4:ミトコンドリアへのタンパク質取り込み過程の比較
今後の展望
本研究は、ミトコンドリアという真核生物において最も重要なオルガネラを制御する基本的な分子機構の1つを明らかにしました。ミトコンドリアが関わる代謝反応は多岐に渡り、ミトコンドリアの機能不全は多くの疾患とも関連があります。本研究成果は、ミトコンドリアへと運ばれるタンパク質の種類を解明する糸口となり、基礎生物学のみならずさまざまな医学的研究の基盤を提供します。
〇関連情報: 「ゲノム編集と4種オルガネラの蛍光可視化を同時に実現」(2021/11/11)
論文情報
- 雑誌名 Journal of Cell Science
論文タイトル Simple prerequisite of presequence for mitochondrial protein import in the unicellular red alga Cyanidioschyzon merolae著者
Riko Hirata, Yuko Mogi, Kohei Takahashi, Hisayoshi Nozaki, Tetsuya Higashiyama and Yamato Yoshida *(*責任著者)DOI番号 10.1242/jcs.262042
研究助成
本研究は、JSTさきがけ「オルガネラ分裂リングの分子動作機序の解明」(課題番号:JPMJPR20EE,研究代表者:吉田大和)、Human Frontier Science Program Career Development Award「Decoding the molecular mechanisms and kinetics of the plastid- and mitochondrial-division machinery」(課題番号:CDA00049/2018-C,研究代表者:吉田大和)、科学研究費助成事業「リアルタイム蛍光観察を基盤としたオルガネラ分裂リングの収縮機構の解析」(課題番号:22H02653,研究代表者:吉田大和)、公益財団法人発酵研究所大型研究助成「ゲノムワイド・セントラルドグマ解析を基盤としたオルガネラ・細胞分裂増殖機構の新パラダイム構築と分子機序の解明」(課題番号:L-2020-2-008,研究代表者:吉田大和)の一環として行われました。また本論文は東京大学によるオープンアクセス論文出版支援により無償公開予定です。
用語解説
注1 ミトコンドリア
αプロテオバクテリアの祖先が宿主細胞へと細胞内共生した結果誕生したと考えられているオルガネラの一種。ATP合成を通じて真核生物が必要とする生体エネルギーを創り出すほか、数多くの代謝経路にも関わっているため、真核生物において極めて重要な器官となっている。
注2 ペプチドタグ
タンパク質分子に付加された目印となるペプチド配列の総称。ミトコンドリア標的配列は15から70個ほどのアミノ酸から構成されていることが知られているが、長さもアミノ酸配列もタンパク質毎に大きく異なる。
注3 両親媒性
ここでは親水性が高いアミノ酸から構成される部分と疎水性が高いアミノ酸から構成される部分を持つタンパク質分子の性質を示している。親水性が高いタンパク質は細胞質中で安定して存在できる一方で、疎水性が高いタンパク質は同じく疎水性に富んだ脂質膜に埋め込まれる傾向があるなど、水との親和性はタンパク質分子の細胞内の挙動に大きく影響する。両親媒性タンパク質はこれら2つの性質を併せ持つため、水との親和性が大きく異なる分子間の相互作用を仲介することもできる。
注4 シゾン
群馬県草津温泉のような酸性の高温環境に生息する単細胞紅藻Cyanidioschyzon merolaeの略称。シゾンは単純な細胞構造に加えてゲノム構造もシンプルであり、細胞核ゲノムにコードされている遺伝子は僅かに4755遺伝子しかない。現在では“シゾン・カッター法”などのゲノム編集をはじめとするさまざまな遺伝子改変技術も確立しており、真核生物の基本原理を解析するモデル生物となっている。
注5 αヘリックス
アミノ酸が連なったポリペプチドが形成する代表的な二次構造の一つ。ポリペプチドを構成するアミノ酸配列の性質によってはアミノ酸間で4残基毎にアミノ基とカルボキシル基が水素結合を形成し、αヘリックスと呼ばれる“らせん構造”を作ることができる。
注6 真核細胞
真核生物の細胞のこと。真核生物は原核生物とは異なり、細胞内共生オルガネラであるミトコンドリアを持つという特徴がある。一部の寄生性の真核生物ではミトコンドリアが退化しているものもあるが、進化の過程でこれまでミトコンドリアを持ったことがない真核生物はいないと考えられている。
注7 構造シミュレーション解析
生物が使う20種類のアミノ酸は、それぞれ特徴的な物理化学的性質を持つ。このアミノ酸毎の性質の違いから、アミノ酸が連なったポリペプチドが取りうる立体構造を予測することができる。αヘリックスなどの二次構造のほか、生体膜貫通領域の有無、さらに現在では三次元立体構造予測なども行われる。