2024-07-30 理化学研究所,静岡県立大学,大阪大学
理化学研究所(理研)環境資源科学研究センター 天然物生合成研究ユニットの高橋 俊二 ユニットリーダー、テイ・ウ 基礎科学特別研究員、坂井 克行 特別研究員、静岡県立大学 薬学部の滝田 良 教授(東京大学 大学院薬学系研究科 准教授(研究開始当時)、理研 環境資源科学研究センター 天然物生合成研究ユニット 客員研究員)、大阪大学 蛋白質研究所の栗栖 源嗣 教授、宮ノ入 洋平 准教授らの共同研究グループは、天然物の生合成において、鉄硫黄タンパク質(Fe-Sタンパク質)[1]がルイス酸(Lewis acid)[2]触媒として機能し、[4+2]環化付加反応(ディールス・アルダー反応)[3]を促進することを発見しました。
共同研究グループは、放線菌[4]の二次代謝産物である「ヴァーティシラクタム(verticilactam:VTL)[5]」の生合成において、水酸化反応を触媒するシトクロムP450(VtlG)[6]と、[4+2]環化付加反応を触媒する酵素(VtlF)を同定しました。さらに、生化学実験と理論計算を効果的に組み合わせることで、酵素分子内の鉄硫黄クラスターが[4+2]環化付加反応を効率的に促進することも明らかにしました。
本研究成果は、天然物生合成において、天然の酵素が、ルイス酸触媒を用いて[4+2]環化付加反応を行う最初の例になります。鉄硫黄クラスターを有し、電子伝達体として知られるタンパク質が、多様な[4+2]環化付加反応の設計のための有望な出発点となることが期待できます。
本研究は、科学雑誌『Nature Communications』オンライン版(7月10日付)に掲載されました。
![鉄硫黄タンパク質が触媒する[4+2]環化付加反応~多様なルイス酸触媒の設計の有望な出発点に~ 鉄硫黄タンパク質が触媒する[4+2]環化付加反応~多様なルイス酸触媒の設計の有望な出発点に~](https://www.riken.jp/medialibrary/riken/pr/press/2024/20240730_1/20240730_1_fig.jpg)
鉄硫黄タンパク質がルイス酸として[4+2]環化付加反応を触媒
背景
[4+2]環化付加反応は、有機合成化学における最も重要な反応の一つです。近年、天然物生合成経路においてこの反応を触媒する酵素が次々と発見されています。例えば、糸状菌が生産するエキセチンの生合成経路において、立体選択的にオクタリン(二環性の炭化水素構造)の形成を担う「Fsa2」が挙げられます注1)。Fsa2酵素群に属する「Phm7」は、エキセチンと鏡像関係にある類縁化合物フォマセチンのオクタリン骨格を作ります注2)。さらに、Fsa2およびPhm7両酵素の活性中心の基質結合様式が[4+2]環化付加反応の立体選択性を決定することが明らかになっています注3)。
ヴァーティシラクタム(VTL)は、16員環マクロラクタムにβケトアミド、オクタリン環、フラン環が存在する珍しい構造を有しています注4、5)。これまでに高橋ユニットリーダーらは、vtl生合成遺伝子クラスター全長をBACベクターに組み込み、異種放線菌に導入・発現させることによって、VTLおよびその新規類縁体(VTL B、VTL C)の安定生産に成功しました注5)。しかし、VTLのオクタリン骨格形成に関わる[4+2]環化付加反応を触媒する酵素遺伝子および反応機構は長い間未解明でした。
注1)2015年4月28日プレスリリース「微生物が特定の形の代謝物を作るために必要な酵素遺伝子を発見」
注2)2018年7月5日プレスリリース「鏡像異性体を作り分ける酵素の発見」
注3)2021年8月19日プレスリリース「天然物が持つ鏡像異性な環状骨格を作り分ける」
注4)Nogawa T, et al. Verticilactam, a new macrolactam isolated from microbial metabolite fraction library, Org. Lett. 12, 4564-4567 (2010)
注5)2020年12月15日プレスリリース「遺伝子資源を化合物資源へ」
研究手法と成果
共同研究グループはまず、生合成遺伝子クラスターに存在するP450酵素遺伝子vtlGに着目し、遺伝子破壊[7]を行いました。vtlG遺伝子破壊株では、VTLの生産が消失し、生合成中間体(VtlG基質)と推測される単環式マクロラクタム(dVTL)の生産が認められました(図1)。また、vtlG遺伝子破壊株の培養液から、水酸化酵素(VtlG)の反応解析に用いる基質を精製する過程で、化合物の一部が非酵素的に環化し、オクタリン構造を有するVTLの類縁体「VTL S」に変換されることを明らかにしました。
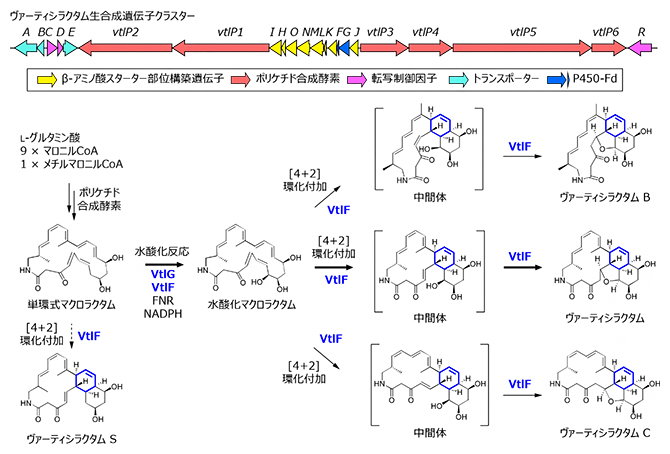
図1 VTL生合成経路の解明
上:ヴァーティシラクタム(VTL)生合成遺伝子クラスター。
下:推定されたVTLの生合成経路。実線は生理的な生合成経路を示し、点線は化合物の精製過程で見いだされた非酵素的反応を示す。
次に、VtlGの機能を調べるために、大腸菌を用いて酵素を精製しました。市販のホウレンソウフェレドキシン(Fd)[8]およびFd-NADP+還元酵素(FNR)を酸化還元パートナーとして使用して試験管内(in vitro)酵素反応系を構築しました。その結果、単環式マクロラクタム(dVTL)はVtlGにより迅速に水酸化マクロラクタム(dVTL-OH)に変わり、経時的に1時間以内でVTLまで変換されました。dVTL-OHからVTLの非酵素的な変換には2週間以上かかるため、VtlG反応系に加えた酵素が[4+2]環化付加反応を促進すると考え、反応に寄与する酵素を解析しました。その結果、ホウレンソウFd単独でdVTLをVTLに迅速に変換できることが分かりました。
続いて、VTL生合成遺伝子クラスター内に存在するVtlF(内因性のFd)に着目し、大腸菌を用いて酵素を精製しました。VtlG、VtlF、FNR、および還元型ニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の存在下で酵素反応を再構築したところ、dVTLは迅速にdVTL-OH、VTLへと変換されました(図2)。さらに、VtlF単独で基質(dVTLおよびdVTL-OH)を添加して酵素反応を行った場合、それぞれ、VTL S、VTLへと効率よく変換されました。この結果は、VtlFが電子伝達体として機能するだけでなく、[4+2]環化付加反応にも関与することを示唆しています。
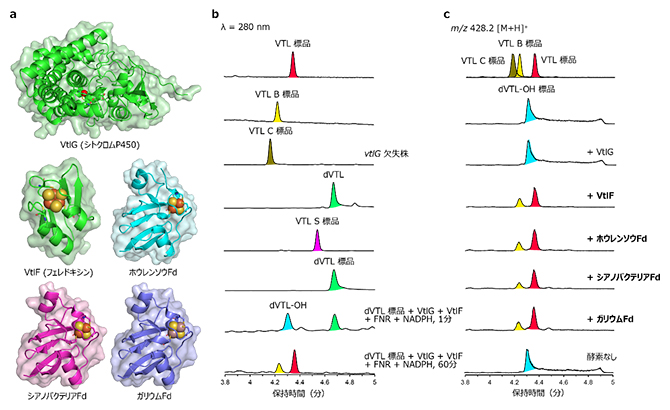
図2 VtlGとVtlFの酵素反応解析
a: VtlGとVtlF、その他のFdの構造。b: 単環式マクロラクタム(dVTL)を用いた酵素反応解析。c: 水酸化マクロラクタム(dVTL-OH)を用いた酵素反応解析。
[4+2]環化付加反応の反応機構を理解するため、ホウレンソウFdとVtlFの共通点である鉄硫黄クラスターに着目しました。最初に、酸化状態の鉄硫黄クラスターを亜ジチオン酸ナトリウムで還元し触媒効率を調べたところ、活性への影響は確認できませんでした。次に、鉄硫黄クラスターに結合するシステイン残基に部位特異的変異導入[9]を行った酵素を調製し、酵素反応を解析しました。その結果、鉄硫黄クラスターを持たないアポ型Fdは活性を示さなくなりました。これらの結果は、[4+2]環化付加反応が鉄硫黄クラスターに依存していることを示唆していました。続いて、鉄硫黄クラスターがルイス酸として機能するかどうかを調べるために、シアノバクテリアSynechocystis sp. PCC 6803由来のFd(SynFd)を、大腸菌を用いて精製しました。さらに、SynFdを用いて鉄原子をルイス酸性のガリウム原子に置換したFd(GaFd)を調製し、[4+2]環化付加反応を解析しました。その結果、SynFdとGaFdともに活性を有していることが確認できました。
さらに、共同研究グループはFdが触媒する[4+2]環化付加反応の詳細に調べるために、GaFdをモデルとして密度汎関数理論計算[10]を行いました(図3)。その結果、ガリウム硫黄クラスターがルイス酸として[4+2]環化付加反応の遷移状態[10]の活性化エネルギー[10]を下げることによって効率的に反応を促進することが分かりました。また、ガリウム硫黄クラスターはマイケル付加反応(Michael addition reaction)[11]遷移状態の活性化エネルギーも大幅に低下させることが分かりました。
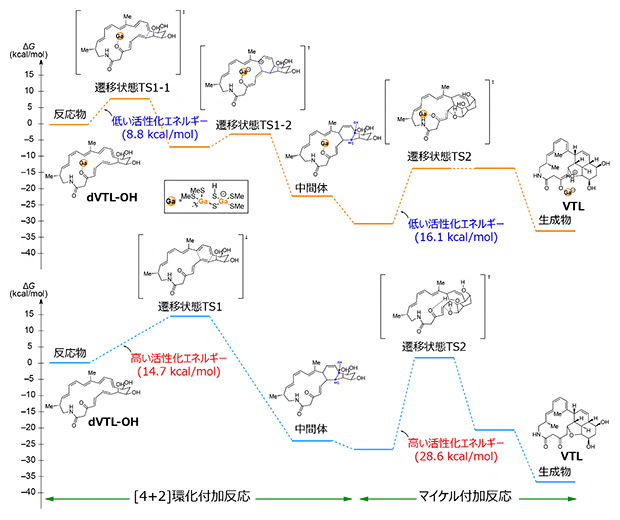
図3 密度汎関数理論計算による反応機構の解明
GaFdの有(上)無(下)による遷移状態と中間体のエネルギー図。GaFdによって[4+2]環化付加反応の遷移状態とマイケル付加反応遷移状態のいずれの活性化エネルギーも低下した。
今後の期待
本研究成果は、複雑な構造を持つ天然物の生合成経路において、[4+2]環化付加反応をルイス酸触媒として触媒する天然由来の酵素の最初の例になります。
発見以来、電子伝達体として知られているFdが、今後は、多様な有機ルイス酸触媒の設計のための有望な出発点となると期待できます。
本研究成果は、国際連合が定めた17項目の「持続可能な開発目標(SDGs)[12]」のうち「3.すべての人に健康と福祉を」に大きく貢献するものです。
補足説明
1.鉄硫黄タンパク質(Fe-Sタンパク質)
鉄(Fe)と硫黄(S)を含むクラスターを持つタンパク質の総称。これらのタンパク質は、電子伝達、酵素活性、遺伝子発現の調節など、さまざまな生物学的プロセスに関与している。
2.ルイス酸(Lewis acid)
電子対を受け取ることができる化学種のことを指す。ルイス酸の定義は、ルイス塩基の対概念であり、電子対供与体(ルイス塩基)と反応して電子対を受け取る能力を持つ。ルイス酸は、多くの化学反応で重要な役割を果たし、触媒として使用される。例えば、有機合成においてルイス酸触媒は、[4+2]環化付加反応(ディールス・アルダー反応)([3]参照)などの多くの反応を促進する。
3.[4+2]環化付加反応(ディールス・アルダー反応)
共役ジエンにアルケン(ジエノファイル)が付加して6員環構造が生じる反応。有機合成化学において非常に重要であり、複雑な天然物や薬物の合成にも広く利用されている。また、反応は多くの生物学的過程にも関与しており、酵素によって触媒されることもある。
4.放線菌
土壌中など自然界に広く存在するグラム陽性の真正細菌であり、複雑な構造を持つ二次代謝産物を生産する。人類は、それらの中から、医薬、農薬、動物薬などの生理活性を持つ物質を利用してきた。現在も医薬探索源として重要視されている。
5.ヴァーティシラクタム(verticilactam:VTL)
放線菌Streptomyces spiroverticillatus JC-8444から単離されたポリケチド化合物。16員環マクロラクタムにオクタリンが縮合した特徴的な構造を持っている。
6.シトクロムP450(VtlG)
広く分布するヘムタンパク質の一種であり、生物の体内でさまざまな酸化反応を触媒する酵素である。この酵素は、生物の体内での代謝反応において重要な役割を果たし、特に脂肪酸代謝や薬物代謝、さまざまな生理活性物質の合成に関与している。
7.遺伝子破壊
特定の生物のゲノムから特定の遺伝子の機能を無効化すること。遺伝子の機能や役割の理解に役立つ。
8.フェレドキシン(Fd)
内部に鉄-硫黄クラスター(Fe-Sクラスター)を含む鉄硫黄タンパク質の一つ。さまざまな生物プロセスにおいて電子伝達体としてとして機能する。
9.部位特異的変異導入
タンパク質を構成する特定のアミノ酸の改変を目的として、酵素遺伝子に変異を導入する実験手法。
10.密度汎関数理論計算、遷移状態、活性化エネルギー
密度汎関数計算は、原子や分子などの物性を明らかにする量子化学計算手法の一つ。例えば、今回の研究では分子の構造変化のエネルギーを明らかにし、各反応経路の検証に用いている。また、反応が進行する際に最もエネルギーが高い状態を遷移状態と呼び、基底状態とのエネルギー差が「活性化エネルギー」である。遷移状態(transition state:TS)は、エネルギーが高く不安定なため実験的には観測は困難であるが、量子化学計算によりその構造を推測できる。密度汎関数法は、正確なエネルギーが電子密度の汎関数(関数の関数)として一意的に定められるというHohenberg-Kohn定理に基づいている。計算コストに対して、比較的良い計算精度が得られることから、近年化学分野で広く活用されている。
11.マイケル付加反応(Michael addition reaction)
有機化学の反応で、カルボニル基など電子求引性基と共役した炭素-炭素二重結合に対して、炭素求核剤が共役付加(二重結合部位にて求核反応が起こる)して新しい炭素-炭素結合を作る反応。広義には、炭素求核剤のみならず酸素求核剤(本発表のケースもこれに該当する)や窒素求核剤などによる反応も含められる。
12.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された、持続可能でよりよい世界を目指す国際目標。17のゴールおよび169のターゲットで構成されており、国連加盟193か国が、2016年から2030年の15年間でこれらを達成することを目標としている。
共同研究グループ
理化学研究所 環境資源科学研究センター
天然物生合成研究ユニット
ユニットリーダー 高橋 俊二(タカハシ・シュンジ)
基礎科学特別研究員 テイ・ウ(Zheng Yu)
特別研究員 坂井 克行(サカイ・カツユキ)
テクニカルスタッフⅠ 髙木 海(タカギ・ヒロシ)
テクニカルスタッフⅠ(研究当時)佐藤 裕美(サトウ・ユミ)
(現 化合物リソース開発研究ユニット テクニカルスタッフⅡ)
分子構造解析ユニット
技師 野川 俊彦(ノガワ・トシヒコ)
静岡県立大学 薬学部
教授 滝田 良(タキタ・リョウ)
(東京大学 大学院薬学系研究科 准教授(研究開始当時)、理研 環境資源科学研究センター 天然物生合成研究ユニット 客員研究員)
東京大学 大学院薬学系研究科
特任助教 渡邉 康平(ワタナベ・コウヘイ)
大阪大学 蛋白質研究所
教授 栗栖 源嗣(クリス・ゲンジ)
准教授 宮ノ入 洋平(ミヤノイリ・ヨウヘイ)
特任研究員 三角 裕子(ミスミ・ユウコ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「天然化合物の多様性拡張を志向した生合成分子基盤の解明(研究代表者:高橋俊二)」、同学術変革領域研究(A)「AIを活用した未知の二次代謝生合成酵素の機能解明と分子間相互作用の精密解析(研究代表者:高橋俊二)」による助成を受けて行われました。
原論文情報
Yu Zheng, Katsuyuki Sakai, Kohei Watanabe, Hiroshi Takagi, Yumi Sato-Shiozaki, Yuko Misumi, Yohei Miyanoiri, Genji Kurisu, Toshihiko Nogawa, Ryo Takita, Shunji Takahashi, “Iron-sulphur protein catalysed [4+2] cycloadditions in natural product biosynthesis”, Nature Communications, 10.1038/s41467-024-50142-1
発表者
理化学研究所
環境資源科学研究センター 天然物生合成研究ユニット
ユニットリーダー 高橋 俊二(タカハシ・シュンジ)
基礎科学特別研究員 テイ・ウ(Zheng Yu)
特別研究員 坂井 克行(サカイ・カツユキ)
静岡県立大学 薬学部
教授 滝田 良(タキタ・リョウ)
(東京大学 大学院薬学系研究科 准教授(研究開始当時)、理研 環境資源科学研究センター 天然物生合成研究ユニット 客員研究員)
大阪大学 蛋白質研究所
教授 栗栖 源嗣(クリス・ゲンジ)
准教授 宮ノ入 洋平(ミヤノイリ・ヨウヘイ)
報道担当
理化学研究所 広報室 報道担当
静岡県立大学 広報・企画室
大阪大学 蛋白質研究所 研究戦略推進室