2018/09/21 大阪大学,自然科学研究機構
内容
我々の皮膚や膣に生息する常在菌であり、真菌の一種であるカンジタ菌(Candida albicans)は、通常は人体に害を及ぼすことはありません。しかし、抗癌剤や抗菌薬、ステロイドなどの投与によって我々の免疫系と細菌叢の恒常性が攪乱されると、Candida albicansは病原性の高い状態に変化して増殖をはじめ、口腔粘膜・外耳道・陰部・手足の指間部にしつこい痛みとかゆみを伴った発疹をひきおこすことがあります。しかし、これまでCandida albicansによる日和見感染で生じる不快情動が、一体どのようなメカニズムで生じているのかは全く明らかにされていませんでした。今回、遺伝子改変マウスを駆使した行動生理学的手法を用いてこの謎に挑んだところ、Candida albicansを構成する多糖類の一種「β-glucan (Candida albicans-derived soluble β-glucan:CSBG)」が皮膚の上皮細胞を刺激してATP分泌顆粒の放出が促進され、結果としてこのATPが末梢の痛覚神経を刺激し、痛みやかゆみを発生させていることがわかりました。今回の発見は、世界にさきがけて真菌感染随伴症状の発現機構の全貌を明らかにしただけでなく、日常的に遭遇することの多いCandida膣炎などによる不快情動を取り除くための新たな治療標的の可能性を見出したことに、重要な科学的価値があります。本研究成果は米国科学雑誌であるCell Pressの科学雑誌iScienceに掲載されました。
Candida albicansが宿主に対してどのようなメカニズムで痛みやかゆみを生じさせているのか、そのメカニズムについてはこれまで殆ど解明されていませんでした。これまでの研究ではCandida albicansが直接痛覚神経を活性化させる可能性などが指摘されていたものの、Candida albicansの「どのような成分が、どの細胞の、どのような受容体を刺激することで不快情動を惹起しているのか」といった、細かな作用機序については全くわかっていませんでした。今回の研究から、Candida albicansから放出された可溶性のβ-glucanCSBGが、皮膚の上皮細胞にあるDectin-1受容体を刺激しATPが放出されることが、Candida albicans感染に伴って生じる不快情動の枢軸機構であることを解明しました。
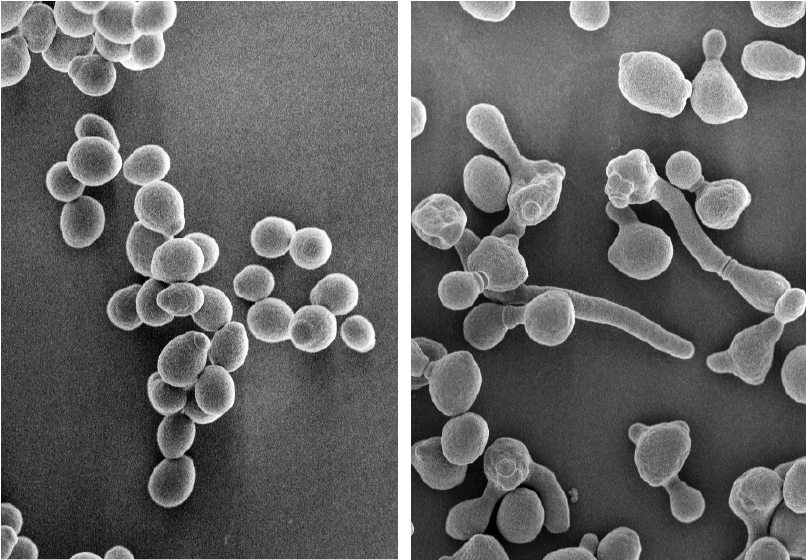
Candida albicansは、過酷な環境においては酵母型とよばれる丸い形質を呈することで休眠状態をとります。ところが、湿潤環境で、かつ37℃といった温度環境におかれると、菌糸型と呼ばれる紐状の形質に転換し、活発に増殖するようになります(図1)。この形質転換が生じる際の培養上清を分析したところ、Candida albicansを構成する成分のひとつである可溶性のCSBGが、菌体から大量に放出されていることがわかりました。これまでCSBGは、免疫細胞に発現するDectin1と呼ばれる受容体を活性化して炎症性サイトカインを誘導することで知られていましたが、生理学的手法を用いた解析の結果、機能的なDectin1は免疫細胞のみならず、痛覚神経や皮膚の上皮細胞にも発現していることがわかりました。また、CSBGをマウスの皮下に投与すると短時間の間に消えてしまう一過性の疼痛が惹起されることが判明しましたが、Dectin1を欠損するマウスではそれが観察されなかったことから、CSBGによる急性一過性の疼痛反応は痛覚神経のDectin1刺激によって生じている可能性が示唆されました。また、CSBGを投与されたマウスは、急性一過性の疼痛反応の消失ののち、アロディニアと呼ばれる痛覚閾値の低下(通常は痛みと感じないような刺激を痛いと感じること)を24時間にわたって認めましたが、この現象はCSBGの刺激によって炎症性サイトカインを産生することのできないBcl6遺伝子やMalt1遺伝子を欠損するマウスでも観察されました。このことは、CSBGによって惹起されるアロディニアは炎症性サイトカインによって引き起こされているわけではないことを意味しています。そこで、CSBGの刺激によってDectin1依存的に皮膚の上皮細胞から放出される炎症性サイトカイン以外の分子を探索したところ、アデノシン3リン酸(ATP)の存在が浮かび上がりました。
ATPは細胞のエネルギー源として重要な物質ですが、小胞性ヌクレオチドトランスポーター(VNUT)とよばれる分子の働きにより分泌顆粒の形で細胞質にストックされていることが知られています。驚くべきことに、ATPの分泌顆粒をつくることのできないVNUT遺伝子を欠損するマウス並びにからし受容体(TRPV1遺伝子)とわさび受容体(TRPA1遺伝子)の二重欠損マウスでは、CSBGによるアロディニアが完全に消失していました。このことは、CSBGが皮膚の上皮細胞のDectin1シグナルを活性化することでATPを放出させ、これが神経に発現するATP受容体(P2X受容体)を活性化することでアロディニアを引き起こしていること、またATPによるアロディニアの誘発にはからしとわさびの受容体が必須であることを示唆しています。
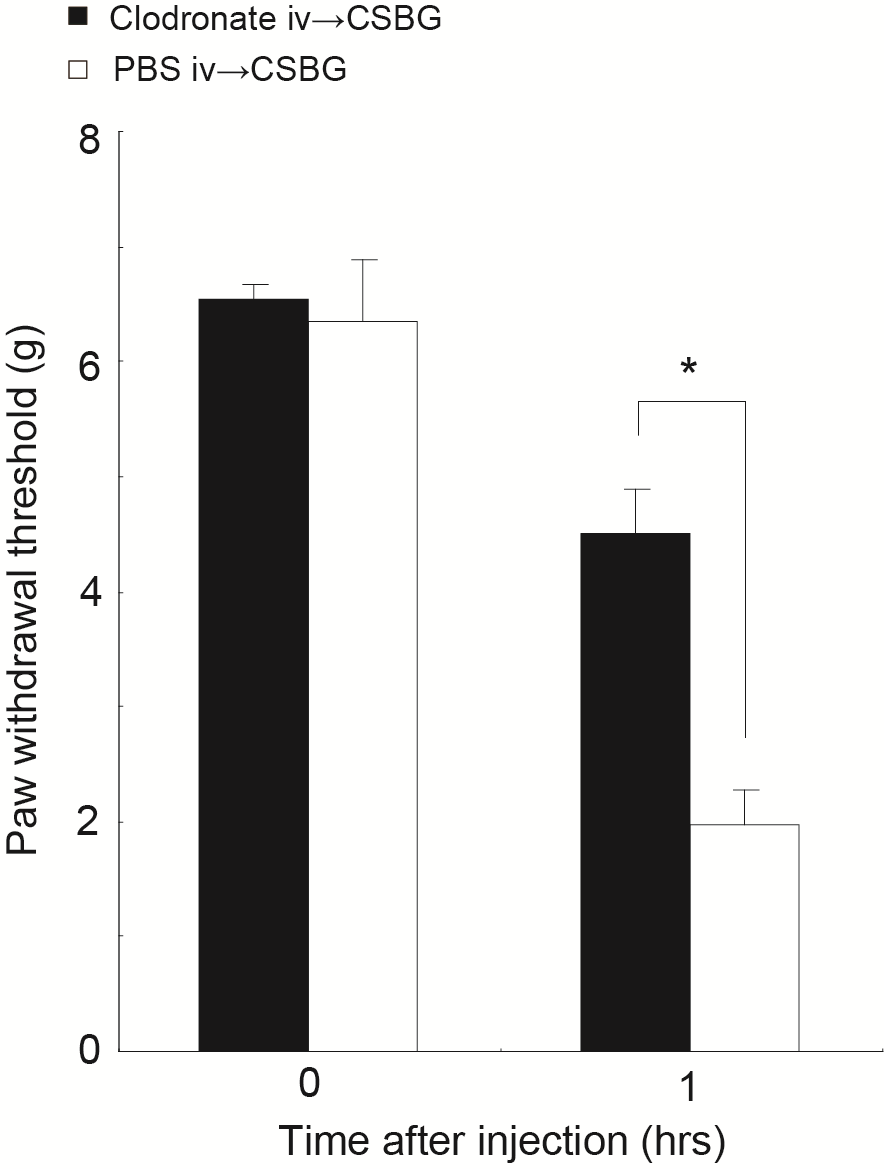
また、VNUT阻害効果を持つ骨粗鬆症治療薬であるクロドロネートを投与したマウスでは、CSBGによる痛みやかゆみが顕著に改善したことから、VNUTは真菌随伴症状をとるための理想的な治療標的であることが明らかとなりました(図2)。
感染症に随伴する疼痛は、現象として臨床の場で広く認識されていたにも関わらず、これまで医学研究の分野において殆ど顧みられることがありませんでした。本研究では真菌感染随伴疼痛の全貌を分子の言葉で包括的に記述すると同時にその治療標的の同定に成功しました。これらの知見は、「感覚免疫学(Senso-immunology)」ともいうべきあたらしい学際領域の創生に資する重要な発見と考えられます。
本研究(研究代表者:丸山健太)は文部科学省科学研究費補助金 (若手A・基盤B)、および大阪大学産学連携プロジェクトMEET、 武田科学財団、千里ライフサイエンス振興財団 岸本基金研究助成、国際科学技術財団、持田記念医学薬学振興財団、生理学研究所 共同利用研究、AMED 革新的医療技術創出拠点プロジェクト(シーズA)、日本リウマチ財団、骨粗鬆症財団 研究助成、ライフサイエンス振興財団 助成研究、赤枝医学研究財団 研究助成、神澤医学研究振興財団 研究助成、ヤクルト・バイオサイエンス研究財団 一般研究助成、テルモ生命科学芸術財団 生命科学助成の補助を受けて行われました。
今回の発見
- カンジダ菌の構成成分であるβ-グルカンはマウスの上皮細胞からのATP分泌顆粒の放出を促す。
- 放出されたATPは神経を刺激し、TRPV1やTRPA1の介在を経て、痛みやかゆみを惹起する。
- 真菌によって引き起こされる痛みやかゆみは、ATP分泌顆粒を形成するために必須のトランスポーターであるVNUTを抑制することでとりさることができる。
図1 カンジダ菌の休眠時と増殖時における形態変化
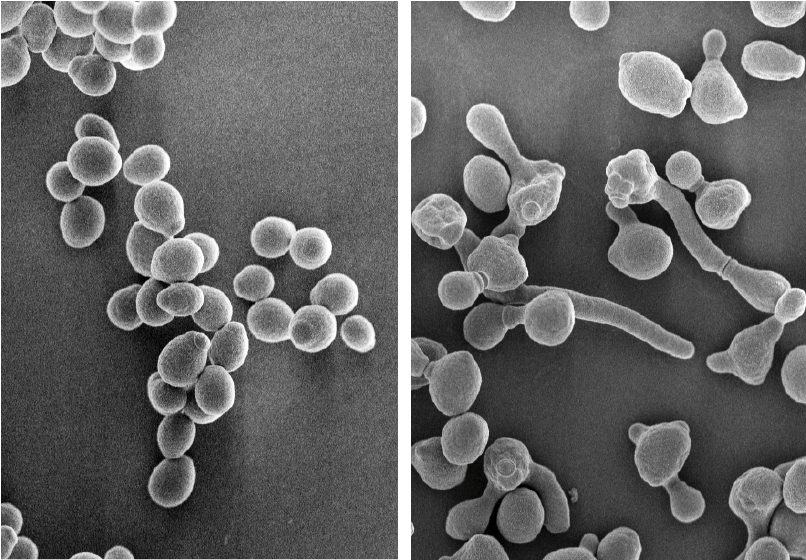
(図左)過酷環境における休眠中のカンジダ菌。酵母のような形態をしている。
(図右)適した環境においた場合のカンジダ菌。偽菌糸という構造を作りながら活発に増殖している。
図2 VNUT阻害剤の投与による真菌感染随伴疼痛の改善
この研究の社会的意義
これまで遺伝学的手法を用いて研究されることのなかった真菌感染知覚機構の全貌を分子レベルで世界にさきがけて解明した最初の報告になります。また、Candida膣炎をはじめとする私たちにとって身近な病気の症状を改善させるための新たな治療標的を見出したという意味において、医学的に重要な発見と考えられます。
論文情報
he ATP transporter VNUT mediates induction of Dectin-1-triggered Candida nociception.
Kenta Maruyama, Yasunori Takayama, Erika Sugisawa, Yu Yamanoi, Takashi Yokawa, Takeshi Kondo, Ken-ichi Ishibashi, Bikash Ranjan Sahoo, Naoki Takemura, Yuki Mori, Hisashi Kanemaru, Yutaro Kumagai, Mikaël M. Martino, Yoshichika Yoshioka, Hisao Nishijo, Hiroki Tanaka, Atsushi Sasaki, Naohito Ohno, Yoichiro Iwakura, Yoshinori Moriyama, Masatoshi Nomura, Shizuo Akira, Makoto Tominaga.
iScience. 2018年8月31日オンライン掲載
お問い合わせ先
<研究について>
大阪大学免疫学フロンティア研究センター
特任助教 丸山健太 (まるやま けんた)
自然科学研究機構 生命創成探究センター 温度生物学グループ
(兼・生理学研究所 細胞生理研究部門)
教授 富永真琴 (とみなが まこと)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室