2024-10-23 名古屋大学
【本研究のポイント】
・気孔数を減らす低分子化合物を発見
・気孔関連変異体の解析や、生化学的解析により、化合物の標的タンパク質を同定
・計算化学、生化学により化合物が結合する標的タンパク質のアミノ酸部位を特定
【概要】
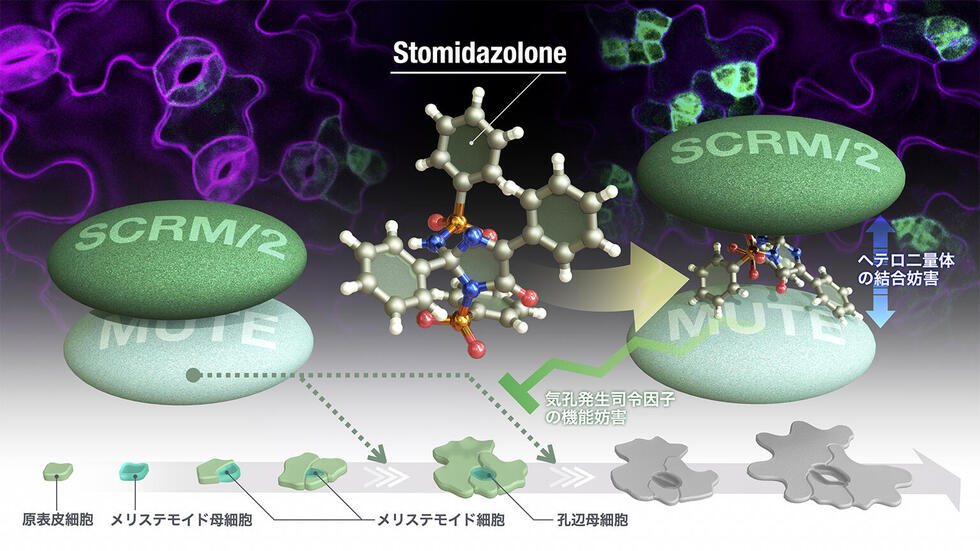
名古屋大学トランスフォーマティブ生命分子研究所(WPI-ITbM)の中川 彩美 研究員、鳥居 啓子 主任研究者/客員教授(米国テキサス大学オースティン校 教授)、理学研究科のシュー・ジャン・イップ 博士後期課程学生、村上 慧 特任准教授(現 関西学院大学)、スンキ・ハン 特任助教(現 韓国 亜洲大学校)らの研究グループは、植物の気孔を減らす低分子化合物を新たに発見し、その作用機序を解明しました。
気孔は植物の葉などの表皮に存在する孔(あな)で、酸素や二酸化炭素などのガス交換や水分調節に使われています。気孔の機能は水分調節や環境応答であるので、気孔の数を調節する低分子化合物があれば、基礎研究だけでなく農業への応用も期待されます。しかしながら、気孔の数やパターンを制御する低分子化合物の報告例は少なく、そのメカニズムも不明でした。
本研究では、イミダゾロン骨格を持つ化合物(Stomidazolone)が顕著に気孔数を減らすことを発見し、生化学的解析により、この分子が気孔の発生に重要なタンパク質のMUTE-SCRMのヘテロ二量体の結合を妨害していることを明らかにしました。気孔をつくる司令因子は、ヒトの幹細胞や神経の分化の司令因子と類似していますが、植物の司令因子だけに特徴的な領域のACTドメインにStomidazoloneが作用することで、植物の転写因子の機能阻害が生じ、気孔数が減ることが明らかになりました。さらに、計算化学と生化学的実験により、この分子と結合しているMUTEタンパク質のアミノ酸残基を同定し、タンパク質構造設計を用いてStomidazolone耐性をもつ植物体の作出にも成功しました。
今後は、農作物にStomidazoloneを投与し、乾燥地や干ばつ時での植物の乾燥耐性を高めるなど、応用開発研究、農業への可能性が期待されます。
本研究成果は、2024年10月23日18時(日本時間)付英国の科学雑誌『Nature Communications』に掲載されました。
【研究背景と内容】
本研究の始まりは、世界に先駆けて発見した分子合成法です。研究グループは、気孔数を調節する分子の発見を目指して、さまざまな化合物の合成に取り組みました。その結果、市販のオキサゾールを原料としてわずか1工程で、三次元骨格をもつイミダゾロン化合物(AYSJ929, Stomidazolone)を与える新規合成法の確立に成功しました(図1)。AYSJ929は過去に報告例のない構造を有しており、その性質に興味がもたれました。野生型のシロイヌナズナにAYSJ929を投与したところ、気孔数が減少し、気孔幹細胞(以下、メリステモイド)注1)が増えるという表現型を示すことを発見しました(図2、左パネル)。そこで、研究グループはAYSJ929をStomidazoloneと名付けました。さらに、メリステモイドマーカー植物注2)の解析により、Stomidazoloneを投与するとメリステモイドが増えていることを確認しました(図2、右パネル)。このことから、この化合物は気孔の発生過程を途中で止めているのではないかと考え、さまざまな気孔関連の変異体の表現型を調べました。
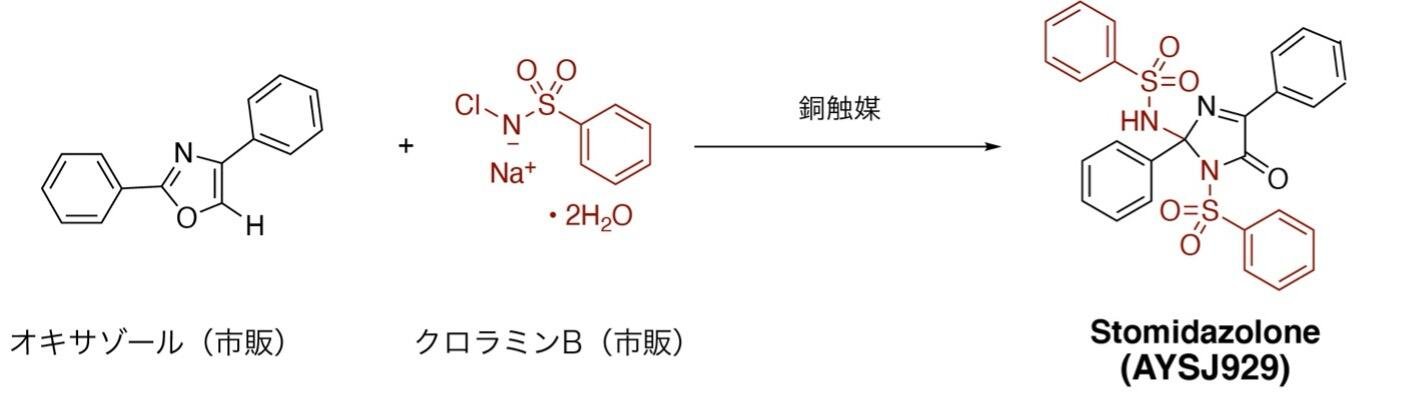
図1
AYSJ929 (Stomidazolone)の合成スキーム。
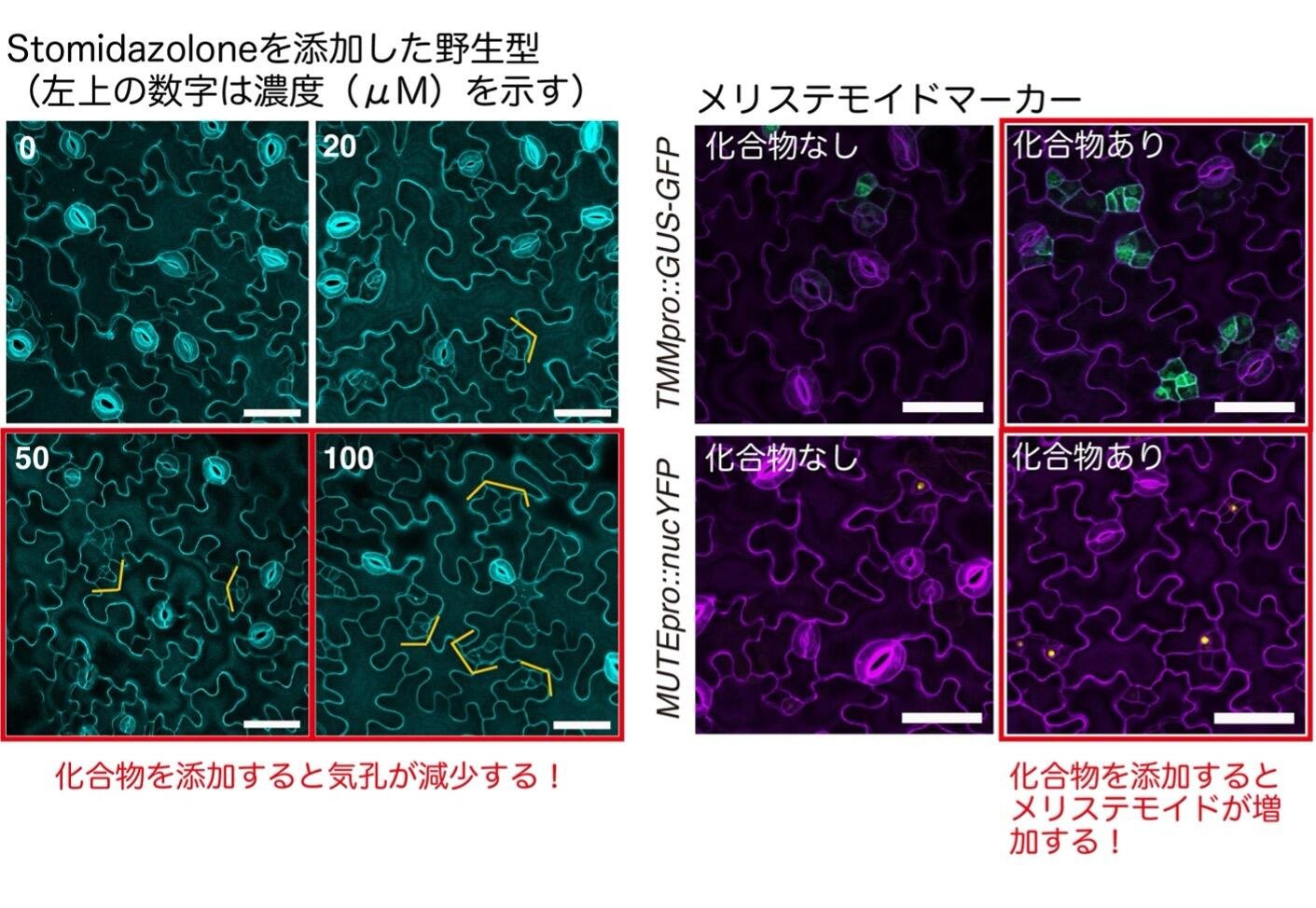
図2
左パネル 野生型植物にStomidazolone (0, 20, 50, 100 μM)添加した時の気孔表現型。50, 100 μM 添加するとメリステモイド(気孔の幹細胞)が多く見られる。黄色く囲った細胞が、分裂の止まったメリステモイドを示す。
右パネル メリステモイドマーカーであるTMMp::GUS-GFPとMUTEpro::nucYFPにStomidazoloneを添加した時の表現型。Stomidazoloneを添加した方がGFP/YFPシグナル(メリステモイド)が多く見られる。
気孔の発生には、SPCH, MUTE, FAMAという3つのbHLH転写因子がSCRMというbHLH転写因子とヘテロ二量体を形成し、発生段階特異的に機能することが知られています。細胞分裂の過程で、この3つのbHLH転写因子のSPCH、MUTE、FAMAが順に作用することで孔辺細胞への分化・分裂が厳密に制御されています。(図3、上パネル)。Stomidazoloneの作用するメカニズムを調べるため、まず、spch, mute, fama変異体にそれぞれこの化合物を投与しました。その結果、spch変異体、mute 変異体に化合物を投与しても変化がありませんでしたが、fama 変異体では、メリステモイドが増加していることが分かりました(図3、下パネル)。このことから、StomidazoloneはMUTEの機能する段階で気孔発生を阻害することが予想されました。
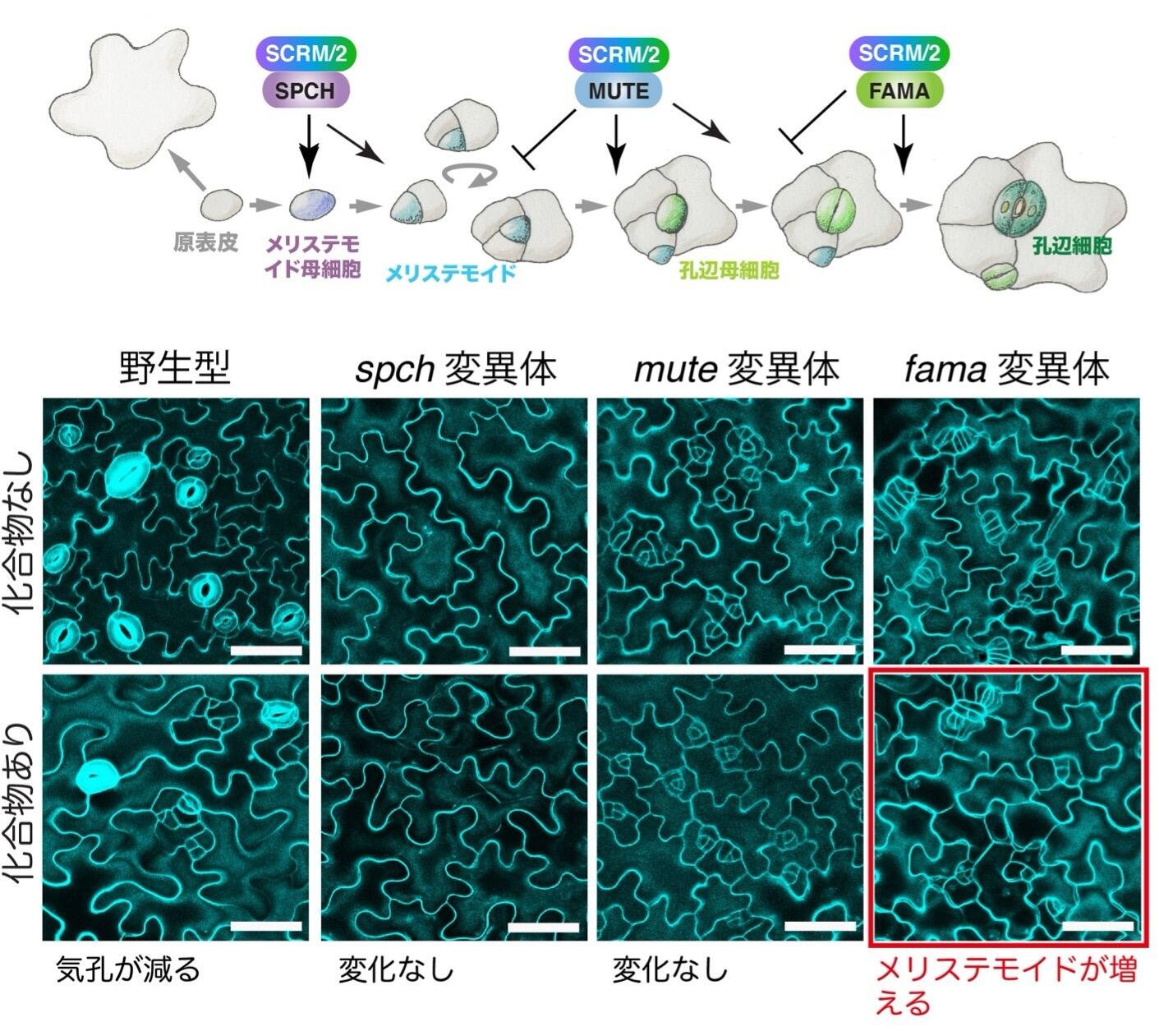
図3
上パネル 気孔発生の細胞分化のモデル図と、それぞれの分化過程に関わるbHLH型転写因子。
下パネル 野生型、spch 変異体、mute 変異体、fama 変異体にStomidazoloneを添加した時の表現型。
次に研究グループは、StomidazoloneのMUTE-SCRMとの相互作用をさらに調べるために、rBiFC法を用いた生化学的解析を行いました。rBiFC法は、相互作用が予想される2つのタンパク質にそれぞれYFP(蛍光タンパク質)のN末端半分とYFPのC末端半分を連結して発現させ、2つのタンパク質が結合するとYFPの光シグナルが検出されるという仕組みです。タバコの葉にSPCH-SCRM、MUTE-SCRM、FAMA-SCRM を発現させたところ、これらのタンパク質は相互作用するのでYFPシグナルが観察されました(図4、上パネル)。ところがStomidazoloneを投与し、同様に相互作用を調べたところ、図4下パネルのように、MUTE-SCRMヘテロ二量体ではシグナルがみられず、Stomidazolone はMUTE-SCRMヘテロ二量体の結合を特異的に妨害することが分かりました。
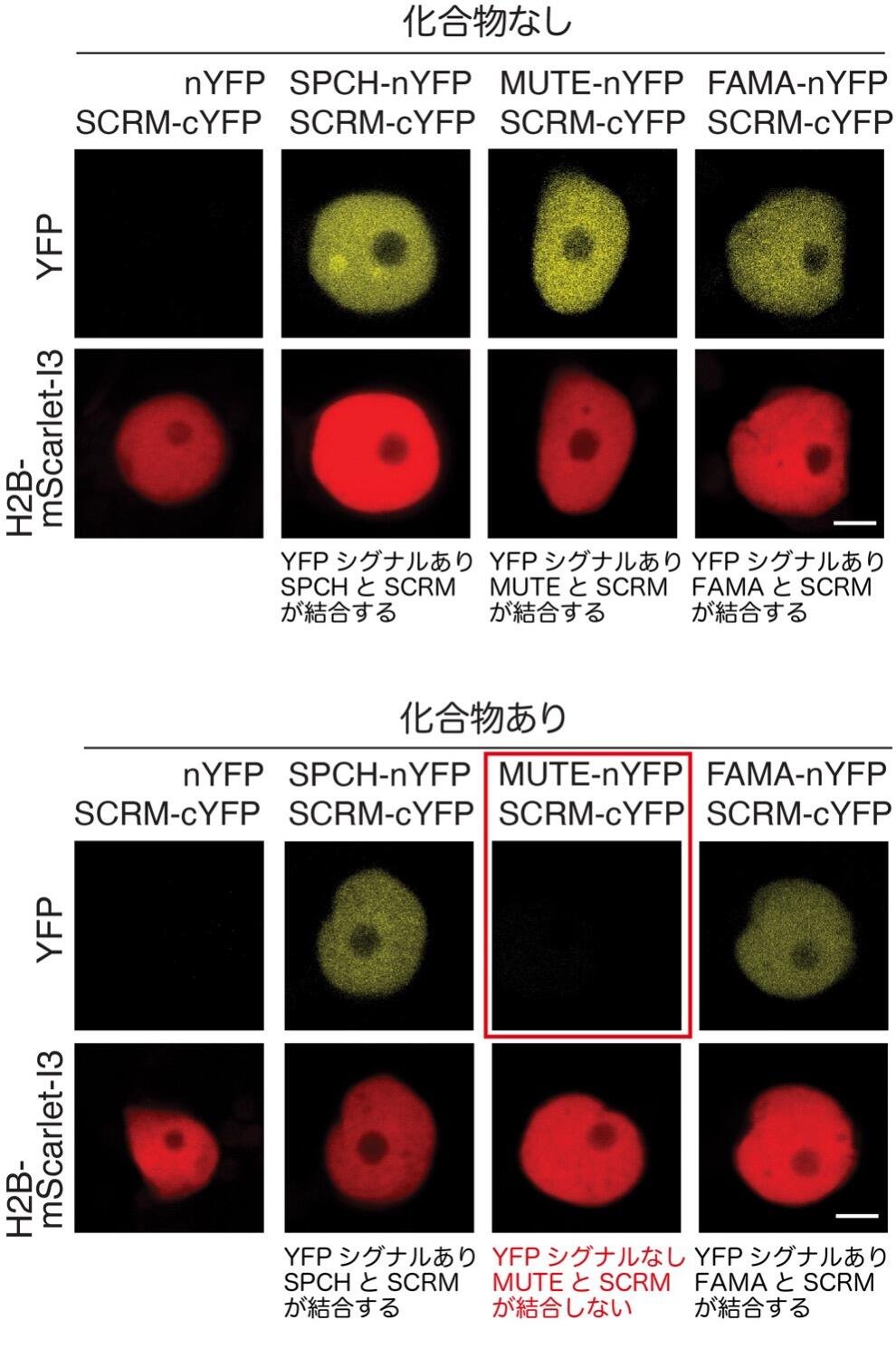
図4
rBiFCによるSCRMとSPCH, MUTE, FAMAとの相互作用解析。
上パネル 化合物なしでは、SPCH, MUTE, FAMA-nYFPとSCRM-cYFPが近傍にありYFPを発現する。コントロールとして導入したH3-mScarlet-I3も発現する。
下パネル Stomidazolone添加時では、SPCH,FAMA-nYFPとSCRM-cYFPが近傍にありYFPを発現するが、MUTE-nYFPとSCRM-cYFPが近傍になくYFPシグナルが検出されない。
さらに、計算化学的手法により、Stomidazoloneと結合しているMUTEタンパク質のアミノ酸残基を予想しました。StomidazoloneはMUTEタンパク質のC末端にあるACTドメイン上の、162番目のグルタミン酸(E162)、163番目のグルタミン酸(E163)、133番目のアルギニン(R133)、134番目のアルギニン(R134)に結合すると予測しました(図5、上パネル)。そこでこの分子モデルを検証するため、in vitroでMUTEタンパク質とStomidazoloneとの結合を調べました。その結果、E162とE163をそれぞれアラニンに置換した変異型MUTEとR133とR134をそれぞれアラニンに置換した変異型MUTEでは、野生型と比較してその結合が弱まっており、さらにE162, E163, R133, R134の4つのアミノ酸残基をアラニン置換した変異型MUTEでは、結合がほとんどみられなくなることが分かりました(図5、下パネル)。つまり、これら4つのアミノ酸残基が、Stomidazoloneとの結合に重要であることが強く示唆されました(図5)。
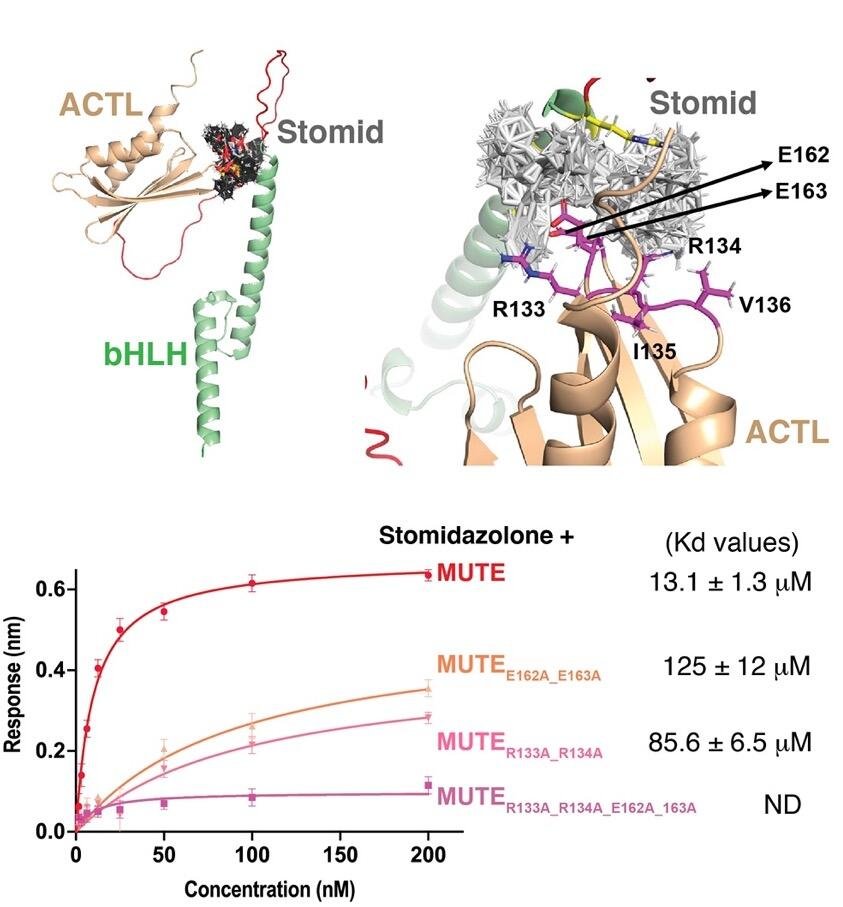
図5
左上パネル Stomidazolone-MUTEの結合モデル。
右上パネル 拡大したStomidazolone-MUTE結合モデル。結合推定部位 E162, E163, R133, R134をピンクで示す。
下パネル MUTEとStomidazoloneとの相互作用を示すBLI解析。変異型MUTEでは結合が弱まる。
これらのアミノ酸変異の効果を、植物体でも観察しました。mute 変異体に野生型MUTE-GFPを発現させた植物、mute 変異体に変異型MUTE E162A_E163A-GFPを発現させた植物、mute 変異体に変異型MUTE R133A_R134A-GFP を発現させた植物の3種類を作製し、Stomidazoloneを投与し気孔数を観察しました。野生型MUTE-GFPを発現させた植物では、気孔数が減り、メリステモイドの増加がみられました。一方、2種類の変異型MUTE-GFPを発現させた植物では、気孔数は化合物添加により変化せず、Stomidazolone耐性を示しました。以上の結果から、MUTEのE162, E163, R133, R134のアミノ酸残基がStomidazoloneとの結合と活性発現に重要であることが明らかになりました。
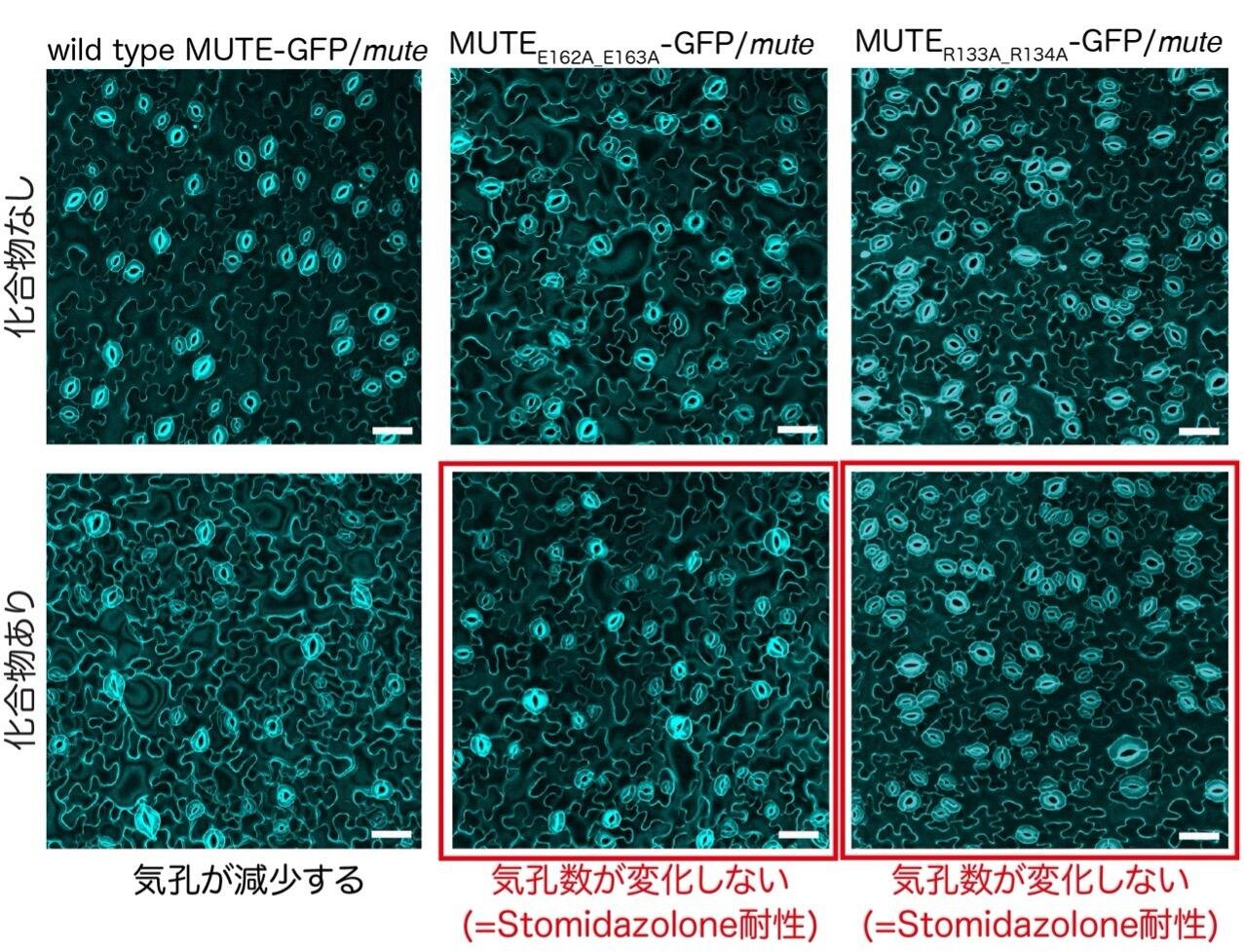
図6
mute変異体に野生型および変異型MUTE-GFPを発現させた植物のStomidazolone添加時の表現型。変異型MUTE-GFP植物はStomidazoloneに耐性を示す。
【成果の意義】
今回、研究グループは、イミダゾロン骨格を持つ化合物のStomidazoloneが顕著に気孔数を減らすことを発見しました。生化学的解析から、Stomidazoloneは気孔をつくる司令因子のMUTEのACTドメインに結合し、MUTEとそのパートナー因子のSCREAMのヘテロ二量体の形成を妨害していることを見出しました。気孔をつくる司令因子は、ヒトの幹細胞や神経の分化の司令因子と類似していますが、植物の司令因子だけに特徴的な領域のACTドメインにStomidazoloneが作用することで、植物の転写因子の機能阻害が生じ、気孔数が減ることが明らかになりました。さらに、計算化学を利用し、Stomidazoloneと結合しないMUTEタンパク質を設計し、Stomidazolone薬剤耐性を持つ植物体の創出にも成功しました。
本研究成果は、低分子化合物による植物の転写因子の機能阻害の新たな作用機序を明らかにするとともに、薬剤による気孔数を自在にコントロールすることが可能となり、乾燥地での農作物の栽培にも役立つなどの応用研究が期待されます。
【付記】
本研究は、科研費(JP16H01237, JP17H06476, JP19H00990)、名古屋大学高等研究院Young Leaders Cultivationプログラム、JSTさきがけ(JPMJPR20D8)、日本学術振興会JST CREST多細胞(JPMJCR1924)、ITbMアワード、戸部眞紀財団、立松財団の支援のもとで行われたものです。
【用語説明】
注1)気孔幹細胞:
気孔を作る孔辺細胞の元となる細胞のことで、メリステモイドと呼ばれる。図3上図にあるように、孔辺細胞の最初にメリステモイドが作られる。
注2)メリステモイドマーカー植物:
メリステモイドで強く発現する遺伝子のプロモーターにGFPやYFPのような蛍光タンパク質で連結させ、メリステモイドであることを簡単に見分けることができる植物。この論文では、TMM 遺伝子プロモーターにGUS-GFPを繋いだTMMpro::GUS-GFPと、MUTE 遺伝子プロモーターに核移行型YFPを繋いだMUTEpro::nucYFPを用いた。
Information
論文タイトル
Chemical inhibition of stomatal differentiation by perturbation of the master-regulatory bHLH heterodimer via an ACT-Like domain
著者
Ayami Nakagawa*, Krishna Mohan Sepuru*, Shu Jan Yip*, Hyemin Seo, Calvin M. Coffin, Kota Hashimoto, Zixuan Li, Yasutomo Segawa, Rie Iwasaki, Hiroe Kato, Daisuke Kurihara, Yusuke Aihara, Stephanie Kim, Toshinori Kinoshita, Kenichiro Itami, Soon-Ki Han, Kei Murakami+, and Keiko U. Torii+ *共筆頭著者 +責任著者
雑誌名 Nature Communications
DOI 10.1038/s41467-024-53214-4
発行年月 2024年10月


