2024-11-12 理化学研究所
理化学研究所(理研)生命医科学研究センター 免疫細胞治療研究チームの平原 裕也 研修生(研究当時)、清水 佳奈子 上級研究員、藤井 眞一郎 チームリーダー(最先端研究プラットフォーム連携(TRIP)事業本部創薬・医療技術基盤プログラム 副プログラムディレクター)らの共同研究グループは、子宮頸(けい)がん(CC:Cervical Cancer)の腫瘍免疫微小環境(TIME)[1]における特定の免疫細胞、特に免疫機能が疲弊状態にあるT細胞(LAG-3+ TIM-3+ T細胞[2]、疲弊T細胞)の重要な特徴を明らかにしました。疲弊T細胞は、腫瘍の進行や免疫調節に関与し、再発リスクのマーカーとしても有望であることが示唆されています。
今回、共同研究グループは、治療前に採取した23人の子宮頸がん患者の末梢血と腫瘍組織のナチュラルキラーT(NKT)細胞[3]、ナチュラルキラー(NK)細胞[3]、T細胞[3]を解析することで末梢血と腫瘍組織の免疫機能を比較しました。CC患者においても末梢血では機能的なNKT細胞とNKG2D[4]を高発現したNKG2Dhi NK細胞[4]を検出した一方で、腫瘍組織内では細胞の疲弊マーカー(LAG-3+TIM-3+)を発現したキラーT細胞(LAG-3+ TIM-3+ CD8+ T細胞[2]、疲弊キラーT細胞)の浸潤を検出しました。この結果は、末梢血および腫瘍部位での免疫細胞の解析が子宮頸がんの予後指標になり得ることを示唆しています。
本研究は、科学雑誌『British Journal of Cancer』オンライン版(10月29日付)に掲載されました。
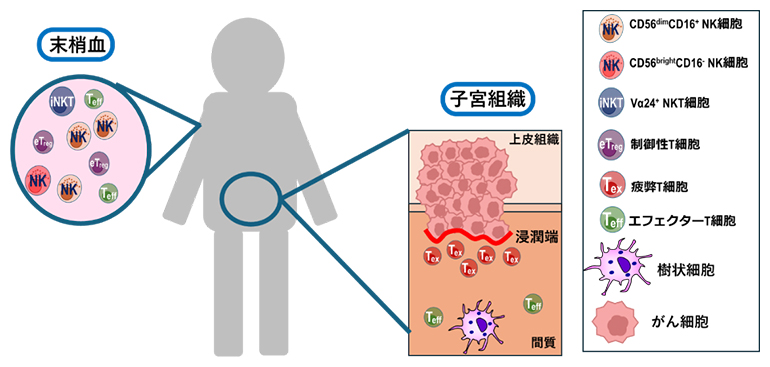
子宮頸がんにおける末梢血と腫瘍免疫微小環境の乖離(かいり)
背景
子宮頸がん(CC)は、世界の女性において4番目に多いがんであり、その発生率と死亡率は依然として高い水準にあります。2020年には、604,127件の新規症例と341,831件の死亡が報告されております注1)。進行期においては20%以上の患者が再発を経験し、治療選択肢も限られているため、新たな治療アプローチの開発が強く求められています。
CCは高リスクのヒトパピローマウイルス(HPV)[5]感染と密接に関連していることから、HPVワクチンによる予防効果が認められており、治療においても免疫療法が有望な選択肢とされています。免疫チェックポイント阻害剤[6]として知られる抗PD-1抗体や抗CTLA-4抗体は、CCの治療においても広く使用されています。しかし、再発・転移性CC患者に対する抗PD-1単剤療法の客観的奏効率(ORR)[7]は12.2%から26.3%と、有効性が十分でない症例が報告されています注2)。
がん細胞は免疫から逃れられる「環境」(腫瘍免疫微小環境)で生存しています。腫瘍免疫微小環境は、腫瘍の発生から発達・進行に多くの影響を与えます。そこで、がんの免疫学的要因の理解を深めるためには、NK細胞やT細胞の役割を明らかにして、腫瘍免疫微小環境における免疫応答のメカニズムを詳細に解析する必要があります。これまで、CC患者の腫瘍免疫微小環境の免疫応答性については分かっていませんでした。
本研究では、CC患者の血中を循環するリンパ球の細胞頻度や機能と腫瘍浸潤リンパ球(TIL)[8]を調べることによって、腫瘍免疫応答を解析することに挑みました。また、腫瘍部位におけるNKT細胞とNK細胞の役割を検討し、T細胞マーカーを用いてCC患者の免疫応答を評価しました。
注1)Sung, H., Ferlay, J., Siegel, R.L., Laversanne, M., Soerjomataram, I., Jemal, A. et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 71, 209-249 (2021).
注2)Chung, H.C., Ros, W., Delord, J.P., Perets, R., Italiano, A., Shapira-Frommer, R. et al. Efficacy and Safety of Pembrolizumab in Previously Treated Advanced Cervical Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol 37, 1470-1478 (2019).
Naumann, R.W., Hollebecque, A., Meyer, T., Devlin, M.J., Oaknin, A., Kerger, J. et al. Safety and Efficacy of Nivolumab Monotherapy in Recurrent or Metastatic Cervical, Vaginal, or Vulvar Carcinoma: Results From the Phase I/II CheckMate 358 Trial. J Clin Oncol 37, 2825-2834 (2019).
Tewari, K.S., Monk, B.J., Vergote, I., Miller, A., de Melo, A.C., Kim, H.S. et al. Survival with Cemiplimab in Recurrent Cervical Cancer. N Engl J Med 386, 544-555 (2022).
Li, C., Cang, W., Gu, Y., Chen, L. & Xiang, Y. The anti-PD-1 era of cervical cancer: achievement, opportunity, and challenge. Front Immunol 14, 1195476 (2023).
研究手法と成果
共同研究グループは、まずCC患者13名の末梢血の免疫解析を行い、次に腫瘍内の免疫状態(腫瘍免疫微小環境)を解析するために腫瘍組織を評価しました。早期(FIGO注3)分類ステージⅠ)と進行期(FIGO分類ステージⅡ-Ⅳ)の未治療のCC患者の末梢血から採取したNKT細胞、NK細胞、T細胞をフローサイトメトリー[9]を用いてそれぞれの細胞のサブセット(亜集団)を解析しました。
はじめに、早期と進行期を含むCC患者と健常者の末梢血中のNKT細胞数、NK細胞数、およびNK細胞のサブセット(CD56dimCD16+とCD56brightCD16–)の割合を確認したところ、いずれも両者で差はありませんでした。一方、NKG2Dの発現はCC患者において有意に増加しており、特にCD56dimCD16+NK細胞において顕著でした。さらに詳細に調べたところ、NKG2Dの発現は早期のCC患者では高く、がんの進行に伴い減少し、進行期のCC患者では低いことが分かりました。この結果は、がんの進行に伴い、CC患者のNK細胞は細胞傷害活性(細胞を破壊する活性)が鈍くなっていくことを示唆しています。
次に、末梢血中のNKT細胞の増殖率とIFN-γ(Ⅱ型インターフェロン)産生能を評価しました。NKT細胞の増殖率はCC患者と健常者に差はなく、CC患者のNKT細胞においてもIFN-γ産生能が保持されており、CC患者のNKT細胞は活性化して抗腫瘍効果を発揮する可能性を確認しました(図1A、1B)。活性化したNKT細胞はNK細胞の活性化を誘導することから、NKT細胞の増殖率の上昇とIFN-γ産生能の結果より、NK細胞についても解析したところ、培養後にCC患者のNK細胞(CD56dimCD16+とCD56brightCD16–)においてNKG2D発現レベルが有意に上昇していることが示されました(図1C)。NKG2DはNK細胞の免疫応答を促進する共刺激(2次シグナル)[4]分子であることから、CC患者の末梢血中においてもNKT細胞、NK細胞の免疫応答性が維持されていることが分かりました。
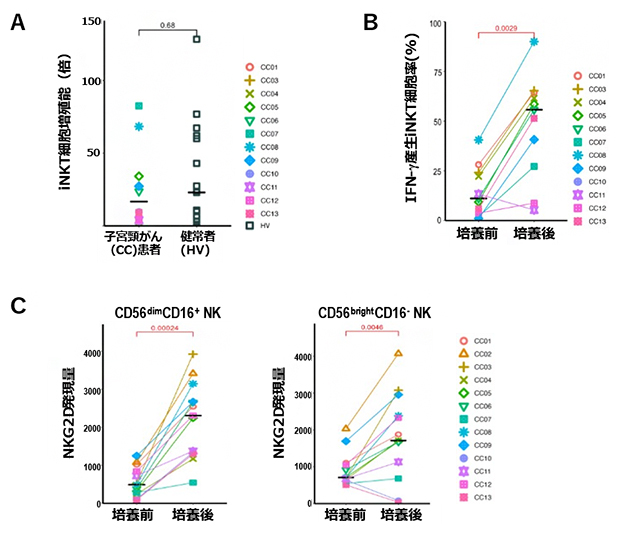
図1 NKTリガンドによるNKT細胞とNK細胞の活性化
(A)CC患者(CC01~CC13)および健常者(HV)のiNKT細胞(インヴァリアントNKT、NKT細胞の一つ)増殖率の比較。増殖率はCC患者と健常者の両者に差がない。
(B)CC患者におけるIFN-γ産生iNKT細胞率。CC患者でもIFN-γの産生能が保たれている。
(C)CC患者のCD56dimCD16+NK細胞とCD56brightCD16–NK細胞のNKG2D発現レベル。NKG2D発現レベルが有意に上昇していることが示されている。
続いて、治療前に採取したCC患者の腫瘍免疫微小環境におけるNK細胞およびキラーT細胞(CD8+T細胞)[2]を解析して、腫瘍組織内での免疫細胞を評価しました。その結果、腫瘍部位およびその境界近傍の領域である浸潤端部位では、正常な非腫瘍部位や上皮領域よりもNK細胞が多く検出されました。この差は統計的に有意ではなく、がん病巣部の上皮領域でのNK細胞の頻度は極めて低いものでした。ただ、統計的に有意ではないとはいえ、がん病巣部周囲にNK細胞が存在する事実、また末梢血のNK細胞が反応する事実は、腫瘍組織内で免疫細胞が活性化し得ることを示唆するものであり、重要な発見です。また、腫瘍の浸潤端部位および腫瘍部位に疲弊キラーT細胞が集積していることが確認されました。一方、非腫瘍部位にはキラーT細胞の集積が見られませんでした。
次に、T細胞のチェックポイントマーカーの発現を調べました。上皮領域の腫瘍部位ではチェックポイントマーカーPD-1が陽性のキラーT細胞(PD-1+CD8+T細胞)の有意な増加が認められました(図2A)。一方で、疲弊キラーT細胞は、PD-1+CD8+T細胞に比べてより多く間質領域の腫瘍部位および浸潤端部位に蓄積していることが明らかになりました(図2B)。この結果は、キラーT細胞が腫瘍細胞を排除しようとしていた形跡であり、がんへの免疫反応が正しく起こっていたことを示唆するものです。しかしながら末梢血の状態と異なり、疲弊キラーT細胞の存在は組織内のキラーT細胞が機能性を失いつつあることを意味し、がんの進行に関与していると考えられます。
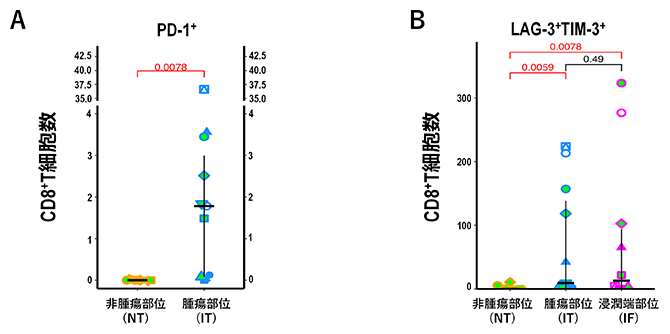
図2 多重免疫組織化学法による腫瘍内CD8+ T 細胞の解析
(A)上皮領域の非腫瘍部位(NT)と腫瘍部位(IT)におけるPD-1+CD8+ T細胞数。腫瘍部位において有意な増加が確認される。
(B)間質領域の非腫瘍部位(NT)、腫瘍部位(IT)、浸潤端部位(IF)におけるLAG-3+TIM-3+CD8+ T細胞数。腫瘍部位および浸潤端部位において蓄積していることが分かる。
注3)International Federation of Gynecology and Obstetrics(国際産婦人科連合)
今後の期待
本研究において、CC患者の末梢血中に機能的なNKT細胞とNK細胞の免疫応答が維持されていること、腫瘍の浸潤端部位および腫瘍部位に疲弊キラーT細胞が集積していることが明らかになりました。この結果は、キラーT細胞が腫瘍細胞を排除しようとしていた形跡であり、がんへの免疫反応が正しく起こっていたことを示唆するものです。しかしながら末梢血の状態と異なり、疲弊キラーT細胞の存在は組織内のキラーT細胞が機能性を失いつつあることを意味し、がんの進行に関与していると考えられれます。このような末梢血、および腫瘍免疫微小環境における自然免疫と獲得免疫の重要な特徴を明らかにした本研究の成果は、CC患者の予後の層別化に役立つ新たなバイオマーカーの検出につながることが期待されます。
補足説明
1.腫瘍免疫微小環境(TIME)
腫瘍組織内には、さまざまな種類の免疫細胞や血管や線維芽細胞など多くの正常細胞が、腫瘍細胞と共に混在しており、それら構成細胞の比率や種類は患者ごとに多様である。腫瘍内でがん細胞と免疫細胞は複雑に相互作用し、これらは患者の予後や治療反応性に大きく関連する重要な要素であり、腫瘍免疫微小環境(TIME)と呼ばれる。腫瘍内でがん細胞や非免疫細胞と免疫細胞が相互作用することにより、腫瘍の増殖、転移に有利な腫瘍免疫微小環境が構築されると考えられている。腫瘍免疫微小環境の理解によりがん免疫療法の効果を向上させることが期待できる。TIMEはTumor Immune MicroEnvironmentの略。
2.LAG-3+ TIM-3+ T細胞、LAG-3+ TIM-3+ CD8+ T細胞、キラーT細胞(CD8+T細胞)
T細胞([3]参照)の中でキラーT細胞は、細胞表面にCD8と呼ばれる特徴的なタンパク質を発現するもので、CD8+T細胞とも呼ばれる。活性化すると、ウイルス感染細胞やがん細胞を殺傷する役割を果たす。LAG-3とTIM-3は免疫チェックポイント分子で、T細胞の疲弊を示すマーカーとして知られている。LAG-3+ TIM-3+ T細胞とLAG-3+ TIM-3+ CD8+ T細胞はいずれも免疫チェックポイントマーカーで、LAG-3+ TIM-3+ T細胞は免疫機能が疲弊状態にあるT細胞(疲弊T細胞)、LAG-3+ TIM-3+ CD8+ T細胞は免疫機能が疲弊状態にあるキラーT細胞(疲弊キラーT細胞)。
3.ナチュラルキラーT(NKT)細胞、ナチュラルキラー(NK)細胞、T細胞
T細胞は胸腺という組織で分化、成熟したリンパ球の一種。獲得免疫をつかさどり、抗原提示細胞から抗原情報を受け取ることで、さまざまな機能を発揮する。ナチュラルキラーT(NKT)細胞、ナチュラルキラー(NK)細胞は両者とも自然免疫を担うリンパ球である。NK細胞は、ウイルスによる感染やがん細胞に対する初期防御機構としての働きを担っている。NKT細胞は、NK細胞のマーカーと1種類のT細胞受容体を発現していて、アレルギー疾患、がん、自己免疫疾患を制御する機能を持つ中核的な免疫調節細胞である。
4.NKG2D、NKG2Dhi NK細胞、共刺激(2次シグナル)
NKG2DはNK細胞の主要な活性化受容体の一つであり、ストレス誘導性のリガンドを認識し、NK細胞の細胞傷害活性(細胞を破壊する活性)を誘導する。NKG2Dhi NK細胞はNKG2Dが高発現したNK細胞。共刺激(2次シグナル)とは免疫応答を強化するために必要な追加的なシグナルで、NKG2DはNK細胞の免疫応答を促進する共刺激(2次シグナル)分子である。
5.ヒトパピローマウイルス(HPV)
皮膚や粘膜に感染するウイルスで、100種類以上の型があることが報告されている。高リスク型のウイルスは、子宮頸がんをはじめとするがんの発生を誘導することが明らかになっている。HPVはHuman PapillomaVirus の略。
6.免疫チェックポイント阻害剤
免疫チェックポイント阻害剤は、T細胞の活性化を抑制する負の共刺激分子(PD-1、CTLA-4)およびそのリガンドに結合し、その作用を阻害する抗体の総称。T細胞の免疫抑制を解除することにより、抗腫瘍免疫応答を増強する。
7.客観的奏効率(ORR)
治療薬の効果が確認された患者の割合を示す数値。臨床試験において、新しい治療薬の有効性を評価する重要な指標として使用される。ORRはObjective Response Rateの略。
8.腫瘍浸潤リンパ球(TIL)
血管から腫瘍内に浸潤し、抗腫瘍活性を有するリンパ球(B細胞、T細胞、NK細胞)の総称。TILはTumor Infiltrating Lymphocytesの略。
9.フローサイトメトリー
一個一個の細胞にレーザー光を照射し、その散乱光や蛍光を測定することで、細胞の情報を取得したり、特定の細胞を分取したりする技術。本研究では、赤色蛍光タンパク質を持つ細胞外小胞を取り込んだ細胞を分離・分取するために用いた。
共同研究グループ
理化学研究所 生命医科学研究センター 免疫細胞治療研究チーム
研修生(研究当時)平原 裕也(ヒラハラ・ユウヤ)
上級研究員 清水 佳奈子(シミズ・ナカコ)
チームリーダー 藤井 眞一郎(フジイ・シンイチロウ)
(最先端研究プラットフォーム連携(TRIP)事業本部 創薬・医療技術基盤プログラム 副プログラムディレクター)
横浜市立大学大学院 医学研究科 生殖生育病態医学
教授 宮城 悦子(ミヤギ・エツコ)
神奈川県立がんセンター 臨床研究所
研究所長 宮城 洋平(ミヤギ・ヨウヘイ)
原論文情報
Yuhya Hirahara, Kanako Shimizu, Satoru Yamasak,omonori Iyoda, Shogo Ueda, Shinya Sato, Jotaro Harada, Haruya Saji, Satoshi Fujii, Yohei Miyagi, Etsuko Miyagi, Shin-ichiro Fujii, “Crucial Immunological roles of the invasion front in innate and adaptive immunity in cervical cancer”, British Journal of Cancer, 10.1038/s41416-024-02877-3
発表者
理化学研究所
生命医科学研究センター 免疫細胞治療研究チーム
研修生(研究当時)平原 裕也(ヒラハラ・ユウヤ)
上級研究員 清水 佳奈子(シミズ・カナコ)
チームリーダー 藤井 眞一郎(フジイ・シンイチロウ)
(最先端研究プラットフォーム連携(TRIP)事業本部 創薬・医療技術基盤プログラム 副プログラムディレクター)
報道担当
理化学研究所 広報室 報道担当