2024-11-28 東京農工大学
東京農工大学大学院工学府 竹田浩章研究員、松沢佑紀研究員、竹内愛美大学院生、工学研究院生命機能科学部門 津川裕司教授(理化学研究所生命医科学研究センター客員研究員)、慶應義塾大学薬学部 有田誠教授(理化学研究所生命医科学研究センターチームリーダー)、そしてフランス分子細胞薬理学研究所(IPMC、フランス国立科学研究センター、コートダジュール大学、フランス国立衛生医学研究所)原山武士研究員の国際共同研究グループは、脂質の多様性プロファイリング、脂質構造の異性体識別、そして脂質局在の可視化を行う質量分析データ解析プログラム「MS-DIAL 5」を開発しました。これにより、マウスの目に存在する脂質多様性とその局在を捉え、視機能維持に重要な脂質と考えられている超長鎖多価不飽和脂肪酸(VLC-PUFA)注1がホスファチジルコリン(細胞膜を構成するリン脂質の一種、PCと表記)の特定の場所に取り込まれる分子機序の一端を明らかにしました。脂質代謝を捉えるための様々な質量分析法が利用可能な現代において、多様な(マルチモーダルな)データの統合的な解析が可能な「MS-DIAL 5」は生命科学の基礎・応用研究を革新的に加速させる情報解析プログラムとして活用されることが期待されます。
本研究成果は、科学雑誌『Nature Communications』(11月28日付)に掲載されます。
報道解禁日:11月28日 午後7時00分(日本時間)
論文タイトル:MS-DIAL 5 multimodal mass spectrometry data mining unveils lipidome complexities
URL:https://www.nature.com/articles/s41467-024-54137-w
背景
代謝とは生体内の化学反応です。生命は代謝によって生きるために必要な分子、たとえばDNAやタンパク質、そして脂質を合成します。脂質は細胞膜の構成成分であるため、細胞内外の物資輸送やタンパク質機能を含む様々な生体反応場を作り出します。そのため細胞の個性は脂質によって構成されているといっても過言ではなく、各細胞が共創的に集合することで組織や臓器が構成され、ヒトの生命活動が維持されています。
特定の機能や形を持つ細胞を作り出すため、ヒトは多様な脂質(リン脂質や糖脂質)を合成します。また食べ物に含まれる脂質や腸内細菌が産生する脂質まで合わせると、ヒトの生体内には少なくとも1万種を超える脂質分子が存在すると考えられています。このような多様な脂質を捉えるためのリピドミクス注2手法として、津川教授らの研究グループはこれまで質量分析と呼ばれる分析手法と情報解析技術の研究開発を推進してきました。近年、脂質代謝解析の目的に応じてその質量分析手法は多岐にわたるようになり、(1)脂質多様性を網羅的にプロファイリングするノンターゲットリピドミクス注3、(2)脂質構造の異性体を識別する構造リピドミクス注4、そして(3)脂質分子の局在を可視化する空間リピドミクス注5と呼ばれる3つの手法が脂質多様性の生物学を開拓する上で必須の手法として認知されるようになっています。しかしながら、これら多様な(マルチモーダルな)質量分析手法から得られたデータを解析するための情報解析プログラムは無く、データ解析工程が脂質代謝研究の最大のボトルネックでした。
そこで本研究グループは、これまで開発してきたMS-DIALプログラムをマルチモーダル質量分析データに対応できるように刷新し、上記3つの質量分析手法で得られたデータを円滑に解析する「MS-DIAL5」を新たに開発することにしました。MS-DIALは質量分析データから代謝物(メタボローム)情報を抽出するプログラムであり、世界中の研究者が使用するメタボロミクス・リピドミクスに欠かせない情報解析プログラムです。また、プログラム開発だけでなく、構造リピドミクスに資する分析化学手法を最適化することで異性体識別性能を向上させることを目指しました。そして開発した手法を、マウスの目に存在する脂質代謝解析に適用することで、これまで未解明であった超長鎖多価不飽和脂肪酸(VLC-PUFA)を含むリン脂質の生合成経路を明らかにすることを試みました(図1)。
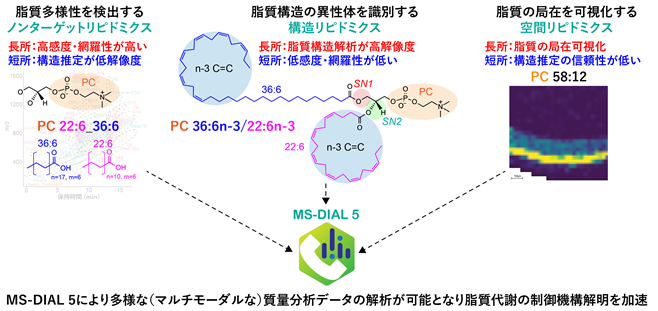 図1.本研究の概要
図1.本研究の概要
研究体制
本研究は、東京農工大学大学院工学府の竹田浩章研究員、松沢佑紀研究員、竹内愛美大学院生、西田孝三研究員、轟善勝大学院生、清水邦善大学院生、坂本七海大学院生、岡昂輝大学院生、鄭美和研究員、栗崎優斗大学院生、木内佐紀大学院生、時吉花菜子大学院生、ブヤントグトク・ブジンラハム学部生、倉田明咲学部生、熊久保涼太大学院生、田中剛教授、吉野知子教授、津川裕司教授、同大学大学院農学府の長谷川真由大学院生、宮本潤基テニュアトラック准教授、理化学研究所環境資源科学研究センターの高橋みき子テクニカルスタッフⅠ、同センター森哲哉専門技術員、フランス分子細胞薬理学研究所(IPMC)の原山武士研究員、慶應義塾大学薬学部の前川大志講師(研究当時)、同大学薬学部 有田誠教授、パラツキー大学オロモウツのクヴァスニチカ・アレシュ大学院生、株式会社エービー・サイエックスの建田潮氏、理化学研究所生命医科学研究センターの内野春希特別研究員、AGC株式会社 田辺佳奈氏、同社 竹田薫識氏、島津製作所 岡本真美氏、同社 高橋秀典氏によって実施されました。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業ERATO「有田リピドームアトラスプロジェクト」JPMJER2101、同 ライフサイエンスデータベース統合推進事業「統合化推進プログラム(本格型)」JPMJND2305、AMED革新的技術による脳機能ネットワークの全容解明JP15dm0207001、AMED新興・再興感染症研究基盤創生事業21wm0325036h0001、JSPS科研費基盤研究B 24K02011、挑戦的研究(開拓)21K18216・24K21269、国立がん研究センター研究開発費「質量分析インフォマティクス」2023-A-08、ATIP-Avenir program (CNRS-Inserm)、東京農工大学融合研究支援制度(TAMAGO)、そして同大学Global Innovation Research fundsの支援を受けて行われました。
研究成果
本研究の大きな成果は、構造リピドミクスと空間リピドミクスデータの解析環境を整備したことです。リピドミクスでは、質量分析法が利用されます。質量分析とは、分子をイオン化し、その質量(m)を電荷(z)で割った値m/zで分子の質量と強度を観測する手法です。また、イオン化された分子に対して装置内の衝突室と呼ばれる場所にてエネルギーを加え、分子イオンを断片化することで断片化イオンを生成することができます。この断片化のパターンは分子の構造に特異的であるため、その断片化パターン(MS/MS)をライブラリー(分子構造がわかっている物質でMS/MSのデータを取り、それらを蓄積したもの)と照合することで分子構造の推定が可能です。本研究では、構造リピドミクス手法で用いられるMS/MS法の1つであるelectron activated dissociation (EAD)法に着目し、それを用いた分析手法およびスペクトル解析手法の開発に取り組みました。EAD法は、質量分析装置内部にて分子に電子エネルギーを与えることで、分子を形作る化学結合のホモリティック開裂(電子対を均等に分離させることによるラジカルの生成)を分子内の様々な場所で引き起こす手法です。これまで頻用されてきたcollision induced dissociation(CID)法と呼ばれる開裂方法は、エステル結合やペプチド結合など結合エネルギーが比較的小さな場所でしか開裂を引き起こさないのに対し、EAD法では炭素―炭素間の結合も開裂させるため、非常に多くの構造特異的なスペクトル情報が得られます(図2)。
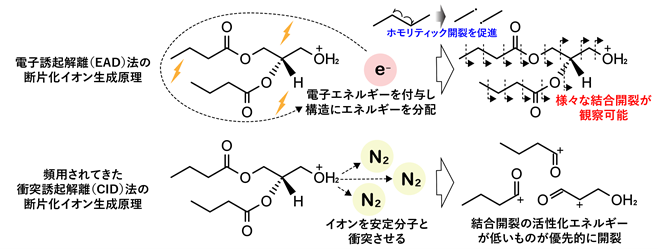
図2.ノンターゲットリピドミクスで利用されるCID法と構造リピドミクスのため本研究で利用したEAD法の原理。(上)EAD法では、物質内に多数存在する炭素-炭素結合のどこでも開裂させることができるので、様々な大きさの断片が生じる。それらの断片化が発生しうる物質を考えることで、もとの物質の構造を推測することができる。(下)CID法では、特定の場所だけが優先的に開裂するため、物質全体がどのような構造になっているのかわからない。
この性質を利用することで、リン脂質のリンカー部分であるグリセロール骨格のSN1・SN2注6脂肪酸位置異性体や、水酸化脂肪酸の位置異性体、そして二重結合位置異性体を、その特異的開裂によって生じるm/zの値や断片化イオンの強度パターンによって判別することが可能になります。また、EAD法ではその二重結合の位置までが推定できるので、たとえばオレイン酸の二重結合位置(カルボン酸末端から数えて9番目の炭素)情報を付与して18:1(9)と記載することが可能です。一方、CIDでは二重結合情報が付与できないため18:1と記載することになります。脂肪酸を構成する炭素数が同じ分子でも、二重結合の位置やSN1/SN2のどちらの位置に脂肪酸が結合しているかによって、分子機能や化学反応における役割などが変化します。そのため、このような異性体を区別して解析することは、生化学研究に貢献するだけでなく、疾患の分子メカニズムを理解する上で重要です(図3)。
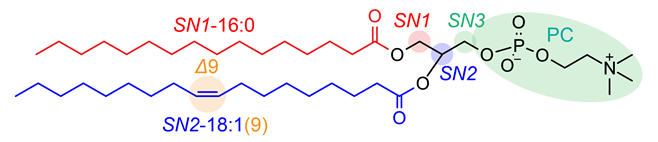
図3.本研究の構造リピドミクスで推定可能な脂質分子構造の概要:図示されている構造はPC 16:0/18:1(9)と表され、スラッシュの左側・右側はそれぞれSN1・SN2に結合している脂肪酸側鎖を意味し、括弧内は二重結合位置を示す。
本研究グループは、二重結合の位置だけが異なる物質同士(構造異性体)の識別を自動で可能にするアルゴリズムをMS-DIAL 5に実装しました。アルゴリズム検証のため、100種類以上の標準品を様々な濃度で調整したものから得られたスペクトルを用いてプログラム性能をテストしたところ、SN位置と水酸基位置異性体については100%の精度で異性体識別に成功しました。また、二重結合位置異性体についても、様々なテスト項目において91%〜96%の精度で推定可能であることがわかりました。今回のプログラム検証の結果は、異性体が共溶出する状況においても存在量が最も多い異性体を高い精度でアノテーション(質量分析によって検出されるピークに対して代謝物質名を付与すること)することが可能であることを示しています(図4)。
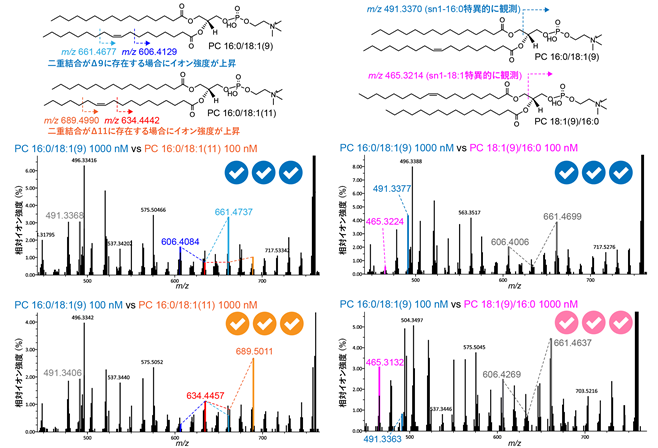
図4.MS-DIAL5プログラム検証結果の一例.PC 16:0/18:1(9)、PC 16:0/18:1(11)、PC 18:1(9)/16:0の異性体が共溶出した場合のスペクトルの識別に用いる重要な診断イオンをカラーで示す。スペクトルパネル右上のチェックマークは3つの反復データでMS-DIALが正確に、最も存在量の多い異性体を識別できたことを示している。
本研究グループはさらに、動物の視機能に重要とされる超長鎖多価不飽和脂肪酸(VLC-PUFA)をアシル基として含むホスファチジルコリン(VLC-PUFA PC)の構造解析を目的とし、開発した手法を構造リピドミクスに適用しました。近年発表した固相精製法注7を適用して、マウスの目に含まれる脂質成分のEAD法による分析およびMS-DIAL 5による解析を行ったところ、618種類のユニークな脂質構造情報が得られ、そのうち250種類については従来のCID法では識別できない異性体情報を得ることができました。本研究において「広く浅い解析」法として位置づけられるCID法では771種類のユニークな脂質情報が得られたことと比較すると、感度が問題視されていた構造リピドミクスが「狭く深い解析」法から「広く深い解析」法に近づいてきたと考えられます。これは、インフォマティクスだけでなく、脂質抽出の前処理および分析化学の技術開発の総合的な成果であると言えます。また、本手法により、目に含まれるVLC-PUFAの多くは二重結合を6個含むオメガ3脂肪酸(32:6n-3、34:6n-3など)であること、そしてVLC-PUFAがPCのSN1に選択的に濃縮されていることがわかりました(n-3はオメガ3を意味する表記)。また、二重結合の位置の正しさについては、oxygen attachment dissociation (OAD)法と呼ばれるMS/MS法によっても検証を行い、推定構造が確からしいことを確認しました。このVLC-PUFA PCについて既に公開されているデータとの比較から、同じ不飽和度を持つオメガ3脂肪酸であるDHA(22:6n-3)とは別の代謝制御機構を受けてPCに取り込まれている可能性を示唆する結果を得ました。さらに、VLC-PUFA脂肪酸を培養細胞(HeLa細胞)に添加するだけでPCに取り込まれるだけでなく、SN1位置選択性も維持されることがわかりました(図5)。
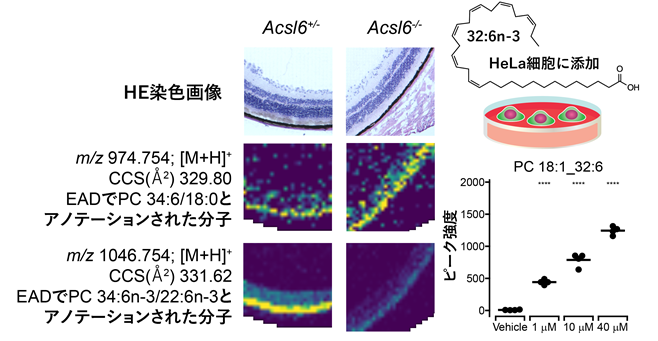
図5.MS-DIAL5による空間リピドミクス再解析とHeLa細胞を用いたVLC-PUFA添加実験の結果。網膜においてDHA(22:6n-3)をリン脂質に濃縮する脂質代謝酵素が働いているマウス(左の画像)では、22:6n-3を含むリン脂質(最下段)が存在する一方、働いていないマウス(右の画像)では22:6n-3を含むリン脂質量が減弱している。一方、多価不飽和脂肪酸として34:6n-3のみを含むリン脂質は変化していないことがわかる(中段)。また、32:6n-3の添加量の増加に伴い、Hela細胞中の32:6n-3リン脂質(PC 18:1_32:6)の量も上昇していることから、HeLa細胞にも存在する代謝酵素で32:6n-3がリン脂質へと取り込まれることがわかった。
本研究グループは、試験管内で飽和脂肪酸であるパルミチン酸、超長鎖多価不飽和脂肪酸のVLC-PUFA、そしてVLC-PUFAと二重結合数が同じ数であるDHAに対する基質特異性を検証しました。着目したのは、glycerol 3-phosphate acyltransferase(GPAT)という代謝酵素です。この酵素は、パルミチン酸のような飽和脂肪酸をリン脂質のSN1に導入する活性があることが知られています。本研究グループは、VLC-PUFA構造の一部がパルミチン酸と類似していることに着目し、GPATの基質認識能を検証しました。その結果、GPATがDHAとは反応しない一方、パルミチン酸とVLC-PUFAとは反応することがわかりました。このことは、GPATはパルミチン酸同様にVLC-PUFAを基質として取り込み得ることを示しており、「視細胞におけるVLC-PUFA PCがSN1に濃縮される仕組みの分子機序としてGPATが関与している」という仮説を支持する結果となりました(図6)。
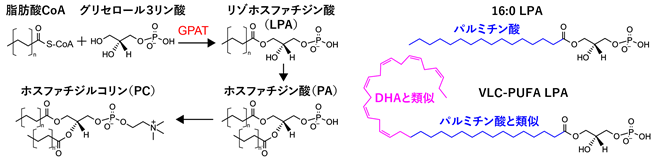
図6.VLC-PUFA PC生合成におけるGPATの役割と飽和脂肪酸(パルミチン酸)との構造類似性。(左側)GPATはパルミチン酸のような飽和脂肪酸を基質として好む性質があり、生成物であるリゾホスファチジン酸のSN1に脂肪酸を選択的に取り込むことが知られている。(右側)VLC-PUFA LPAは、パルミチン酸とDHAのいずれとも類似した構造を持っている一方、本研究ではパルミチン酸との構造類似性に着目した。
今後の展開
本研究では、ノンターゲットリピドミクスだけでなく、構造リピドミクスや空間リピドミクスデータの解析が可能なMS-DIAL 5を新たに開発したことで、脂質の異性体構造およびその局在を高精度に可視化することが可能になりました。また本技術により、目に特異的な脂質代謝環境を詳細に解析して検証を重ねることで、これまで未解明であった超長鎖多価不飽和脂肪酸がリン脂質へ導入される分子機序の一旦を明らかにしました。MS-DIALのユーザー数は増加の一途を辿り、メタボロミクスやリピドミクスを行う研究者が第一選択として利用する情報解析プログラムとなりました。また、様々なプログラムのベンチマークにもなっています。そのため、世界の学術の発展のためにも、プログラムが出力する代謝物情報は正確でなければならず、信頼性の高い代謝物構造およびその発現量を提供する責任を担うようになってきました。このことから、質量分析法の進化を鵜呑みにせず、データを精査することでスペクトルの情報量に基づいた高精度のアノテーション環境を今後も構築していく予定です。また、本研究で開発した構造リピドミクス法の適用範囲は、脂質多様性の全体像から考えるとほんの一部にすぎず、その適用を拡大するための分析化学や情報解析技術の継続開発は必須です。今後も、工学と情報解析技術の発展により脂質多様性の生物学における新たな機能などを明らかにしていくことで、生命科学研究全体の発展に貢献することを目指します。
用語解説
注1 )超長鎖多価不飽和脂肪酸(VLC-PUFA)
多価不飽和脂肪酸は二重結合を2つ以上含む脂肪酸を意味する。本研究では、炭素数28以上の脂肪酸を超長鎖脂肪酸と定義した。特に、不飽和度6つの超長鎖多価不飽和脂肪酸に着目して研究を行っている。
注2 )リピドミクス
オミクスという言葉は、生体分子の全て(総体)を表す意味で学術的に用いられる。たとえば遺伝子(Gene)のすべて(Omics)でゲノミクス、タンパク質(Protein)のすべて(Omics)でプロテオミクス、代謝物(Metabolite)のすべて(Omics)でメタボロミクスである。脂質は代謝物に含まれるものであるが、脂質(Lipid)に焦点をあてて解析される場合リピドミクスと呼ばれる。
リピドミクスにおいては、脂肪酸側鎖をその炭素数と不飽和度の数で記載する。たとえばパルミチン酸は炭素数16で二重結合数が0の飽和脂肪酸であり、16:0と表記される。また、オレイン酸は炭素数18で二重結合が1つのモノ不飽和脂肪酸であり、18:1と表記される。また、16:0がSN1、18:1がSN2に結合していると特定できる場合は2本のアシル基をスラッシュで区切り、PC 16:0/18:1のように表示する。一方、SN1とSN2のどちらに結合しているか不明な場合はアンダーバーで区切り、PC 16:0_18:1のように表す。
注3 )ノンターゲットリピドミクス
分析対象を絞らない脂質分子種解析の方法。具体的には、液体クロマトグラフィータンデム型質量分析(LC-MS/MS)を用いて、液体クロマトグラフィーより溶出したすべての分子をイオン化し、検出する。検出されたイオンの分子構造を、同時取得可能な断片化イオンスペクトルに基づき推定を行う。断片化イオンスペクトルとは、質量分析装置内部の衝突室と呼ばれるところでエネルギーを与えて分子イオンを断片化することによって得られるマススペクトル(MS/MSとも言う)を意味する。ノンターゲットリピドミクスで用いられる開裂手法は、衝突誘起解離(collision induced dissociation: CID)と呼ばれるものである。
注4 )構造リピドミクス
英語ではstructural lipidomicsと呼ばれるものであり、通常は英語のまま用いられるがここでは構造リピドミクスとした。脂質分子種の構造を質量分析情報によって詳細に読み解くことを意図した言葉である。つまり、分析化学において分子構造解析に使用される手法として質量分析(MS)法、核磁気共鳴(NMR)法、X線結晶構造解析法の3つが挙げられる。本来、この3つの手法すべてを利用することで初めて分子構造の完全な構造決定が可能と言えるが、昨今では質量分析のみから脂質構造の完全な構造決定を目指した研究が行われるようになっている。
注5 )空間リピドミクス
英語ではspatial lipidomicsと呼ばれる。脂質分子種の組織や細胞内での局在を可視化する手法を意味する。頻用される装置として、マトリックス支援レーザー脱離イオン化(MALDI)法が知られている。本研究では、質量分析内部でイオンをその分子構造(正確には衝突断面積と呼ばれる値)によって分離することが可能なイオンモビリティハイブリッド型のMALDI-MSによって取得されたデータを扱っている。
注6 )SN1・SN2
グリセロールに存在する3つのヒドロキシル基(OH基)の真ん中のOHに結合する炭素をSN2、両端に結合するものをSN1・SN3と呼び、通常アシル基が結合しているものをSN1、極性基が結合している側をSN3と呼ぶ。
注7 )固相精製法
多様な脂質分子を分画・濃縮する技術の1つ。詳細は東京農工大学プレスリリース(2024年10月28日)「生命の脂質多様性を紐解く精製技術を開発 -分画と濃縮により未知の脂質分子の発見を加速-」に記載している。
◆研究に関する問い合わせ◆
東京農工大学 大学院工学研究院
生命機能科学部門 教授
津川 裕司(つがわ ひろし)
◆報道に関する問い合わせ◆
東京農工大学 総務課広報室
科学技術振興機構 広報課
慶應義塾 広報室
理化学研究所 広報室 報道担当