2024-12-20 慶應義塾大学,東京大学
発表概要
東京大学大学院新領域創成科学研究科博士課程3年の薛世玲那、慶應義塾大学再生医療リサーチセンターの岡野栄之センター長/教授(研究当時:慶應義塾大学医学部生理学教室・教授)、森本悟副センター長/特任准教授(研究当時:慶應義塾大学医学部生理学教室・専任講師)、ならびに東京大学定量生命科学研究所の泊幸秀教授らの共同研究グループは、筋萎縮性側索硬化症(amyotrophic lateral sclerosis;ALS;注1)の研究において、人工多能性幹細胞(iPSC;注2)からの効率的な下位運動ニューロン(注3)誘導法を開発しました。さらに、Artificial Intelligence(AI)画像解析技術とシングルセル追跡技術を活用することで、疾患表現型を簡便かつ再現性高く評価できる方法を開発しました。本研究成果は、2024年12月19日午前11時(米国東部時間)に、International Society for Stem Cell Research(国際幹細胞学会)発行でCell PressグループのStem Cell Reports(オンライン版)に掲載されました。
1. 研究背景
ALSは進行性の致死性神経変性疾患です。運動ニューロンの変性・脱落にともない、筋力低下、呼吸不全をきたし、最終的に3-5年の経過で死に至ります。しかし、ALSの病態メカニズム、特に神経変性のメカニズムの全容は未だ明らかではなく、治療法の確立には時間を要しています。このため、ALSの疾患理解を深め、候補薬の治療効果を迅速に評価できる技術への高いニーズがあります。
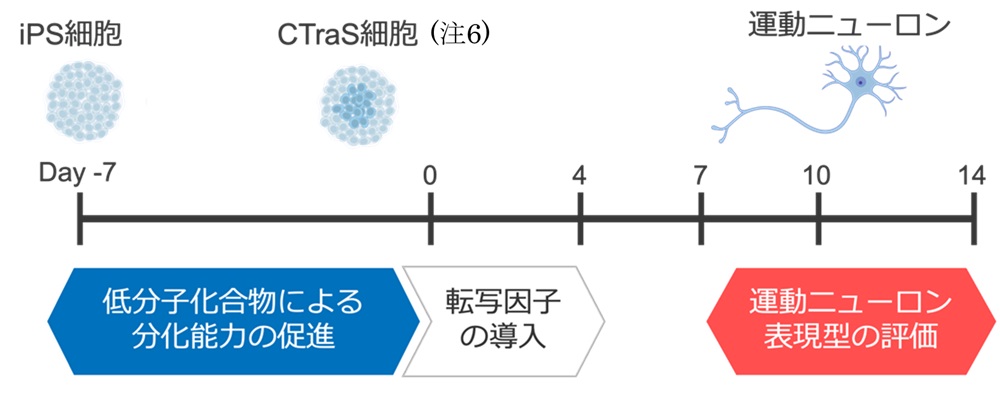
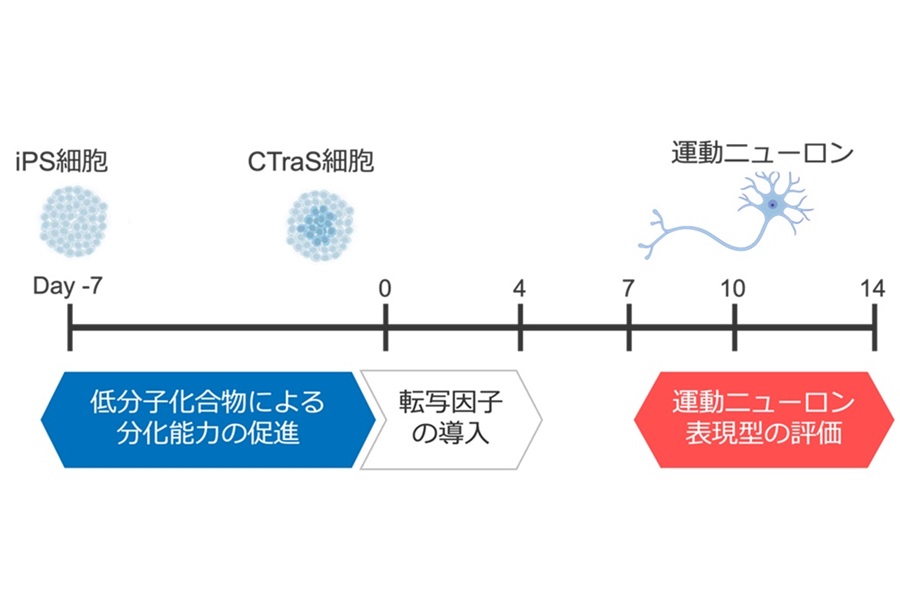
近年、iPS細胞を用いた研究はALSの疾患理解や薬剤スクリーニングにおいて大きな可能性を示しています。しかし、これまでの疾患研究、薬剤スクリーニングの多くは、主に、家族性ALS(注4)に特徴的な特定の遺伝的異常を持つ細胞を用いた研究に限られており、ALS患者の9割を占め、疾患の多様性に富む孤発性ALS(注5)へのアプローチはあまりされていないという問題がありました。これは、従来の手法では運動ニューロンの誘導効率が低く、誘導と表現型評価に多大な時間と労力を要するために、多様な背景を持つ孤発性ALSを対象とした大規模な実験が困難であったことに起因します。そこで、共同研究グループは、iPS細胞から脊髄型の下位運動ニューロンを迅速かつ高効率で誘導する方法を開発し、さらにAI画像解析技術を用いた疾患表現型の簡便かつ再現性の高い評価法を開発しました(図1)。
2. 本研究のポイント
- 新しい高効率な下位運動ニューロン誘導法: ヒトiPS細胞から下位運動ニューロンを高効率(約80%)で誘導する新しいプロトコルを開発しました。従来法と比較して短期間で効率的に分化を達成し、ALS病態の解明や薬剤スクリーニングへの応用が期待されます。
- ALS病態の再現: 遺伝性ALS患者由来のiPS細胞から誘導した下位運動ニューロンにおいて、ALS特有の病態(TDP-43およびFUSタンパクの異常な凝集)を再現しました。このことから、本研究の手法がALS研究に適したモデルであることが示されました。
- 機能的な神経活動の確認: 誘導した下位運動ニューロンで成熟したニューロンと同様の発火活動やネットワーク活動をMEA(マルチ電極アレイ)システムを用いて確認することができました。
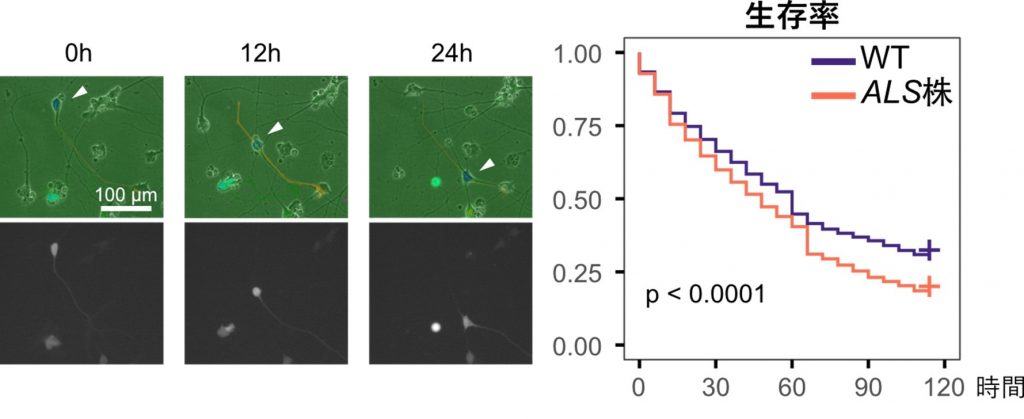
- ALS細胞の脆弱性評価: 経時的なライブイメージングとシングルセル追跡技術、およびAI画像解析技術を活用しALS患者由来下位運動ニューロンが健康な細胞に比べて生存率が低い傾向にあることが示されました(図2)。この傾向は撮像に基づいた従来の単純な細胞体カウントでは明確には示すことができませんでした。この技術は、ALS患者由来細胞ごとの細胞脆弱性を評価するための有望なツールです。
3. 今後の展開
この下位運動ニューロン誘導法は、ALS患者由来のiPS細胞を用いた迅速かつ効率的な薬剤スクリーニングのための基盤となります。これにより、ALS特有の症状の早期発見や、患者ごとの異なる病態に対応した個別化医療の実現に向けた研究が進むと考えられます。また、病態の異なるALS患者由来のiPS細胞株を用いた大規模な研究や、シングルセル追跡技術とオミクス解析を組み合わせた単一細胞レベルでの詳細な研究に応用されることで、複雑な病態をもつALSの疾患理解が進むことが期待されます。さらに、本手法は、他の神経変性疾患のモデル構築や創薬研究にも応用可能であり、神経疾患全般の治療法開発への貢献が期待できます。
4. 特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム事業 神経疾患特異的iPS細胞を活用した病態解明と新規治療法の創出を目指した研究、再生・細胞医療・遺伝子治療実現加速化プログラム 筋萎縮性側索硬化症における病態回避機構の解明と治療に資する層別化技術開発、再生・細胞医療・遺伝子治療実現加速化プログラム 革新的RNA編集技術を用いた筋萎縮性側索硬化症の遺伝子治療開発、脳とこころの研究推進プログラム 孤発性筋萎縮性側索硬化症の双方向トランスレーショナル研究による病態介入標的の同定と核酸医薬の開発研究、ゲノム創薬基盤推進研究事業 RNA標的医薬創出に資する、疾患RNA分子完全長一次構造に関するデータ基盤の構築、難治性疾患実用化研究事業 患者レジストリを活用した沖縄型神経原性筋萎縮症のエビデンス創出研究、JSPS科研費JP20H00485, JP21H05278, JP22K07500, JP22K15736、宮田幸比古記念ALS研究助成基金、日本ALS協会小出良夫基金、公益財団法人第一三共生命科学研究振興財団、UBE学術振興財団、加藤記念難病研究助成基金、の研究助成を受けて実施されました。
<参考文献>
Fujimori K, Matsumoto T, Kisa F, Hattori N, Okano H, Akamatsu W. Escape from Pluripotency via Inhibition of TGF-β/BMP and Activation of Wnt Signaling Accelerates Differentiation and Aging in hPSC Progeny Cells. Stem Cell Reports. 2017 Nov;9(5):1675-1691. PMID: 29107593; PMCID: PMC5831048.
Fujimori K, et al. Modeling sporadic ALS in iPSC-derived motor neurons identifies a potential therapeutic agent. Nat Med. 2018 Oct;24(10):1579-1589. PMID: 30127392.
Morimoto S, et al. Phase 1/2a clinical trial in ALS with ropinirole, a drug candidate identified by iPSC drug discovery. Cell Stem Cell. 2023 Jun 1;30(6):766-780.e9. PMID: 37267913.
<用語解説>
(注1) 筋萎縮性側索硬化症(amyotrophic lateral sclerosis; ALS):運動ニューロンの変性・脱落を特徴とする神経変性疾患で、全身の筋力低下を主症状とする。呼吸筋を含めた筋力低下を引き起こすため、未治療では3-5年で呼吸障害により死亡する。
(注2) 人工多能性幹細胞(iPS細胞;iPSC):体を構成する細胞(体細胞)に、特定の遺伝子を導入することによって作出される人工的な細胞。ほぼ全ての細胞種への分化能(多能性)と、無限増殖能(幹細胞性)を保持している。
(注3) 下位運動ニューロン(Lower Motor Neuron ; LMN):ヒトが運動する際、脳からの司令が上位運動ニューロン、次いで脊髄(下位)運動ニューロンに伝達され、筋肉まで伝わる。脊髄(下位)運動ニューロンは、脊髄に位置している。
(注4) 家族性ALS:家族歴を持つ発症例。代表的にはSOD-1、FUS、TDP-43といったタンパク質をコードする遺伝子への変異が原因として特定されている。
(注5) 孤発性ALS:ALS患者の90%は孤発性、すなわち家族歴を持たずに発症し、孤発性ALSと呼ばれている。
(注6) CTraS細胞:未分化状態を維持するのに関与するシグナルを調節する小分子で処理することで、分化能が促進された状態の細胞(Fujimori et al., 2017)。
アイキャッチ画像
雑誌名等
雑誌名:Stem Cell Reports
題 名:Swift Induction of Human Spinal Lower Motor Neurons and Robust ALS Cell Screening via Single-Cell Imaging(ヒト脊髄下位運動ニューロンの迅速な誘導とシングルセルイメージングによるALS細胞の頑強な評価法)
著者名:Selena Setsu, Satoru Morimoto, M.D., Ph.D.†, Shiho Nakamura, Fumiko Ozawa, Kagistia Hana Utami, Ayumi Nishiyama M.D., Ph.D., Naoki Suzuki M.D., Ph.D., Masashi Aoki M.D., Ph.D., Yukio Takeshita, M.D., Ph.D., Yukihide Tomari, Ph.D., Hideyuki Okano, M.D., Ph.D.†
†Co-corresponding author
DOI: 10.1016/j.stemcr.2024.11.007
URL: https://doi.org/10.1016/j.stemcr.2024.11.007
問い合わせ先
・研究内容についてのお問い合わせ先
慶應義塾大学 再生医療リサーチセンター センター長 岡野 栄之(おかの ひでゆき)
・本リリースの配信元
慶應義塾広報室
東京大学定量生命科学研究所総務チーム