2024-12-23 理化学研究所
理化学研究所(理研)生命機能科学研究センター 細胞外環境研究チームのウルゲジン・ドゥーリゲンゴア 研修生、藤原 裕展 チームリーダーらの研究チームは、細胞の足場として働く基底膜[1]の動態を可視化する新たな手法を開発し、基底膜が従来考えられていたよりもはるかにダイナミックに振る舞うことで、臓器の形づくりを積極的に制御していることを明らかにしました。
本研究成果は、形態形成における基底膜の動的な役割を示す重要な成果で、器官の発生や再生のメカニズムの解明に広く貢献すると期待されます。
細胞接着の足場となる基底膜は、巨大なタンパク質同士の平面的なネットワークにより形成される細胞外の非細胞性成分であり、従来は建物の床のような静的な細胞の支持構造と見なされてきました。
今回、研究チームは、全身の基底膜が光る遺伝子組換えマウスの作製に成功し、それを用いた基底膜のライブイメージング[2]技術を新たに開発しました。この技術を活用し、皮膚の毛包[3]の形態形成における基底膜の動態と機能を解析した結果、基底膜は、動き、伸びる性質を持つことが明らかとなりました。さらに、その動的特性が毛包の領域ごとに異なることで、基底膜を足場とする上皮前駆細胞[4]の移動や分裂様式、さらには上皮組織全体の形態が制御されていることが分かりました。
本研究は、科学雑誌『Journal of Cell Biology』オンライン版(12月10日付)に掲載されました。
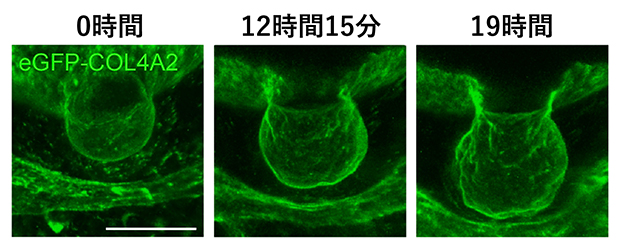
毛包の形態形成においてダイナミックに振る舞う基底膜(緑)
背景
基底膜は、上皮細胞、内皮細胞、筋細胞など、多くの細胞を包む厚さ100ナノメートル(nm、1nmは10億分の1メートル)程度のシート状の細胞外マトリックス[5]です。その基本構造は、基底膜と細胞との接着を担うラミニン[1]と、力学的基盤を形成するコラーゲンⅣ[1]の平面的なネットワークから成ります。基底膜は、これらコアタンパク質に加え、何百種類ものタンパク質から成る超分子複合体であり、その成分の組み合わせにより細胞に最適な環境を提供しています注1)。さらに、基底膜は細胞接着の足場として機能するだけでなく、力学的・生化学的なシグナルを伝達することで、細胞の増殖、分化、移動、生存、極性といった基本機能を統御しています。そのため、基底膜の機能破綻は、発生異常やさまざまな疾患の原因となります。
一方で、基底膜は長らく、建物の床のような静的な細胞の支持構造と見なされてきました。この認識には、基底膜のライブイメージング技術が十分確立されておらず、その動態が不明だったことが影響しています。特に、基底膜分子は巨大で、複雑な分子間相互作用を形成しているため、機能を損なわずに修飾や操作を行うことが難しく、基底膜のライブイメージングの進展を妨げてきました。
近年、線虫やショウジョウバエなどの無脊椎動物では基底膜のライブイメージング技術が進展し、その動態が器官発生の制御に重要であることが示唆されています。しかし、哺乳類などの脊椎動物では、生きた組織内で基底膜と細胞の動態を同時にライブイメージングする技術は十分確立されていませんでした。そこで、研究チームは、基底膜を可視化できるマウスを開発することで、基底膜の時空間動態が哺乳類の組織構築にどのように関与しているのかを解明することを目指しました。
注1)2021年5月10日プレスリリース「異種組織を一体化する細胞外環境の特性を解明」
研究手法と成果
研究チームはまず、基底膜を蛍光タンパク質(eGFP)で光らせることができる遺伝子組換えマウス「eGFP-Col4a2マウス[6]」を作製しました。このマウスは全身の基底膜がeGFPで標識されており、ホモ接合体[7]でも正常に発生しました(図1)。なお、最近、同様の試みとしてラミニンやコラーゲンⅣα1(COL4A1)に蛍光タンパク質を融合させた遺伝子組換えマウスが報告されましたが、いずれもホモ接合体で胎生致死[8]でした注2、3)。これらのマウスとeGFP-Col4a2マウスのホモ表現型の違いの原因は不明ですが、蛍光タンパク質の種類や挿入位置が基底膜の機能に影響を与えている可能性があります。
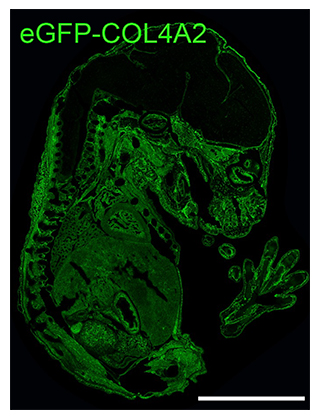
図1 全身の基底膜が可視化できるeGFP-Col4a2マウス
胎齢(胎仔が母体の中で過ごした時間)15.5日のeGFP-Col4a2マウスのeGFP免疫蛍光染色画像。ほぼすべての組織の基底膜がeGFP(緑)で標識されている。スケールバーは3mm。
次に、eGFP-Col4a2マウスの胎仔(たいじ)皮膚組織を用いて、発生中の毛包の基底膜を生体外で3次元ライブイメージングする方法を確立しました(図2A)。毛包は表皮と真皮にまたがって存在し、基底膜がそれらの組織をつなぎ合わせています。そこで、毛包の発生過程で基底膜がどのように拡張するかを調べたところ、毛包の先端部(図2B)で顕著な基底膜の拡張が見られ、拡張率は毛包の上部に向かって徐々に減少し、毛包の柄部上部では拡張がほとんど見られず、むしろ収縮傾向にありました(図2B)。つまり、毛包の基底膜は風船のように一様に広がるのではなく、拡張率に空間的な勾配がありました。
基底膜拡張率の空間勾配を生み出す要因を調べるため、eGFP-COL4A2の光退色後蛍光回復(FRAP)法[9]とパルスチェース法[10]を組み合わせて、基底膜への新しいコラーゲンⅣタンパク質の組み込みを解析しました。FRAP解析では、毛包先端部でのCOL4A2の蛍光が退色後3時間半で50%回復し、従来「数日から数カ月」とされてきたコラーゲン分子のターンオーバー[11](入れ替わり)が、発生中の毛包では非常に速いことが示唆されました(図2C)。パルスチェース解析では、光を当てると緑から赤へ蛍光色が変化する光変換蛍光タンパク質でCOL4A2を標識したマウスを開発し、局所的なレーザー照射で赤と緑のモザイク状になった基底膜の色の変化を追跡しました。赤に色変換された毛包先端部では、緑の蛍光が増加すると同時に赤い蛍光が消失したことから、分子のターンオーバーを伴う組み込みが起きていることが判明しました。一方、毛包上部ではターンオーバーが遅く、最上部では分子の入れ替わりがほとんど起こっていませんでした。このように、COL4A2のターンオーバー率の空間勾配が、基底膜の拡張率の空間勾配とよく一致することが明らかになりました。
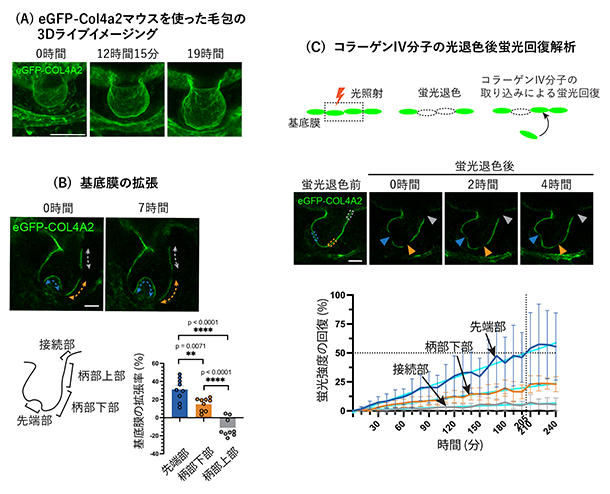
図2 毛包の形態形成過程における基底膜の動態
A.eGFP-Col4a2マウスの胎仔毛包の3Dライブイメージング。皮膚組織を横から見た図。スケールバーは50マイクロメートル(μm、1μmは100万分の1メートル)。
B.毛包基底膜に見られる拡張率の空間的勾配。柄部に比べて先端部で顕著な基底膜の拡張が見られた。
C.eGFP-COL4A2の光退色後蛍光回復解析。局所的な光照射により、その領域のeGFP-COL4A2のみを退色させることができる。未照射のeGFP-COL4A2が組み込まれない限り蛍光は復活しない。蛍光退色後の経過観察では、先端部で速い回復が観察された一方、接続部では回復がほとんど見られなかった。
BとC:スケールバーは20μm。
基底膜は細胞と接着し物理的な拘束をつくり出すことで、細胞の挙動や組織形状に影響を与えます。そこで、拡張する毛包基底膜上での上皮前駆細胞の挙動を調べました。その結果、拡張せず安定している基底膜上では細胞はほとんど移動しませんでしたが、毛包先端に向かって拡張する基底膜上ではその方向に合わせて細胞が協調的に移動することが明らかとなりました(図3)。この現象は、ムービングウオーク(動く歩道)上で人がその流れに従って移動する様子に似ています。このことから、発生中の毛包では、細胞が静的な基底膜上を能動的に這(は)い回っているわけではなく、基底膜の動態が細胞移動の方向性や速度を決定する重要な要因となっていることが示唆されました。
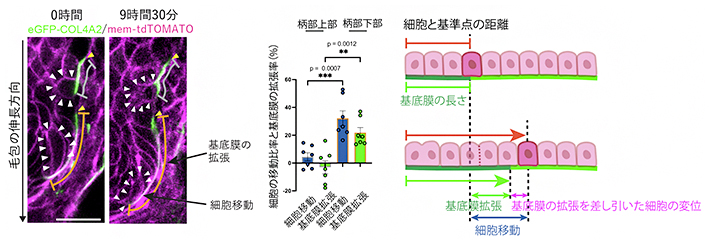
図3 細胞と基底膜の協調的な動態
左)細胞膜をマゼンタで、基底膜を緑で標識した同時ライブイメージング。灰色の線は柄部上部、オレンジの線は柄部下部の範囲を指し、それぞれの基底膜に接着する細胞を白三角で示す。黄色三角は、基底膜の伸長と細胞の移動を計測するための基準点。スケールバーは20μm。
中)毛包柄部上部と柄部下部における細胞の移動比率とその直下の基底膜の拡張率の計測結果。基底膜の拡張率が大きい柄部下部では、細胞の移動比率も大きい。
右)基底膜の拡張に伴って上皮前駆細胞が先端方向に移動する様子の模式図。細胞の移動には、基底膜の拡張が大きく寄与する。
このような細胞外マトリックスのリモデリング(再構築)において重要な役割を果たすのが、細胞外マトリックス成分の分解です。基底膜成分の分解と新たな分子の挿入により、基底膜はその構造を保ちながら拡張することが可能になると考えられます。そこで研究チームは、細胞外マトリックスの分解を担う酵素であるマトリックスメタロプロテアーゼ(MMP)[12]の阻害剤を加えました。その結果、コラーゲンⅣのターンオーバーが大きく遅延し(図4A)、基底膜の拡張も顕著に減少しました(図4B)。さらに、分裂した上皮前駆細胞の娘細胞の配置角度が基底膜に対して垂直に変わり(図4C)、陥入する上皮組織の異方的な伸長が停止し、毛包の特徴的な形態が発達せず単純な幅広の毛包が形成されました(図4D)。これらの結果から、基底膜の分子レベルでのターンオーバー制御が、基底膜の拡張を調節する重要な仕組みであること、さらに、基底膜の方向性を持った拡張が細胞の移動や娘細胞の配置を調節することで、上皮組織の指向性を持った成長を制御していることが明らかとなりました。
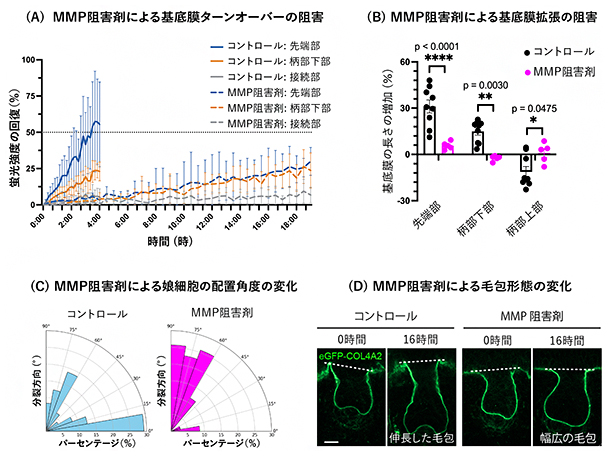
図4 基底膜の拡張と毛包の形態形成に必須なマトリックスメタロプロテアーゼ(MMP)活性
A.MMP阻害剤存在下でのeGFP-COL4A2のFRAP解析。MMP阻害剤処理により、コントロール(実線グラフ)に比べて蛍光回復が大きく遅延した(破線グラフ)。
B.MMP阻害剤処理により、先端部や柄部下部の基底膜の拡張が顕著に阻害された。
C.MMP阻害剤処理により、上皮前駆細胞の娘細胞の配置角度が水平から垂直へと変わった。
D.MMP阻害剤処理により、毛包の伸長が停止し、毛包特有の構造が発達せず幅広い上皮構造が形成された。eGFP-COL4A2(緑)により上皮直下の基底膜が可視化されている。スケールバーは20μm。
注2)Morgner et al., Developmental Cell 10;58(7):535-549 (2023)
注3)Jones et al., Journal of Cell Biology 223 (2): e202309074. (2024)
今後の期待
本研究の成果は、器官の発生や再生のメカニズムの解明に広く貢献すると期待されます。特に、活発に動き拡張する基底膜が、細胞の移動や分裂様式を制御するという発見は、初期発生や他の器官形成に関するこれまでの理解に新たな視点を加えるだけでなく、組織再生やがんなどの疾患における基底膜の役割を解明する重要な手掛かりにもなります。
さらに、本研究で開発された基底膜可視化技術は、ヒトを含む他の哺乳類にも応用可能なため、ヒトオルガノイド(生体外で作製するミニチュア臓器)などの形成過程における基底膜の動的な役割を解明するための強力なツールとなります。これらの知見や技術は、多細胞システムの作動原理を理解するための基盤を提供するとともに、生物学や医学の幅広い分野において、新たな研究の進展に寄与することが期待されます。
補足説明
1.基底膜、ラミニン、コラーゲンⅣ
基底膜は、細胞外マトリックス([5]参照)の一つ。100ナノメートル程度の薄いシート状で、上皮細胞、内皮細胞、筋肉細胞、神経細胞、脂肪細胞などの足場と成る。基底膜の主成分はラミニンとコラーゲンⅣ。ラミニンは細胞表面にある接着分子インテグリンを介して細胞の接着を誘導したり、細胞にシグナルを伝達したりする。コラーゲンⅣは基底膜の力学的基盤を提供する。
2.ライブイメージング
生体内や培養環境下で分子、細胞、そして組織の動態をリアルタイムで観察する手法。生きた細胞や組織の構造、動き、相互作用などをモニタリングすることが可能。
3.毛包
哺乳類の皮膚に存在する毛をつくる小器官であり、触覚を感知する感覚器でもある。毛包は表皮と真皮にまたがって存在し、基底膜がそれらの組織をつなぎ合わせている。周期的に毛と毛包を再生するため、幹細胞、器官再生、細胞分化研究のモデルとして良く用いられる。
4.上皮前駆細胞
発生期の上皮組織に存在する増殖性の未分化な上皮細胞。さまざまな上皮細胞を生み出すことができる。
5.細胞外マトリックス
細胞外に存在する非細胞性の構造で、シート状の基底膜と立体的な間質性マトリックスに大別される。さまざまなタンパク質が会合した巨大複合体で、それらをコードする遺伝子は約300種類あるといわれている。細胞を支えるだけでなく、細胞間のコミュニケーションや組織の構造形成にも重要な役割を果たす。
6.eGFP-Col4a2マウス
全ての組織の基底膜に含まれるコアタンパク質であるコラーゲンⅣα2(COL4A2)の末端(アミノ端側)付近に、緑色蛍光タンパク質eGFPが付加されるように遺伝子操作を施したノックインマウス。ノックインマウスとは、特定の遺伝子座に外来の遺伝子や修飾を導入することにより、特定の機能を持つ遺伝子を正確に発現させたり、遺伝子の変異を再現したりするように設計された遺伝子改変マウスモデルのこと。
7.ホモ接合体
生物のある遺伝子座において、両親から受け継いだ遺伝子(アレル)が同一である状態を指す。
8.胎生致死
胚発生の途中で生存が不可能になる現象。主に遺伝子の異常が原因で胎児・胎仔が成長を続けることができず、出生に至らない状態を指す。
9.光退色後蛍光回復(FRAP)法
蛍光分子が存在する領域に強い光を照射してその部分を退色させ、その後の蛍光の回復を観察する方法。蛍光物質の拡散定数や特定部位への取り込み速度を定量的に評価することができる。FRAPは Fluorescence Recovery After Photobleachingの略。
10.パルスチェース法
ある生体成分を標識し(パルス)、その後、無標識の同成分にさらすことで(チェース)、成分の移動やターンオーバーを追跡する実験方法。
11.ターンオーバー
生体内で、古い分子や細胞が新しいものと置き換えられる動的なプロセスを指す。
12.マトリックスメタロプロテアーゼ(MMP)
細胞外マトリックスの分解に関与する酵素群で、金属イオン(主に亜鉛)を補因子として持つタンパク質分解酵素。これらは、組織のリモデリング(再構築)や修復、発生、病態において重要な役割を果たす。
研究チーム
理化学研究所 生命機能科学研究センター
細胞外環境研究チーム
研修生 ウルゲジン・ドゥーリゲンゴア(Duligengaowa Wuergezhen)
(大阪大学 大学院医学系研究科 大学院生)
研修生(研究当時)エレノア・ギンドロス(Eleonore Gindroz)
上級研究員(研究当時)森田 梨津子(モリタ・リツコ)
(現 細胞外環境研究チーム 客員研究員、大阪大学 大学院生命機能研究科 准教授)
研修生(研究当時)橋本 恵(ハシモト・ケイ)
(現 お茶の水大学 ヒューマンライフサイエンス研究所 特任講師)
チームリーダー 藤原 裕展(フジワラ・ヒロノブ)
生体モデル開発チーム
技師 阿部 高也(アベ・タカヤ)
チームリーダー 清成 寛(キヨナリ・ヒロシ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、BDR Stage Transition Project)で実施し、科学技術振興機構(JST)戦略的創造研究推進事業CREST「多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出(研究総括:松田道行)」領域の研究課題「体表多様性を創発する上皮―間充織相互作用の動的制御機構の解明(研究代表者:藤原裕展)」、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(A)「細胞外情報を統御するマルチモーダルECM」計画研究「基底膜ダイナミクスが駆動する器官形成の制御機構(研究代表者:藤原裕展)、同計画研究「領域研究「細胞外情報を統御するマルチモーダルECM」の統括と運営(研究代表者:藤原裕展)」、同基盤研究(B)「位置情報システムによる皮膚の領域特異性の創出・維持・破綻メカニズムの解明(研究代表者:藤原裕展)」、同挑戦的研究(萌芽)「細胞外マトリックスのダイナミクスの可視化(研究代表者:藤原裕展)」「癌微小環境に残された正体不明の血管被覆マトリックスへのアプローチ(研究代表者:木戸屋浩康)」、理研国際プログラムアソシエイト(ウルゲジン・ドゥーリゲンゴア)、大阪大学生体統御ネットワーク医学教育プログラム(ウルゲジン・ドゥーリゲンゴア)、お茶の水大学博士課程教育リーディングプログラム(橋本恵)による助成を受けて行われました。
原論文情報
Duligengaowa Wuergezhen, Eleonore Gindroz, Ritsuko Morita, Kei Hashimoto, Takaya Abe, Hiroshi Kiyonari, Hironobu Fujiwara, “An eGFP-Col4a2 mouse model reveals basement membrane dynamics underlying hair follicle morphogenesis”, Journal of Cell Biology, 10.1083/jcb.202404003
発表者
理化学研究所
生命機能科学研究センター 細胞外環境研究チーム
チームリーダー 藤原 裕展(フジワラ・ヒロノブ)
研修生 ウルゲジン・ドゥーリゲンゴア(Duligengaowa Wuergezhen)
報道担当
理化学研究所 広報室 報道担当