発生過程における頑健性を支えるエピジェネティクス因子
2018-10-11 理化学研究所
理化学研究所(理研)生命医科学研究センター免疫器官形成研究チームの古関明彦チームリーダーと藥師寺(上夏井)那由他客員研究員らの研究チーム※は、マウスの四肢の原基である肢芽形成において、エピジェネティクス[1]因子の「ポリコム複合体[2]」と肢芽の発生シグナルが共通の標的遺伝子を制御するメカニズムを発見しました。
本研究成果は、発生シグナルがポリコム複合体と協働することで、一つの受精卵からどのように胚を形作っていくのか、その仕組みの一端を明らかにするものです。今後、ES細胞[3]やiPS細胞[3]から組織や器官を作り出す過程での効果的な方法の開発や再生医療の発展に貢献すると期待できます。
今回、研究チームは、肢芽の基部化シグナル[4]とポリコム複合体が共通の標的遺伝子「Meis2」の発現制御領域で相互に拮抗することで、Meis2遺伝子発現のオン・オフをそれぞれ制御していることを明らかにしました。さらに、数理モデル[5]に基づくシミュレーションを組み合わせた解析から、Meis2遺伝子の発現を活性化させるために必要な基部化シグナルの閾値(いきち)[6]をポリコム複合体が調節していることを見いだしました。これまでにポリコム複合体は遺伝子の発現を抑制すると同時に、活性化する役割を担っていることが分かっていましたが、本研究はポリコム複合体が新たに閾値調節機構として働くことを示しています。
本研究は、英国の科学雑誌『Development』(2018年10月15日号)の掲載に先立ち、オンライン版(9月6日付け)に掲載されました。
※研究チーム
理化学研究所
生命医科学研究センター 免疫器官形成研究チーム
チームリーダー 古関 明彦(こせき はるひこ)
客員研究員 藥師寺(上夏井) 那由他 (やくしじ(かみなつい) なゆた)
生命機能科学研究センター 発生幾何研究ユニット
ユニットリーダー 森下 喜弘(もりした よしひろ)
※研究支援
本研究は、日本医療研究開発機構 革新的先端研究開発支援事業ユニットタイプ「エピゲノム研究に基づく診断・治療へ向けた新技術の創出」研究領域(研究総括:山本雅之(東北大学大学院医学系研究科教授)における研究課題「エピジェネティクスによるエンハンサー動態制御メカニズムの解明と細胞機能制御への応用」(研究代表者:古関明彦)による支援を受けて行われました。
背景
一つの受精卵から胚が形作られていく過程で、エピジェネティクス因子の「ポリコム複合体」は遺伝子の発現を主に抑制するように働いており、未分化な細胞が次第に分化していく過程に深く関わっていることが知られています。2016年に古関チームリーダーらは、このポリコム複合体がさまざまな発生シグナルと協調して、四肢の領域特定化と形態形成に関与していることを報告しました注1)。しかし、ポリコム複合体と発生シグナルがどのように共通の標的遺伝子群の発現を制御しているのか、その詳細な分子メカニズムはまだ分かっていませんでした。
そこで研究チームは、肢芽の基部化シグナルであるレチノイン酸シグナルによって活性化され、反対にポリコム複合体によって抑制されることが分かっている「Meis2遺伝子」に着目し、この制御メカニズムを明らかにすることを試みました。
注1)2016年1月19日プレスリリース「四肢形成における分子メカニズムの一端を解明」
研究手法と成果
Meis2遺伝子は、肢芽の先端部側ではポリコム複合体「PRC1」の働きによって抑制されることで、基部側でのみ発現します。このPRC1の構成因子であるRing1A遺伝子とRing1B遺伝子を欠損したマウスでは、Meis2遺伝子の発現が肢芽の先端部まで拡大します。野生型のマウス胚が基部化シグナルであるレチノイン酸シグナルを過剰に受け取ったときにも同じ現象が見られ、Meis2遺伝子の発現領域は肢芽全体に広がります(図1A)。研究チームはこのことに着目し、レチノイン酸処理した野生型のマウス肢芽において、ポリコム複合体の働きに影響が生じているかを調べました。
Meis2遺伝子の発現を制御するプロモーター領域[7]を調べた結果、Meis2遺伝子の発現が見られない正常な肢芽先端部では、PRC1を構成するRING1B(ポリコム複合体の構成因子の一つ)と、PRC2の働きによるH3K27me3(ヒストンH3の27番目リジンのトリメチル化修飾)の蓄積が見られました。これに対して、レチノイン酸処理した肢芽先端部では、RING1BやH3K27me3の蓄積が著しく減少していることが分かりました(図1B)。通常、野生型の肢芽基部領域ではレチノイン酸濃度が高くなっており、Meis2遺伝子のプロモーター領域にはレチノイン酸シグナルの受容体の結合が見られるのに対して、RING1BやH3K27me3の蓄積はほとんど見られません。このことから、レチノイン酸処理した肢芽先端部ではレチノイン酸シグナル受容体の働きが強くなったことで、RING1BやH3K27me3の蓄積が阻害されている可能性が考えられます。また、これは、レチノイン酸シグナル受容体とポリコム複合体がMeis2遺伝子のプロモーター領域で競合することで、遺伝子の発現を制御している可能性も示しています。
次に、レチノイン酸処理によって肢芽先端部で誘導されたMeis2遺伝子の発現が、ポリコム複合体の量に依存して変化するのかどうかを調べました。低濃度のレチノイン酸を投与すると、Ring1B遺伝子を欠損していない正常な胚ではMeis2遺伝子は肢芽先端部でほとんど発現しないが、Ring1B遺伝子を半分欠損したマウス(Ring1Bヘテロ変異胚;肢の骨の形態に異常はない)では、Meis2遺伝子の肢芽先端部での発現誘導が起こることが分かりました(図2)。さらに、Ring1B遺伝子を全て欠損したマウス(Ring1Bホモ変異胚;肢の軛脚(やっきゃく)部[橈骨(とうこつ)・尺骨]が短くなる)では、レチノイン酸投与によってMeis2遺伝子が先端部でより強く発現することが分かりました(図2)。これは、ポリコム複合体によってMeis2遺伝子の活性化に必要なレチノイン酸濃度への感受性が制御されていることを示しています。
さらに、これまでに分かっている肢芽の基部先端部軸形成に関わる遺伝子ネットワークに、ポリコム複合体がレチノイン酸シグナル応答性の閾値(いきち)を調節しているという新しい機能を取り込み、肢芽における各遺伝子の発現を数理モデルに基づきシミュレーションしました。その結果、ポリコム複合体の変異体やレチノイン酸処理した肢芽で観察された遺伝子の発現パターンは、シミュレーション上でも再現されることが確認できました。
ポリコム複合体PRC1には四つのサブタイプがあり、PCGF1~6のタンパク質のどれを含むかによって区別しますが、共通のサブユニットとしてタンパク質RING1A/Bを持っています。最後に、このレチノイン酸シグナルへの閾値調整にはどのタイプのポリコム複合体PRC1が関わっているのかを調べました。その結果、PCGF3またはPCGF5を含むポリコム複合体(PCGF3/5-PRC1)の変異マウスの肢芽においても、先端部におけるMeis2遺伝子の発現が見られ、かつ肢芽先端部でのH3K27me3の蓄積が減少していることが分かりました(図3)。これらの結果は、PCGF3/5-PRC1が発生シグナルの閾値調整に関与していることを示しています。
今後の期待
本研究から、マウスの四肢形成においてポリコム複合体は標的遺伝子の発現を抑制するように作用するだけでなく、発生シグナルの閾値調節を行うことで特定の遺伝子の発現を制御していることが分かりました。
胚が発生する過程では、環境状態の変化といった外的要因の影響を受けることで発生シグナルの強さは変化しますが、深刻なレベルでない限り最終的には決められた形が作られます。この頑健な胚発生システムは、本研究から明らかになったポリコム複合体による発生シグナルの閾値調節機能によって支えられていると考えられます。
今後、ES細胞やiPS細胞から組織、器官を作り出す過程で、発生シグナルそのものを調節するだけでなく、ポリコム複合体も正常に機能できるように制御していくことで、より効果的な方法の開発につながると期待できます。
原論文情報
Nayuta Yakushiji-Kaminatsui, Takashi Kondo, Ken-ichi Hironaka, Jafar Sharif, Takaho A. Endo, Manabu Nakayama, Osamu Masui, Yoko Koseki, Kaori Kondo, Osamu Ohara, Miguel Vidal, Yoshihiro Morishita and Haruhiko Koseki, “Variant PRC1 competes with retinoic acid-related signals to repress Meis2 in the mouse distal forelimb bud”, Development, 10.1242/dev.166348.
発表者
理化学研究所
生命医科学研究センター 免疫器官形成研究チーム
チームリーダー 古関 明彦(こせき はるひこ)
客員研究員 藥師寺(上夏井) 那由他(やくしじ(かみなつい) なゆた)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- エピジェネティクス
- DNA配列の変化によらず、遺伝子の発現を制御するメカニズムの総称。狭義ではDNAのメチル化やヒストン修飾による制御を指すことが多い。
-
- ポリコム複合体
- ショウジョウバエで見いだされた一群のクロマチン因子で、ヒトに至るまで保存されている。体の軸に沿った各領域の特異的構造を形成する、ホメオティック遺伝子群の調節因子として発見された。のちにDNAが巻き付いているヒストンタンパク質のメチル化、ユビキチン化の活性を持つことが分かり、遺伝子の発現を主に抑制することが知られている。機能的な違いからPRC1とPRC2に大別される。PRC1はヒストンH2Aの119番目のリジン残基をユビキチン化して、近傍遺伝子の転写を抑制すると考えられている。PRC2はヒストンH3の27番目のリジン残基をメチル化して、近傍遺伝子の転写を抑制すると考えられている。
-
- ES細胞、iPS細胞
- ES細胞(胚性幹細胞)は、受精卵が分化してできた発生初期の胚の細胞から作られ、全ての細胞に分化する能力を持つ。iPS細胞(人工多能性幹細胞)は、線維芽細胞などの分化細胞に、3~4個の転写因子を導入するなどして作られた多分化能を持つ細胞。ES細胞のように、あらゆる細胞に分化する能力がある。ES細胞が抱える倫理的問題を解決できると考えられており、また患者自身の細胞から作ることができるので、iPS細胞から分化した細胞を患者に移植しても拒絶反応が起きにくいと考えられている。
-
- 基部化シグナル
- 肢芽の基部側の領域特定化に重要なシグナル。体幹部から分泌され、肢芽の形成に不可欠のレチノイン酸シグナルが代表的なものとして考えられている。
-
- 数理モデル
- 数学的手法を用いて現象を記述またはシミュレートするモデルのこと。
-
- 閾値(いきち)
- 特定の因子が生体物質を活性化させるために必要な最小限の値。本研究では、Meis2遺伝子を活性化させるために必要なレチノイン酸シグナルの最小濃度のことを指す。
-
- プロモーター領域
- ゲノムDNA上でRNAに書き写される領域の近くにあり、遺伝子を発現させる機能を持つ部分。
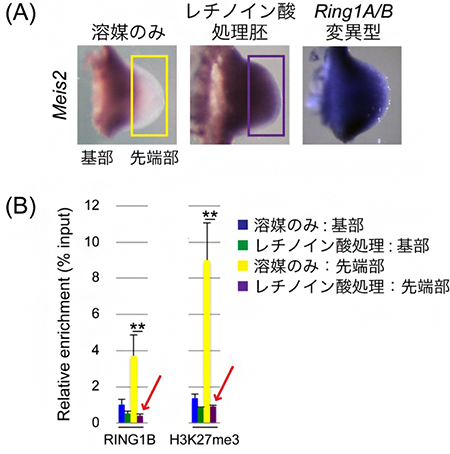
図1 レチノイン酸処理によるMeis2遺伝子の肢芽先端部での発現誘導とポリコム複合体の変化
(A) 左から、溶媒のみで処理した野生型マウス胚(コントロール胚)、レチノイン酸で処理した野生型マウス胚、Ring1A/B変異型マウス胚におけるMeis2遺伝子の発現パターン。青紫色で染まった部分が遺伝子の発現領域を示している。通常、Meis2遺伝子は肢芽の基部側でのみ発現しているが(黄色枠)、レチノイン酸処理もしくはRing1A/B変異型では肢芽の先端部にまで発現範囲が拡大する。
(B) Meis2プロモーター領域におけるRING1B(ポリコム複合体PRC1の構成因子)と、H3K27me3(PRC2の働きによるヒストンH3の27番目リジンのトリメチル化修飾)の蓄積率。溶媒のみで処理した肢芽先端部(黄色)ではRING1BとH3K27me3が多く蓄積しているのに対し、レチノイン酸処理した肢芽先端部(紫色)ではこれらの蓄積は著しく失われていることが分かる(赤矢印)。
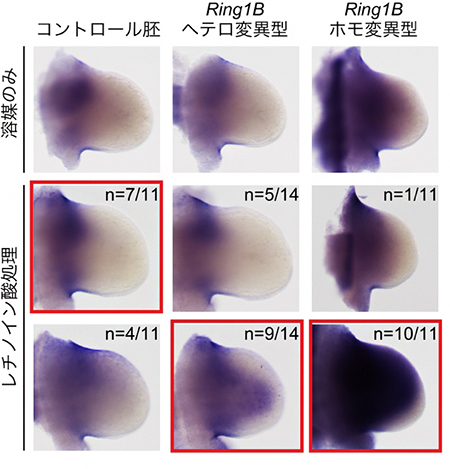
図2 Meis2遺伝子活性化におけるポリコム複合体依存的なレチノイン酸への感受性
低濃度のレチノイン酸で処理すると、ポリコム複合体の構成因子Ring1B遺伝子の正常型(コントロール胚)では、異所的なMeis2遺伝子の発現誘導は起こらない(左列)。しかし、Ring1Bヘテロ変異型とRing1Bホモ変異型では、Meis2遺伝子の発現が肢芽先端部にまで広がっている(中列と右列)。
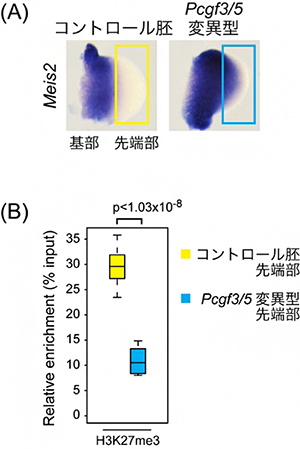
図3 Pcgf3/5変異型におけるMeis2遺伝子の肢芽先端部での発現誘導とH3K27me3の変化
(A) ポリコム複合体PRC1の構成因子であるPcgf3とPcgf5の両方の遺伝子を欠損した変異型においても、Meis2遺伝子の肢芽先端部において異所的な発現が見られた。
(B) Meis2遺伝子のプロモーター領域におけるH3K27me3の蓄積率。コントロール胚の肢芽先端部(黄色)ではH3K27me3が多く蓄積しているのに対し、Pcgf3/5変異型の肢芽先端部(水色)ではその蓄積は著しく失われている。