2024-12-24 理化学研究所
理化学研究所(理研)生命機能科学研究センター 栄養応答研究チームの大井 綾乃 研究パートタイマーⅠ(研修生)、小幡 史明 チームリーダーらの共同研究グループは、炎症によって臓器が傷害を受ける仕組みをショウジョウバエ[1]の尿細管(マルピーギ管[2])を用いて調べたところ、本来は病原菌を標的とするはずの抗菌ペプチド[3]が自らの臓器を傷つける原因になっていることを発見しました。
本研究成果は、炎症が引き起こす病態の機序の理解につながり、炎症性疾患に対する新規治療法の開発に貢献すると期待されます。
自然免疫経路[4]の活性化により起こる炎症は、病原菌の排除に必要な一方で、過度になると自らの臓器を傷害するという二面性を持っています。しかし、炎症により発現が誘導される膨大な数の因子のうち、傷害に関わる因子を特定することは困難でした。
今回、共同研究グループはショウジョウバエのマルピーギ管を用いて、炎症による傷害を起こす因子を遺伝学的手法で探索しました。その結果、炎症を起こした臓器の細胞がつくり出す抗菌ペプチドの一種Attacin-D(AttD)をコードする遺伝子の発現を抑制したときにのみ、病態が改善することを明らかにしました。AttDは細胞外に分泌されないというユニークな特徴を持ち、その結果、細胞内にとどまって臓器を傷害することが分かりました。さらに腸がんのショウジョウバエに見られる炎症にも、AttDが関与していることを突き止めました。
本研究は、科学雑誌『Cell Reports』オンライン版(12月23日付:日本時間12月24日)に掲載されました。

ショウジョウバエの通常個体(左2匹)とマルピーギ管炎症で腹部が膨満した個体(右2匹)
背景
異物の侵入や刺激により免疫経路が活性化すると、局所的な発熱や腫れ、痛みなどを伴う炎症反応が引き起こされます。炎症は、病原体などの異物の排除に重要な役割を担いますが、一方で過度または慢性的な炎症は臓器を傷害し、機能低下を引き起こします。このように「もろ刃の剣(つるぎ)」ともいえる炎症は、その強度を適切に制御することが重要と考えられてきました。例えば関節リウマチなどの炎症性疾患の治療には免疫反応全体を阻害する薬が用いられることがあります。しかし、このような方法では生体防御という炎症の本来の役割まで抑制するため、感染症にかかりやすくなるという副作用が起きてしまうことが課題となっています。副作用の少ない治療のためには臓器傷害を引き起こす因子のみを阻害する薬が必要ですが、膨大な数の因子が関わる炎症反応において、どの因子が傷害に関わるかを生体内で解明することは困難です。
ショウジョウバエは小さいながらも基本的な臓器構造を持ち、哺乳類と同じような自然免疫経路を持っているため、免疫研究のモデルとして用いられてきました。これまでに、ショウジョウバエの各臓器における免疫反応が臓器傷害を誘導することも複数報告されています。このうち、小幡チームリーダーらは先行研究において、ショウジョウバエの加齢に伴ってマルピーギ管で生じる慢性的な炎症が、個体の寿命を短縮させることを明らかにしました注1)。しかし、炎症によってマルピーギ管が傷害されるメカニズムは明らかになっていません。
そこで本研究では、遺伝学的手法を用いて、ショウジョウバエのマルピーギ管の炎症により誘導される因子について、その傷害への関与を調べ、臓器傷害に必要な因子の同定を試みました。
注1)Yamauchi, T., Oi, A., Kosakamoto, H., Akuzawa-Tokita, Y., Murakami, T., Mori, H., Miura, M., and Obata, F. Gut Bacterial Species Distinctively Impact Host Purine Metabolites during Aging in Drosophila. iScience 23, 2020
研究手法と成果
共同研究グループはまず、マルピーギ管で炎症が起きたときに個体全体やマルピーギ管自体にどのような影響が出るかを解析しました。そのため、遺伝学的手法を用いてショウジョウバエの自然免疫経路の一つであるImd経路[5](哺乳類のTNFR経路[5]に相当)を活性化することでマルピーギ管に炎症を誘導しました。マルピーギ管は体液から尿をつくることで体内のイオンや水分のバランスを保つ働きをしているため、その機能不全により水分蓄積による水膨れが起こることが知られています。予想通り、マルピーギ管の炎症により、体内水分量の増加による腹部の膨満や、マルピーギ管での細胞脱落などが観察され、マルピーギ管の機能と形態の両方に異常が起きることが分かりました(図1)。
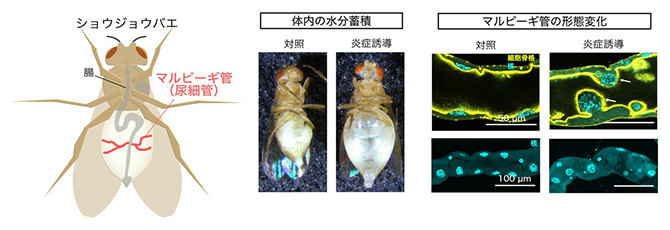
図1 マルピーギ管での炎症誘導による機能・形態異常
左)ショウジョウバエ体内の腸とマルピーギ管の配置。
中)マルピーギ管特異的に炎症誘導(Imd経路活性化)を行った個体の写真。対照群に比べて炎症誘導群では水分の蓄積により腹部が膨満した。
右)マルピーギ管特異的に炎症誘導(Imd経路活性化)を行った個体のマルピーギ管の写真。上部は断面図で、蛍光標識ファロイジン(Phalloidin)により黄色に染色したアクチン(細胞骨格)と、蛍光色素ヘキスト(Hoechst)によりシアンに染色した核を示している。炎症誘導個体では矢印で示すように細胞が脱落している様子が見られた。下部は焦点を移動させて撮影した積層画像で、視野内の核(シアン)の全形を示している。炎症誘導個体では核の数の減少や並び方の異常が見られた。
このときの状態を詳細に記述するため、次世代シーケンサーを用いてマルピーギ管で発現する遺伝子の網羅的な発現解析(RNAシーケンス:RNAseq)を行いました。Imd経路の活性化により889遺伝子の発現が増加、793遺伝子が減少しており、増加した遺伝子の中にはImd経路により誘導される転写因子NF-κB[6]のターゲット遺伝子の他に、ストレス関連遺伝子、細胞死関連遺伝子などが含まれていました。そこで、発現増加した遺伝子の中から特に増加率の高い100遺伝子を、マルピーギ管傷害を引き起こす「炎症性傷害因子」候補として絞り込みました。
これらの候補遺伝子のどれがマルピーギ管傷害に必須であるかを調べるため、Imd経路の活性化と同時に候補遺伝子を一つずつ抑制したときの傷害の有無を観察しました。その結果、抗菌ペプチドの一種であるAttacin-D(AttD)をコードする遺伝子の発現を抑制したときにのみ傷害が起きなくなりました。よって、AttDがImd経路活性化による傷害の誘導に必要な因子であることが明らかになりました(図2)。ショウジョウバエには抗菌ペプチドに分類される遺伝子が42種類存在し、免疫の活性化によって誘導されて細菌を攻撃することで生体防御に働くことが知られています。Imd経路を活性化したマルピーギ管でも多くの抗菌ペプチド遺伝子が誘導されていたにもかかわらず、傷害に必要な因子として同定されたのはAttDのみでした。AttD遺伝子と似た配列を持つ仲間であるAttacin-A(AttA)遺伝子でさえ、抑制しても効果はありませんでした(図2)。AttDを抑制したときには他の抗菌ペプチドの発現には影響がなかったことから、Imd経路の生体防御機能を損なわずに傷害のみを抑制できたといえます。

図2 遺伝学的スクリーニングによる傷害誘導因子Attacin-Dの同定
左)遺伝学的スクリーニングの概要。炎症誘導により発現が増加した遺伝子のうち増加率上位100遺伝子を候補として、炎症誘導(Imd経路活性化)と同時にそれらを一つずつ抑制した上で細胞傷害の有無を観察した。その結果、Attacin-D(AttD)遺伝子の発現を抑制したときのみ、炎症誘導に伴う傷害が起こらなかった。
右)マルピーギ管特異的に炎症誘導(Imd経路活性化)とAttDの抑制を行った個体の写真。炎症誘導を行っていてもAttDを抑制すると腹部の膨満が見られなくなった。しかし、AttDと似た配列を持つAttAを抑制した場合は腹部の膨満が観察された。
一般的に抗菌ペプチドは、外界と接触する組織から侵入する細菌を標的とします。そのため、細菌を感知した細胞で合成された抗菌ペプチドは、細胞外に分泌されるのに必要なシグナル配列[7]を有しています。しかしショウジョウバエの持つ全ての抗菌ペプチドについてシグナル配列を調べたところ、唯一AttDにはシグナル配列が存在しないことが分かりました(図3)。また昆虫由来の培養細胞を用いた解析からも、他の抗菌ペプチドとは異なりAttDは細胞外に分泌されないことが実験的にも確認され、AttDは分泌されずに細胞内にとどまることで細胞自身に傷害を引き起こしている可能性が考えられました。
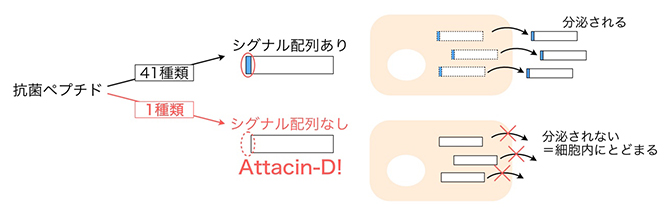
図3 抗菌ペプチドの中で唯一シグナル配列を持たないAttacin-D
ショウジョウバエの持つ42種類の抗菌ペプチドのシグナル配列を予測したところ、Attacin-D(AttD)は唯一シグナル配列を持たなかった。昆虫由来の培養細胞を用いた実験でも、AttDは培養液中に検出されなかったことから、細胞外に分泌されず、細胞内にとどまることが確認された。
ショウジョウバエは、がん研究にも有用であることが知られています。先行研究において、腸の幹細胞にがん遺伝子を強制発現させることで、がんの発症により誘導されたマルピーギ管炎症が個体死を引き起こすことが報告されていました注2)。そこでがん病態へのAttDの寄与を調べるため、腸でのがん誘導と同時にAttDを抑制したところ、水分蓄積による腹部の膨満や個体死などのがん病態がほとんど完全に回復することが分かりました。以上の結果より、AttDは炎症によるマルピーギ管機能や形態の異常に決定的な因子であることが明らかになりました(図4)。
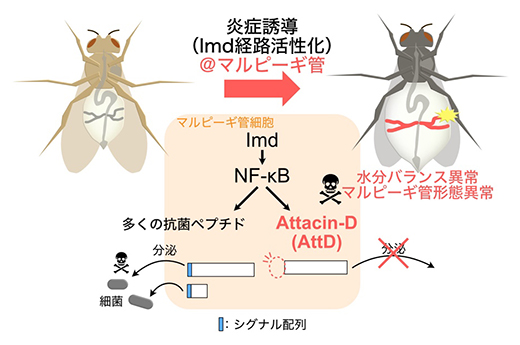
図4 炎症によるマルピーギ管傷害機構
炎症誘導(Imd経路活性化)によりマルピーギ管で発現が増加する遺伝子のうち、AttD以外の抗菌ペプチドは細胞外に分泌されて細菌を排除し生体防御に働く。一方で、唯一シグナル配列を持たない抗菌ペプチドであるAttDは細胞内で毒性を発揮し、形態と機能の異常の原因となる。
注2)Chen, Y., Xu, W., Chen, Y., Han, A., Song, J., Zhou, X., and Song, W. Renal NF-κB activation impairs uric acid homeostasis to promote tumor-associated mortality independent of wasting. Immunity 55, 2022
今後の期待
自然免疫により発現が誘導される遺伝子は数百以上に及ぶことが知られています。しかし、そのうちどれがその遺伝子を持つ生物自身の細胞を傷害するかは不明でした。今回の発見により、病原菌を殺すための抗菌ペプチドが、炎症反応において自身を傷害することが明らかとなりました。これまでに見つかった多数の抗菌ペプチドはいずれも機能的に同等である(重複する)と考えられてきましたが、AttDはショウジョウバエにおいて唯一分泌能を失った特殊な抗菌ペプチドであり、この一つのみが臓器傷害に重要であることを示した点で画期的です。本研究は炎症による特定の臓器傷害が、炎症反応の結果誘導される特定の遺伝子によってなされることを解明した初めての例であり、炎症による臓器傷害機構の新たな知見として重要です。さらに、今回見いだされた臓器傷害とそれを誘導する炎症性因子の一対一の関係が他の臓器にも存在するのか、また分泌能を失った抗菌ペプチドの本来の生理的な役割は何かなど、自然免疫に関わる新たな問いも浮かび上がりました。
Imd経路と相同な経路は哺乳類にも存在しますが、哺乳類でAttDに相当する遺伝子は現在のところ見つかっていません。しかし、シグナル配列を持たないという特徴やその構造から類似した遺伝子を探索することで、本研究の知見が今後哺乳類にも拡大されることが期待されます。それにより、炎症性疾患に対して、免疫全体の抑制ではなく臓器傷害に重要な因子のみを抑制するという新しい治療法の開発につながるかもしれません。
補足説明
1.ショウジョウバエ
ショウジョウバエは、体長2~3mm前後の大きさで、飼育が容易であり、遺伝学的な解析に優れていることから、さまざまな研究分野でモデル生物として用いられている。
2.マルピーギ管
哺乳類の腎臓尿細管に相当するショウジョウバエの臓器。体液中からイオンや水を輸送して尿を生成することで、体液のイオンや水分のバランスを保つ。生成された尿は、直接結合している腸を経由して体外に排せつされる。
3.抗菌ペプチド
植物から哺乳類まで幅広い生物に存在し、免疫経路が活性化した際に誘導される物質。一般的に細胞外に分泌されて細菌に到達し、さまざまな機構で細菌を殺す働きをする。
4.自然免疫経路
幅広い生物に生まれつき備わった生体防御システムである免疫経路の一つ。侵入した病原体に素早く反応して排除する。ヒトやマウスといった脊椎動物では自然免疫の他に獲得免疫という病原体に応じた対処方法を記憶する後天的な免疫経路があるのに対して、昆虫などの無脊椎動物は自然免疫しか有していない。
5.Imd経路、TNFR経路
Imd経路は、哺乳類の腫瘍壊死因子受容体(TNFR)経路と相同性を示すショウジョウバエの自然免疫経路の一つ。細菌の細胞膜成分を感知して活性化し、抗菌ペプチドなどの免疫関連因子の発現を誘導して異物を排除する。ImdはImmune deficiencyの、TNFRはTumor Necrosis Factor Receptorの略。
6.NF-κB
Imd経路が活性化したときに活性化し、核の中に移行してさまざまな遺伝子の転写を促進する転写因子。ターゲットには抗菌ペプチドなどの遺伝子が多くある。哺乳類の自然免疫経路が活性化するときにも同様の因子が誘導される。
7.シグナル配列
タンパク質の局在場所を示す目印となる配列。細胞質で合成されたタンパク質のシグナル配列が読み取られることで細胞外や細胞膜など適切な場所に輸送される。
共同研究グループ
理化学研究所 生命機能科学研究センター 栄養応答研究チーム
研究パートタイマーⅠ 大井 綾乃(オオイ・アヤノ)
(研修生、京都大学 大学院生命科学研究科 博士後期課程)
チームリーダー 小幡 史明(オバタ・フミアキ)
(京都大学 大学院生命科学研究科 客員准教授)
東京大学 大学院薬学系研究科 遺伝学教室
教授 三浦 正幸(ミウラ・マサユキ)
助教 篠田 夏樹(シノダ・ナツキ)
東京薬科大学 生命科学部生命医科学科 再生医科学研究室
講師 長島 駿(ナガシマ・シュン)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、主に日本医療研究開発機構(AMED)革新的先端研究開発支援事業「健康・医療の向上に向けた早期ライフステージにおける生命現象の解明」における「発生期環境による寿命制御機構の解明(研究代表者:小幡史明)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「排出を起点とした代謝恒常性制御機構の遺伝学的解析(研究代表者:小幡史明)」、同特別研究員奨励費「炎症性臓器傷害を引き起こす新規遺伝子の機能解析(研究代表者:大井綾乃)」、内藤記念科学振興財団研究助成「発生期自然免疫活性化による生理変化プログラミング機構の解明(研究代表者:小幡史明)」、理化学研究所大学院生リサーチ・アソシエイト制度による助成を受けて行われました。
原論文情報
Ayano Oi, Natsuki Shinoda, Shun Nagashima, Masayuki Miura, Fumiaki Obata, “A Nonsecretory Antimicrobial Peptide Mediates Inflammatory Organ Damage in Drosophila Renal Tubules”, Cell Reports, 10.1016/j.celrep.2024.115082
発表者
理化学研究所
生命機能科学研究センター 栄養応答研究チーム
研究パートタイマーⅠ 大井 綾乃(オオイ・アヤノ)
(研修生)
チームリーダー 小幡 史明(オバタ・フミアキ)
報道担当
理化学研究所 広報室 報道担当