〝CaVT (カブト)〟の開発に成功
2020-03-11 京都大iPS細胞研究所
ポイント
- 遺伝子導入に用いられる合成メッセンジャーRNA注1)からの翻訳注2)を活性化させることができる人工翻訳活性化タンパク質 (Caliciviral VPg-based Translational activator, CaVT:カブト) の開発に成功しました。
- CaVTを結合させることで、通常状態では翻訳が低く抑えられている特殊な合成メッセンジャーRNAの翻訳を活性化させることができます。
- 制御対象となる合成メッセンジャーRNA側のCaVT結合部位を変えることで、翻訳活性化と翻訳抑制の両方を一種類のCaVTで行うことができます。
- 低分子化合物により翻訳活性化能を調節できるCaVTや、細胞の種類に応じて翻訳を自律的に調節するCaVTも開発しました。
- このCaVTを介した翻訳調節により、ゲノム編集や細胞死誘導のような生命現象を制御可能な人工遺伝子回路注3)を構築できました。
1. 要旨
中西秀之プロジェクト助教(現東京医科歯科大学生体材料工学研究所、元京都大学CiRA未来生命科学開拓部門 特定研究員)、齊藤博英教授(CiRA同部門)の研究グループは、細胞内に導入した合成メッセンジャーRNAからタンパク質への翻訳を活性化することができる人工翻訳活性化タンパク質を開発し、これをCaliciviral VPg-based Translational activator (CaVT: カブト) と名づけました。
制御対象となる合成メッセンジャーRNA上にあるCaVT結合部位を変えることで、その翻訳に対するCaVTの効果を活性化から抑制まで幅広く調節することができ、更には細胞種間の差異や、低分子化合物を検知して翻訳を制御することも可能です。
合成メッセンジャーRNAはDNAと比較して安全性が高いことから、遺伝子治療のような医療目的での遺伝子導入において期待が寄せられていましたが、状況に応じた遺伝子発現のオン・オフ切り換えを可能にする「人工遺伝子回路」の構築にあたっては、遺伝子発現の直接的な活性化が難しいという問題点もありました。本研究の成果は合成メッセンジャーRNAを用いた遺伝子導入においても遺伝子発現の直接的な活性化を可能とするものであり、これはより安全かつ有効性の高い合成メッセンジャーRNAの医療応用に繋がるものと期待できます。
この研究成果は2019年 3月 10日に英国科学誌「Nature Communications」でオンライン公開されました。
2. 研究の背景
細胞内に導入された複数の遺伝子により構成され、構成要素である遺伝子の発現が状況に応じて制御される「人工遺伝子回路」は、遺伝子治療や再生医療といった医療から微生物を用いた有用物質の産生に至るまで幅広い応用が期待されています。こうした人工遺伝子回路を構成する各遺伝子の導入にはDNAが通常用いられますが、特に遺伝子治療や再生医療といった医療方面での応用の場合、外から導入したDNAが細胞本来のゲノムDNAへと挿入されることでゲノムDNA上に元々存在する遺伝子の変異を引き起こしてしまう危険性が懸念されます。
合成メッセンジャーRNAを用いた遺伝子導入ではDNAを用いた場合と異なり、こうした変異の危険を回避することができます。しかしその一方で、遺伝子の導入に合成メッセンジャーRNAを用いた場合、人工遺伝子回路の多くで重要な役割を担っている転写活性化タンパク質による遺伝子発現の活性化が利用できないという問題点もありました。
そこで本研究では、合成メッセンジャーRNAからタンパク質への翻訳を直接活性化できる人工翻訳活性化タンパク質を開発しました。
3. 研究結果
1) Cap模倣タンパク質とモチーフ特異的RNA結合タンパク質を組み合わせて作製したタンパク質〝CaVT〟により、標的モチーフを持つ合成メッセンジャーRNAを選択的に翻訳活性化できました。
哺乳類を含む真核生物のメッセンジャーRNAは末端にCap(キャップ)と呼ばれる構造を持ち、このCap構造を真核細胞翻訳開始因子 (eukaryotic Initiation Factor, eIF) が認識することにより、メッセンジャーRNAからタンパク質への翻訳が開始されることが知られています。一方、ネコカリシウイルスやノロウイルスといったカリシウイルス科のウイルスのRNAはCap構造を持たず、代わりにViral Protein genome-linked (VPg) と呼ばれるタンパク質が末端に結合しています。カリシウイルスのRNA上にある遺伝子の翻訳は、ウイルスの感染対象である細胞が元々持っている真核細胞翻訳開始因子がこのVPgを認識することで開始されるのです。
そこで研究グループは、通常のCap構造を持たない合成メッセンジャーRNAとこのVPgを組み合わせることで、必要時にのみ翻訳を活性化できる制御システムが作れるのではないかと考えました。
本研究ではまず、二種類のカリシウイルス(ネコカリシウイルスならびにノロウイルス)に由来するVPgに、モチーフ特異的なRNA結合タンパク質であるMS2コートタンパク質(MS2 Coat Protein, MS2CP)を融合させたものを作製しました。また、制御対象側として、通常のCap構造を持たず、代わりにMS2CPが結合するモチーフを持つ特殊な合成メッセンジャーRNAも作製しました。
上記のMS2CP-VPg融合タンパク質を発現する合成メッセンジャーRNA(こちらはCap構造を持ちます)と制御対象側の合成メッセンジャーRNAをともにヒト子宮頸がん由来培養細胞に導入したところ、ノロウイルス由来のVPgではMS2CPの結合モチーフを持たない非標的メッセンジャーRNAの翻訳まで活性化してしまいました。一方、ネコカリシウイルス由来のVPgを用いた場合は、MS2CPの結合モチーフを持つ合成メッセンジャーRNAを選択的に翻訳活性化できることが分かりました。そこで、このネコカリシウイルス由来VPgとMS2CPの融合タンパク質をCaliciviral VPg-based Translational activator (CaVT) と名づけ、以後の検討に用いました(図1)。
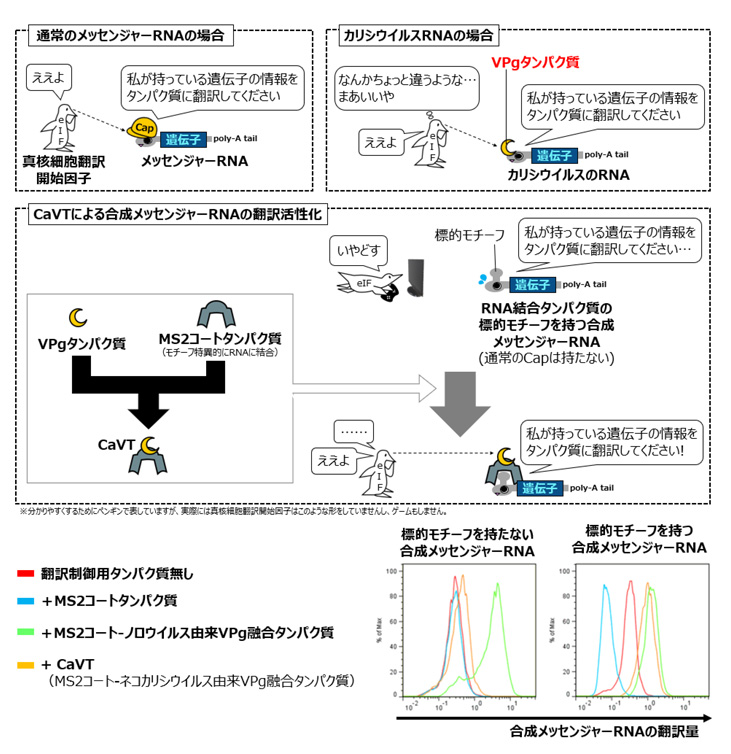
図1 CaVTによる翻訳活性化のメカニズム(上)と実際の結果(下)
2)翻訳に対するCaVTの効果は、制御対象の合成メッセンジャーRNAが持つ結合モチーフの種類や位置により異なることが分かりました。
CaVTによる翻訳活性化に最適な条件を見つけるため、制御対象の合成メッセンジャーRNAとして、結合モチーフの種類や位置が異なる複数のタイプを作製しました。その結果、結合力が弱めのモチーフを持つ合成メッセンジャーRNAと組み合わせた場合の方が、CaVTの翻訳活性化効果は高くなることが分かりました。また、逆に非常に結合力が強いモチーフを持つ合成メッセンジャーRNAと組み合わせた場合は、CaVTは翻訳活性化ではなくむしろ翻訳抑制を引き起こすことが分かりました(図2)。このようにCaVTを用いることで、合成メッセンジャーRNAからの翻訳を自在に制御できるようになりました。
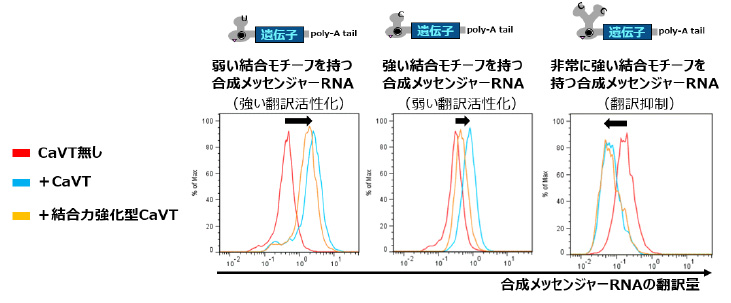
図2 合成メッセンジャーRNAが持つ結合モチーフの違いが
CaVTによる翻訳活性化に与える影響
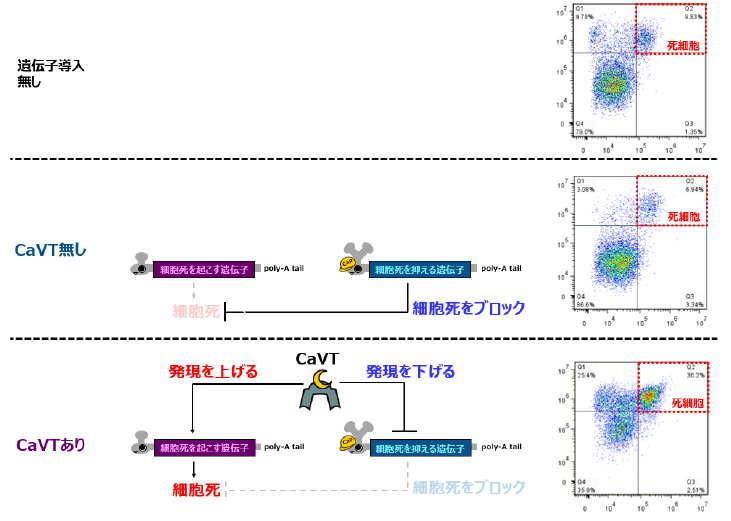
図3 CaVTを活用した人工遺伝子回路による細胞死の制御
3)CaVTを含む人工遺伝子回路を構築することで、ゲノム編集や細胞死誘導を細胞の内部状態に応じて制御することができました。
多くの生命現象は、逆向きの働きを持つ複数のタンパク質のバランスにより成り立っています。例えばBaxというタンパク質は細胞死を誘導するのに対し、Bcl-xLと呼ばれるタンパク質はこの細胞死誘導を抑制する働きを持ちます。研究グループは、モチーフが異なる合成メッセンジャーRNAに対しては異なる効果を及ぼせるというCaVTの特性を活用することでこうしたタンパク質のバランスを変化させ、生命現象を操作できるのではないかと考えました。
そこで、Bax遺伝子を持つ合成メッセンジャーRNAに弱い結合モチーフを、Bcl-xL遺伝子を持つ合成メッセンジャーRNAに強い結合モチーフをそれぞれ付与し、これらの制御対象RNAとCaVTによって構成される人工遺伝子回路を構築しました。この人工遺伝子回路を導入された細胞は、CaVTが無い状態ではBax遺伝子の翻訳は低く、Bcl-xL遺伝子の翻訳は高い状態であるため、細胞死が誘導されませんでした。一方、CaVTの存在下においては、CaVTによりBax遺伝子の翻訳が活性化され、逆にBcl-xL遺伝子の翻訳が抑制されることにより、細胞死の誘導が起こりました(図3)。
CaVTを利用した人工遺伝子回路の汎用性について検討するため、ゲノム編集に用いられるCas9の遺伝子を持つ合成メッセンジャーRNAに弱い結合モチーフを、Cas9に対する阻害効果を有するAcrIIA4の遺伝子を持つ合成メッセンジャーRNAに強い結合モチーフをそれぞれ付与したものも作製しました。これらにより構成される人工遺伝子回路を細胞に導入したところ、細胞死制御の場合と同様、CaVTが無い状態ではゲノム編集が抑えられ、CaVTの存在下ではゲノム編集が引き起こされることが確認できました(図4)。
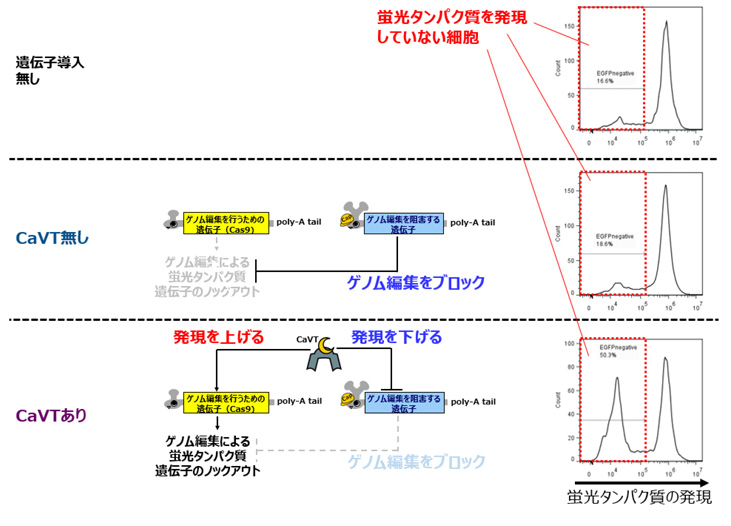
図4 CaVTを活用した人工遺伝子回路によるゲノム編集の制御
更に、細胞種に応じた制御を可能にするため、CaVTを発現する合成メッセンジャーRNAに対し、細胞種によって活性が異なるマイクロRNAの標的配列を付加しました。その結果、マイクロRNA活性に応じて細胞死誘導やゲノム編集を制御することができるようになりました。例えば、同じ人工遺伝子回路を導入してもヒト子宮頸がん由来細胞ではほとんどゲノム編集が起こらないがヒトiPS細胞ではゲノム編集が起こるといった現象を引き起こすことに成功しています(図5)。
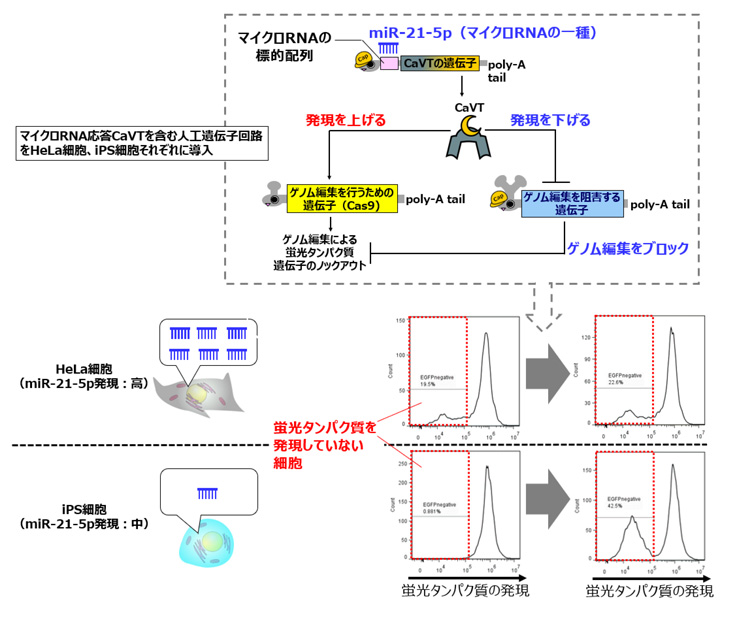
図5 マイクロRNA標的配列を付加したCaVTによる細胞種選択的なゲノム編集の制御
4)分割したCaVTに薬物介在性結合ドメインを融合させることで、薬物を介した翻訳の制御を実現しました。
薬物を介した遺伝子発現制御は、発現のタイミングや発現量の調節を可能にします。そのため、テトラサイクリン応答転写活性化因子に代表されるような薬物応答性の転写活性化タンパク質は、DNAを用いた人工遺伝子回路においては重要な役割を担っています。その一方で、こうした転写活性化タンパク質は、合成メッセンジャーRNAを用いた人工遺伝子回路では利用することができません。そこで本研究では、合成メッセンジャーRNAを用いた人工遺伝子回路においても薬物による遺伝子発現調節を可能にするため、薬物応答性を持つCaVTを開発しました。
通常のCaVTはRNA結合の役割を担うMS2CPと翻訳活性化を担うVPgが直接融合していますが、薬物応答性のCaVTではこれらは分離しており、それぞれに薬物介在性の結合領域が付加されています。薬物が投与されていない状態でもMS2CPは制御対象の合成メッセンジャーRNAに結合していますが、VPgの方は合成メッセンジャーRNAに作用していないため、合成メッセンジャーRNAの翻訳は活性化されません。そして薬物が投与されると、MS2CPとVPgそれぞれに付加された薬物介在性結合領域が互いに結合し、これによりVPgが制御対象の合成メッセンジャーRNAに作用できるようになることで、翻訳が活性化されるという仕組みになっています。実際に、この分割型CaVTを用いることで、薬物濃度に応じた翻訳活性化が可能であることが示されました(図6)。
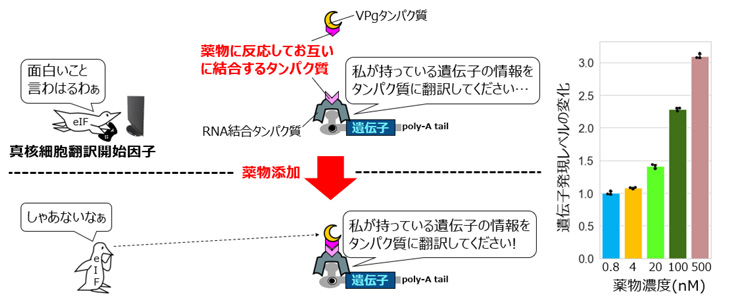
図6 分割型CaVTを用いた薬物による翻訳レベルの調節
4. まとめ
本研究では、細胞内で合成メッセンジャーRNAの翻訳を活性化させる人工翻訳活性化タンパク質の開発に成功し、これをCaVTと名づけました。CaVTは細胞種や薬物に応じて翻訳を制御することもでき、細胞死誘導やゲノム編集など幅広い生命操作技術に活用できます。CaVTによる翻訳制御の対象とする合成メッセンジャーRNAにはどのような遺伝子を載せることもできることから、今後、細胞の分化や初期化の誘導、分化後の細胞の純化といった再生医療・創薬に必要な生命操作技術の発展に寄与するものと期待されます。
5. 論文名と著者
- 論文名
Caliciviral protein-based artificial translational activator for mammalian gene circuits with RNA-only delivery - ジャーナル名
Nature Communications - 著者
Hideyuki Nakanishi1+ and Hirohide Saito1 - 著者の所属機関
1. 京都大学 iPS細胞研究所(CiRA)
+ 現所属:東京医科歯科大学生体材料工学研究所 生体材料機能医学分野
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会・文部科学省 科学研究費補助金「基盤研究S」
- 日本学術振興会・文部科学省 科学研究費補助金「若手研究」
- 京都大学教育研究振興財団「研究活動推進助成」
- 内藤記念科学振興財団
7. 用語説明
注1)合成メッセンジャーRNA
細胞内における遺伝子発現は、ゲノムDNA上にある遺伝子がまずメッセンジャー(伝令)RNAという分子にコピーされた後、そのメッセンジャーRNA上の情報をもとにタンパク質が作られるという経過をたどる。このメッセンジャーRNAを細胞内ではなく、試験管内で人工的に合成したものを「合成メッセンジャーRNA」と呼ぶ。合成メッセンジャーRNAを細胞内に入れると、通常のメッセンジャーRNAの場合と同様にタンパク質が作られる。
注2)翻訳
遺伝子発現の二つの段階のうち、メッセンジャーRNA上の情報からタンパク質が作られる段階を「翻訳」と呼ぶ。また、DNAからメッセンジャーRNAへと情報がコピーされる段階は「転写」と呼ばれる。
注3)人工遺伝子回路
目的遺伝子を含めた複数の遺伝子を細胞内に導入し、それらの間の相互作用により目的遺伝子の発現を制御するシステムを「人工遺伝子回路」 と呼ぶ。