2018-06-06 量子科学技術研究開発機構,日本医療研究開発機構
発表のポイント
- 高感度のナノ粒子型MRI造影剤※1と高磁場MRI※2を組み合わせることで、がん内部の血管構造を三次元的かつ高精細に観察することに成功した
- 抗がん剤治療中の血管構造やナノ粒子型MRI造影剤の分布の変化を長期に、安全に追跡できた
- 治療効果を正確に予測して先手を打つ「見ながら治療(Theranostics)※3」を実現するための重要な技術となる
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)QST未来ラボの青木伊知男グループリーダー、新田展大技術員らと、徳島大学大学院医歯薬学研究部放射線医学分野の原田雅史教授は共同で、生体内のがん内部の血管構造を立体的かつ高精細に可視化し、治療による血管構造の変化を安全に長期間追跡することに成功しました。
がんが自ら作り出す血管は、がん内部に特殊な構造を形成します。血管の周囲に間質細胞※4や線維化※5による「バリアー」ができたがんは、血管から薬剤が届きにくくなる、低酸素化により薬剤抵抗性を獲得するなどで、より治療が難しくなります。
がん治療の精度を高めるためには、薬剤ががんに届くかを予測・評価することが必要です。そのためには、治療前や治療中のがん内部の血管構造を三次元的かつ高精細に、被ばくのリスクを最小限に抑えて観察することが必要になりますが、既存の技術でそれらを実現することは困難でした。
そこで、研究グループは、高感度のナノ粒子型MRI造影剤(2011年7月1日プレスリリース)に、高い信号が得られる高磁場MRI(7テスラ=70000ガウス)とノイズ信号を少なくできる特殊な受信コイルを組み合わせることで、がんの内部の血管構造を50 µm(1 µmは1 mmの1/1000)の高い解像度で、三次元的かつ安全に可視化する技術を開発しました。
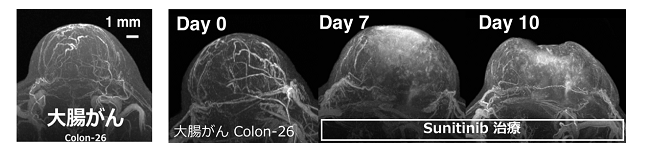
大腸がんを皮下に移植したマウスにナノ粒子型MRI造影剤を投与して、高磁場MRIを使って血管造影法で撮影した結果、がんの内部の小さな血管の立体構造が明瞭に描出されました(下図左)。また、がんの血管形成を抑制する抗がん剤(スニチニブ)を投与し、がん内部の血管構造の変化や、ナノ粒子型MRI造影剤の分布を10日間にわたって追跡することができました(下図右)。
本成果は、がん治療中の内部の変化を詳細に観察し、その情報に基づいて治療効果を予測・評価することで最適な治療を、先手を打って選ぶ「見ながら治療(Theranostics)」という未来の医療の実現に対して大きな貢献が期待できます。
本研究は、国立研究開発法人科学技術振興機構(JST)の「センター・オブ・イノベーション(COI)プログラム、国立研究開発法人日本医療研究開発機構(AMED)の次世代がん医療創生研究事業(P-CREATE)「DDS技術を基盤とした革新的がん治療法の開発」および日本学術振興会科学研究費(17H00860)による支援を受け実施されました。この成果は、生命科学におけるナノ科学技術と医学応用に関する国際的学術雑誌「Nanomedicine: Nanotechnology, Biology and Medicine」誌に2018年4月4日に受理され、オンラインに暫定公開(上図の動画を含む)され、間もなく出版予定の6月号(Volume 14, Issue 4)の表紙に採用されオープンアクセスとして公開される見込みです。
採用予定のカバーイラスト:
研究開発の背景と目的
国民の3.5人に1人ががんで死亡し、生涯において男性の54%、女性の40%が、がんに罹患するとされる中、早期に社会復帰できるよう、超早期の診断技術に加えて、治療効果を予測し、がんの病態を詳しく確認しながら治療を行う高精度医療(プレシジョン・メディシン)の必要性が注目されています。
がんの病態を確認する上で重要な観察対象の一つが、がん内部の血管です。がんは、その増殖に伴って、自ら血管を作り出し、酸素や栄養を取り込みます。そのため、がんはその周囲に特殊な血管構造を形成し、その構造は、増殖治療に対する抵抗性に関連するとされています。
例えば、膵臓がんやスキルス胃がんなど、抗がん剤が効きにくいがんでは、がん細胞をバリアーするように周辺に沢山の間質細胞が存在したり、線維化したりして、薬が届きにくくなります。また、血管が少なく酸素が届きにくいがんでは、薬剤や放射線に抵抗性を獲得する細胞が生じ、それが再発や転移など予後の悪化に繋がることが指摘されています。
より高精度ながん治療には、治療を困難にするがんの血管構造を、治療前や治療中にも観察して、適切な治療方法を選択する必要があります。しかし、がんの診断に用いられるポジトロン断層画像法(PET)は解像度が足りず、微細な血管構造を描出することができません。X線CTは高い解像度を持ちますが、検査当たりの被ばく線量が多くなるため、高頻度の撮影は推奨されません。これらのことから、がんの血管構造を長期間にわたって安全に観察する方法がありませんでした。
そこで研究グループは、磁場とFMラジオ帯の電波を使用して生体内を高解像度で可視化できるMRIと、ナノ粒子技術を使った造影剤に注目しました。MRI装置には高い信号が得られる高磁場MRI(7テスラ=70000ガウス)にノイズ信号を少なくできる特殊な受信コイルを組み合わせ、造影剤には脂質二重膜からなるリポソームの外部にガドリニウムを多数配置した高感度のナノ粒子型MRI造影剤(図1、2011年7月1日プレスリリース)を用いることにより、高解像度で、三次元的かつ安全に血管構造を可視化する技術の開発を試みました。
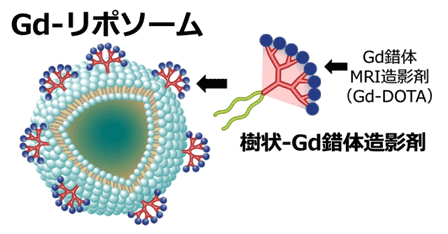
図1 高感度なガドリニウム錯体MRI造影剤
樹状のデンドロン脂質に多数のガドリニウム錯体造影剤(Gd-DOTA)をつけ、リポソーム膜状に配置しました。直径は約100ナノメートルで、造影剤を長時間、血中を巡らせるために、リポソームの二重膜の外側に水溶性高分子ポリエチレングリコール(PEG)を用いています。
研究の手法と成果
(1)高解像がん血管イメージング
大腸がん細胞(Colon-26)をマウスの皮下に移植し、がんの直径が約5 mmになるまで生育後、ナノ粒子型MRI造影剤を尾静脈から投与して、7テスラMRIと特殊なコイルを使って血管造影法で撮影しました。その結果、がんの内部の小血管(細動脈と細静脈)の立体構造を50 µm(1 µmは1 mmの1/1000)と高い解像度で明瞭に描出されました(図2)。
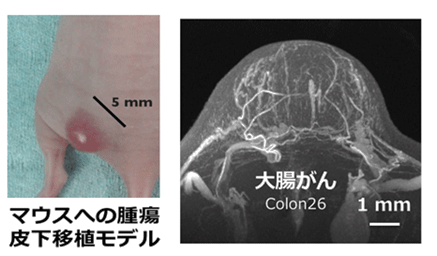
図2 皮下移植がんモデルによる高解像血管イメージング
がんの周囲には多数の血管がありますが、中心部にはあまり血管が観察されません。これは、中心部が低酸素状態になりやすいという過去の研究と一致しています。
(2)治療中のがん血管の変化とナノ粒子分布の観察
がんの血管形成を抑制する抗がん剤スニチニブ(Sunitinib)を毎日投与して、血管構造の変化や、ナノ粒子の分布を、時間経過を追って調べました。その結果、投与7日後には、がん底部に近い領域の血管には大きな変化はありませんでしたが、表面に近い部分の血管は構造に変化が見られ、その付近に多数のナノ粒子型MRI造影剤が集積していました(図3中)。10日後には、がん底部付近の血管は維持されていますが、がんの表面が陥没して体積が減り、その付近に多数のナノ粒子が溜まっていました。また、ナノ粒子のがんへの溜まり方にも、ばらつきがあることが観察されました(図3下段)。
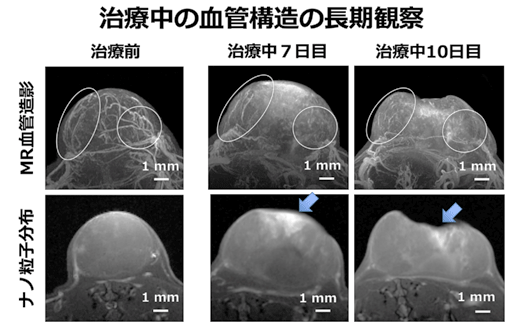
図3 治療中のがんの血管構造の変化とナノ粒子の分布
治療前と比べて、治療中ではがん血管が徐々に崩壊していますが、残っている部分もあることがわかります(白丸)。ナノ粒子が高濃度で分布する部分(矢印)と、低濃度しか分布しない部分があることもわかります。
以上の結果は、開発した技術により、生体内のがんの血管構造を高精細かつ三次元的に、時間を追って治療中の変化をも観察できることを示しています。
今後の展開
現在、開発が進められているコンパニオン診断薬※6は、がん細胞に対する治療の有効性はチェックできますが、がん組織全体に対する有効性は、イメージングを使用しなければ確認できません。
しかし、治療薬と似た動きをする「コンパニオン造影剤※7」を用いれば、がんの内部に十分な濃度になるよう薬剤が届くかどうかを見て確認することができます。今回使用したナノ粒子型MRI造影剤などを「コンパニオン造影剤」として用いて、治療を始める前にがんの内部を可視化し、薬剤が十分に届かないことがわかれば、その部分だけを放射線や粒子線治療と組み合わせるといった最適な治療を選択することができます。
ヒトに利用できる7テスラMRI装置が世界的に徐々に普及を始めており、高磁場MRI装置と「コンパニオン診断薬」を組合せたこのような技術を、将来、ヒトに応用していくことで、がん治療中の内部の変化を詳細に観察し、その情報に基づいて最適な治療を、先手を打って選ぶ「見ながら治療(Theranostics)」を実現できると期待できます。
用語解説
- ※1 ナノ粒子型MRI造影剤
- 造影剤は、診断用の画像を撮影する際に画像のコントラスト(白黒)を強調させるための薬剤です。現在の医療では、MRI用の造影剤として、大半がガドリニウムという元素を、化合物で覆って毒性が出ないようにしたガドリニウム錯体造影剤が使用されています。本研究では、直径約100ナノメートルのリポソームに多数のガドリニウム錯体造影剤を付けたナノ粒子型MRI造影剤を用いています。
- ※2 高磁場MRI
- MRIはMagnetic Resonance Imagingの略で、磁気共鳴画像法と訳される。高い磁場の中で体内の水に特定の周波数の電磁波(FM電波)を与えて、共鳴により得られた信号をコンピュータにより画像化する手法です。国内では6千台以上が稼働するなど、非侵襲的に生体の断層画像を取得する方法として、診断を中心に広く臨床現場で使用されています。
通常の医療では磁場の強さが3テスラ以下のMRIが使用されます。MRIは、高い磁場ほど強い信号を検出できるので、小さな個体を対象とする本研究では、7テスラMRIが使用されました。使用されたMRIでは50ミクロンの解像度で生体の断層画像を得ることができます。ヒト用の7テスラMRIも研究用に世界で50台以上稼動しており、米国で脳診断用に臨床認可を得るための申請がなされています。本研究で得られた結果は、3テスラ以下の臨床装置でも再現が可能ですが、解像度は低下します。 - ※3 セラノスティクス(theranostics)
- 診断技術(diagnostics)と治療技術(therapeutics)を組み合わせた造語で、個々の患者における診断情報を治療に直結させようとする試みで、診断と治療の融合的な概念です。例えば、ある患者に対して、治療を行った結果が迅速に診断(観察)できれば、その結果を元に、すぐさま次の治療を選択できます。我々はこれまでに、抗がん剤ナノミセルとMRI造影剤を組み合わせて、抗がん剤の分布をイメージングで追跡しながら治療を行うセラノスティクス(Cancer Res. 2010 Sep 15;70(18):7031-41)、リポソームに造影剤を内包し、その体内動態や薬剤放出を可視化する手法(Nanomedicine. 2015 Jan;11(1):229-38., Transl Res. 2015 Dec;166(6):660-673.e1)、放射線治療後に短期間で細胞活動の変化を検出し、その後の治療に反映させる手法(Cancer Res. 2013 Jun 1;73(11):3216-24)など、診断と治療の融合に繋がる研究開発を、機構内外の共同研究を通じ積極的に進めています。
- ※4 間質細胞
- 上皮細胞の支持組織を構成する細胞の総称で、線維芽細胞や免疫細胞(リンパ球や好中球,マクロファージなど)、血管内皮細胞、平滑筋細胞などが含まれる。これらの細胞は正常組織の維持に必須であるとともに、炎症反応や創傷治癒反応に重要な役割を担っている(実験医学増刊 Vol.27 No.2より引用)。近年、膵臓がんやスキルス胃がんなど、難治性がんにおいて間質細胞が多いため、薬剤送達を妨げるなど、がんの難治化との関係性が指摘されている。
- ※5 線維化
- 内臓などの組織を構成している結合組織と呼ばれる部分が異常増殖する現象のこと。たとえば、心筋に線維化が生じたときには心臓の働きに異常が起き、呼吸困難や心悸亢進(動悸)などの症状が出る。また関節リウマチにおける骨の萎縮や変性、肝臓全体の線維化を示す肝硬変の病態なども、結合組織が線維化した例としてよく知られている(血液用語辞典より引用)。その発生には免疫細胞や低酸素が関与していると考えられており、繊維化が生じた部位では血流が低下し、薬剤濃度の低下に繋がると考えられる。
- ※6 コンパニオン診断薬
- 特定の医薬品の有効性や安全性を一層高めるために、その使用対象患者に該当するかどうかなどをあらかじめ検査する目的で使用される診断薬。例えば、「ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌」という効能効果を有する抗がん剤の使用前に、その患者さんがALK融合遺伝子陽性かどうかを検査するために用いる診断薬が該当します(独立行政法人医薬品医療機器総合機構コンパニオン診断薬WGより引用)。
-
- 独立行政法人医薬品医療機器総合機構 コンパニオン診断薬WG
- ※7 コンパニオン造影剤
- 量研・青木が提唱する概念。特定の医薬品の有効性や安全性を一層高めるために、その使用対象患者に該当するかどうかなどをあらかじめ生体イメージングで検査する目的で使用される造影剤。例えば、抗がん剤とほぼ同一の体内動態を持ち、その動態を可視化できる造影剤、あるいは抗がん剤を運搬するキャリアを標識した造影剤などにより、治療開始前に治療薬が腫瘍の全領域に送達され一定濃度に達するか、副作用が懸念される部位での濃度は想定内かなどを高解像度のイメージング装置により事前・事後および治療期間中に検査することで、治療薬や治療法の適切な選択を行うための造影剤をいう。治療と診断を一体化したセラノスティクス(theranostics)の一形態であり、高精度医療の実現の一翼を担うと期待される。
掲載論文
- Journal:
- Nanomedicine: Nanotechnology, Biology and Medicine(Elsevier)
- Title:
- Intratumoral evaluation of 3D microvasculature and nanoparticle distribution using a gadolinium-dendron modified nano-liposomal contrast agent with magnetic resonance micro-imaging
- Authors:
- Nobuhiro Nitta,1,2,3 Yoichi Takakusagi,1,2 Daisuke Kokuryo,4 Sayaka Shibata,1,2 Akihiro Tomita,5 Tatsuya Higashi,1 Ichio Aoki,1,2*, Masafumi Harada,3
- Author affiliations:
- 1 National Institute of Radiological Sciences (NIRS), National Institutes of Radiological Science and Technology (QST), 4-9-1 Anagawa, Inage, Chiba, 263-8555, Japan.
- 2 Group of Quantum-state Controlled MRI, QST, 4-9-1 Anagawa, Inage, Chiba, 263-8555, Japan.
- 3 Graduate School of Medicine, Tokushima University, 3-18-15, Kuramoto-cho, Tokushima 770-8503, Japan.
- 4 Graduate School of System Informatics, Kobe University, 1-1, Rokkodai-cho, Nada-ku, Kobe, Hyogo, 657-8501, Japan
- 5 Department of Hematology, Fujita Health University School of Medicine, 1-98 Dengakugakubo, Kutsukake-cho, Toyoake, Aichi, 470-1192, Japan
- *Corresponding Author
本件に関する問い合わせ先
研究内容について
国立研究開発法人量子科学技術研究開発機構・「量子MRI研究グループ」
グループリーダー 青木 伊知男
報道対応
国立研究開発法人量子科学技術研究開発機構
経営企画部 広報課長 鈴木 國弘
AMED事業について
国立研究開発法人 日本医療研究開発機構 戦略推進部 がん研究課