2022-06-28 国立がん研究センター,日本医療研究開発機構
発表のポイント
- 国立がん研究センター中央病院などは、日本医療研究開発機構(AMED)の支援をうけて、難治・希少がんの悪性脳腫瘍である膠芽腫に対し、糖尿病治療薬メトホルミンを併用する多施設第I相臨床試験を2021年3月から先進医療B*1で行い、その安全性を示すことができました。
- 2022年6月からは有効性を検証するための第II相臨床試験を、国立がん研究センター中央病院など5施設で開始しました。
- メトホルミン*2は一般に広く使われている糖尿病治療薬で、山形大学と国立がん研究センターの共同研究で、膠芽腫モデルマウスのがん幹細胞*3の腫瘍形成能を喪失させる可能性を報告し(日本学術振興会科学研究費助成事業 2009-2011年度 基盤研究[B])、2019年に特許を取得しています。
- メトホルミンによる様々ながんに対する有効性が報告されていますが、値段が安く利益をあげられる可能性が低いことから、企業によるメトホルミンのがんに対する臨床開発が進みにくいのが現状です。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)中央病院(病院長:島田和明)などは、最も悪性度の高い脳腫瘍である初発膠芽腫の患者さんを対象に、現在の標準治療に糖尿病治療薬メトホルミンを併用した場合の安全性・有効性を評価する第I相臨床試験(研究代表者:脳脊髄腫瘍科長 成田善孝)を日本医療研究開発機構(AMED)革新的がん医療実用化研究事業の支援により実施し、その安全性を示すことができました(2021年4月から2022年3月)。2022年6月からは、中央病院など5施設にて第II相臨床試験を実施し、今後2年間かけ評価します。
膠芽腫は、予後の悪い難治がんのため有効な治療開発が望まれていますが、希少ながんでもあり治療開発が進みにくいのが現状です。メトホルミンは、一般に広く使用されている安価な糖尿病治療薬で、山形大学医学部(腫瘍分子医科学講座 北中千史教授)との共同研究(日本学術振興会科学研究費助成事業 2009-2011年度 基盤研究[B])において、膠芽腫モデルマウスのがん幹細胞の腫瘍形成能を喪失させる可能性を報告しています。しかし、後発品もあり企業主導による臨床開発が進みにくいことから、医師主導で本臨床試験を実施します。膠芽腫に対するメトホルミンの有用性が明らかとなれば、患者さんにとって新たな治療法の選択肢となり、また医療費も安く抑えられることとなります。
背景
膠芽腫は、手術後に放射線治療と薬物療法(テモゾロミド)を行うのが標準治療ですが、治療開始からの5年生存割合は15%程度*の難治がんで、急速に言葉の障害や手足の麻痺が進む悪性脳腫瘍です。年間発生数は2200人程度(2016年全国がん登録データ)*の希少ながんでもあり、新規治療の開発が進んでおらず、有効な治療開発が望まれています。*Nippon Rinsho Vol 79,Suppl 1,2021
膠芽腫の治療成績を改善するためには、治療後の再発を抑制することが重要で、そのためには再発の要因となるがん幹細胞を標的とする治療法の開発が一つの鍵となると考えられます(図1)。
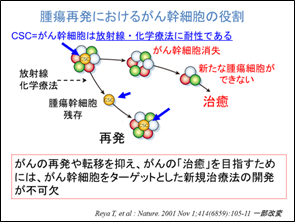
図1 腫瘍再発におけるがん幹細胞の役割
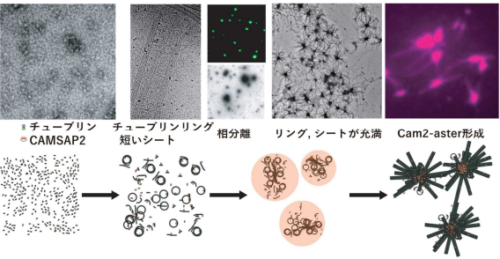
山形大学医学部と国立がん研究センター中央病院の研究チームは、一連の研究からがん幹細胞中のFOXO3という分子を活性化することができれば、がん幹細胞を再発不可能な「ただのがん細胞」に変化させられることを確認し(日本学術振興会科学研究費助成事業 2009-2011年度 基盤研究[B])、さらに、メトホルミンがFOXO3活性化能を持つことに着目した研究を進めました。その結果、培養状態の膠芽腫幹細胞にメトホルミンを作用させると、がん幹細胞としての性質が消失する可能性が示唆され、また膠芽腫モデルマウスにメトホルミンを投与したところ腫瘍中のがん幹細胞が減少することを確認し、メトホルミンが膠芽腫のがん幹細胞の腫瘍形成能を喪失させる可能性が示唆されました(山形大学・国立がん研究センターにて「ガン幹細胞に対する分化促進薬及び脳腫瘍治療薬」として2019年特許取得[特許6489517])。
研究チームは、これらの研究成果(図2)をもとに、膠芽腫の患者さんに対してメトホルミンの有効性を評価する臨床試験の実施を模索してきましたが、メトホルミンの薬価が1日投与分(2250mg)でも90.9円で、1年投与しても33,178円と安価であること、さらにメトホルミンは後発品が多数あり、抗がん剤としての開発には多額の経費が必要であることから、企業の協力が得られませんでした。このように、製薬企業主導では臨床開発を進めにくいことから、医師主導で臨床試験を計画し、2020年度AMEDの革新的がん医療実用化研究事業で本試験である「がん幹細胞を標的とした初発膠芽腫の放射線+テモゾロミド+メトホルミン併用療法の第I・II相臨床試験(研究代表者 成田善孝)」が採択されました。
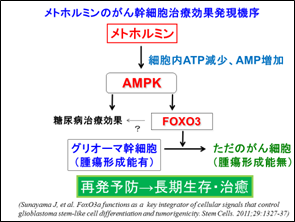
図2 メトホルミンのがん幹細胞治療効果発現機序
「初発膠芽腫に対するテモゾロミド併用放射線期治療後のメトホルミン併用テモゾロド維持療法」について
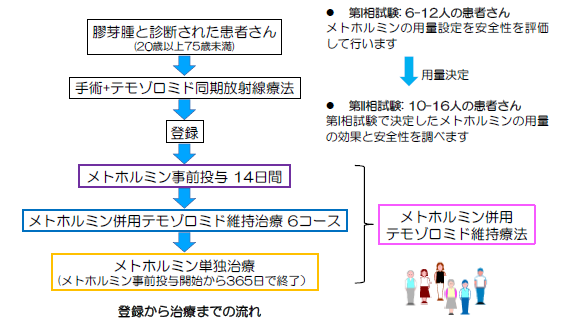
本臨床試験は、20歳-75歳の外来通院可能な初発膠芽腫患者さんを対象に、標準治療である手術後の放射線治療と薬物療法(テモゾロミド)にメトホルミンを併用します。第I相試験では、安全性の評価と推奨用量の決定を行い、第II相試験では安全性と有効性を評価します。
2021年2月に「メトホルミン経口投与及びテモゾロミド経口投与の併用療法」として先進医療Bでの実施が許可され、2021年3月から第I相臨床試験を、国立がん研究センター中央病院脳脊髄腫瘍科などで実施しました。2022年3月までに、7人の初発膠芽腫の患者さんに標準治療薬であるテモゾロミドとメトホルミン1500mg(4人)および2250mg(3人)を投与し安全性を評価する第I相試験を行いましたが、併用時に重篤な有害事象は見られず、メトホルミンの最大用量である2250mgとテモゾロミドを併用しても問題ないことがわかりました。その後、先進医療技術審査部会で審議され、2022年6月から有効性を評価する第II相臨床試験を国立がん研究センター中央病院など5施設で開始しました。第II相臨床試験では15人の患者さんの参加を予定しています。
本臨床試験は先進医療Bのもとで行われ、患者さんに投与されるメトホルミンはAMEDの委託研究費で購入したものを用います。
- 【対象(主な適格規準)】
-
- 初発膠芽腫患者(20歳-75歳)
- 初期治療として放射線(RT)+テモゾロミド(TMZ)療法が施行されている
- 重篤な全身合併症が無く、通常の生活が可能
- 【治療プロトコール】
-
- 事前投与期間(メトホルミン(MF)単独):7日間
- 維持治療(TMZ+MF併用療法) : 6コース(1コース:TMZ5日・MF28日)
- MF単独治療 : 維持治療終了後~試験治療開始後1年まで
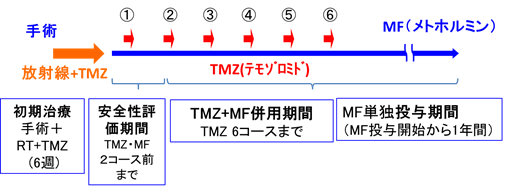
手術による腫瘍摘出後、メトホルミン 500mgを7日間事前内服し、テモゾロミドとの併用でメトホルミン2250mgを内服します。これを事前内服含め2回繰り返し観察を行い、安全性(用量制限毒性)を評価します。テモゾロミドとメトホルミンの併用は6回まで行い、その後メトホルミンを約6ヵ月間(メトホルミン投与から1年間)内服します。
- 【予定登録患者数】
- 第I相臨床試験:7例(2022年3月終了)
第II相臨床試験:15例※第I相試験とあわせて22例(2022年6月開始) - 【研究期間】
- 2021年2月から4年(登録期間2年、追跡期間1年、解析期間1年)
- 【評価項目】
- 主要評価項目:用量制限毒性発現割合、プロトコール完遂割合
- 副次評価項目:有害事象発現割合、プロトコール治療完遂割合、6ヵ月・12ヵ月の無増悪生存割合、全生存期間、奏効割合
- 【臨床的仮説と症例数設定の根拠(参考)】
- 本試験の主たる研究仮説は「試験治療(RT(放射線)+TMZ(テモゾロミド)+MF(メトホルミン)療法)の無増悪生存期間が標準治療(RT+TMZ単独)に対して有意に上回る。」としました。標準治療の【RT+TMZ, TMZ維持療法6コース】の12ヶ月の無増悪生存割合が27%と報告されていることから(Stupp, N Engl J Med. 2005)、 RT+TMZ+MFの12ヶ月の無増悪生存割合が50%を上回れば、RT+TMZ+MFが有望と判断して第III試験(RT+TMZ vs. RT+TMZ+MF)を計画します。RT+TMZ開始からの12ヶ月の無増悪生存割合を50%と仮定すると、有意水準片側10%、検出力70%とし、登録期間2年・フォローアップ期間1年として、二項分布に基づく正確な方法を用いて必要解析対象数を計算すると、必要な症例数が20例となります。若干の不適格例や追跡不能例を見込み、予定登録数を22例としました。
- 【詳細】
- 本試験の詳細は以下をご参照ください。
用語解説
- *1 先進医療B
- 先進医療は、保険診療として認められていない医療技術の中で、保険診療とすべきかどうかの評価が必要であると厚生労働大臣が定めた治療法(評価療養)のひとつです。効果や安全性を科学的に確かめる段階の高度な医療技術で、実施できる医療機関が限定されています。先進医療Bは、未承認の治療法を含む、または未承認の治療法を含まない場合でも臨床試験として、安全性および有効性の評価が特に必要とされる治療法で、保険外併用療養費制度のもと保険診療との併用が認められています。
- *2 メトホルミン
- メトホルミンは1959年以降、日本を含む世界100ヵ国以上で承認されている2型糖尿病治療の第一選択薬です。臨床現場において長期間使用されており安全性プロファイルは確立されています。メトホルミンの添付文書によると、 1日500mgより開始し、通常維持量は1日750mg~1500mgですが、症状により最大2250mgまで用いることができます。添付文書によると主な有害事象は下痢(40.9%)、悪心(15.2%)、食欲不振(12.3%)、腹痛(10.5%)等の消化器症状です。
メトホルミンの発がん抑制作用についてはさまざまな研究がなされ、メトホルミンに発がん抑制作用があることが、後ろ向き研究において報告されています。Notoらによるメタ解析によると、4つのコホート研究と2つのランダム化比較試験の計6研究を解析したところ、メトホルミンはがんによる死亡リスクを34%減少させることが報告されています(Noto H, PLoS One. 2012)。メトホルミンががんの治療薬として使えることが示唆されて、現在様々ながんに対する臨床試験が進行中です。本試験では、膠芽腫に対する標準治療薬のテモゾロミドとメトホルミンを併用することにより、有害事象が増強することが懸念されたため、テモゾロミドとメトホルミン1500mgまたは2250mgの併用による第I相試験を行い、安全性を証明することができました。 - *3 がん幹細胞
- これまでのがん治療では、手術・放射線・抗がん剤による初期治療が奏功して腫瘍がいったん消失したように見えるケースでも、多くの場合で腫瘍の再発がみられます。近年こういった腫瘍の再発は、がん幹細胞と呼ばれる腫瘍中のごく一部の細胞が原因と考えられるようになってきました。がん幹細胞は腫瘍の大部分を占める「ただのがん細胞」とは異なって新たに腫瘍を形成する能力をもっているうえ、放射線や抗がん剤に対する抵抗性が高く、治療後も残存し再発の原因になると考えられています。そこで、従来の治療法に加えてがん幹細胞を標的とした治療法を開発することが重要と考えられるようになってきました。
お問い合わせ先
患者さんからの問い合わせ先
国立がん研究センター中央病院
相談支援センター
報道に関する問い合わせ先
国立がん研究センター
企画戦略局 広報企画室
AMED事業に関する問い合わせ先
日本医療研究開発機構(AMED)
ゲノム・データ基盤事業部 医療技術研究開発課