 細胞遺伝子工学
細胞遺伝子工学 光受容によるリボソーム生合成関連遺伝子の翻訳活性機構~植物の新たな成長制御の解明へ~
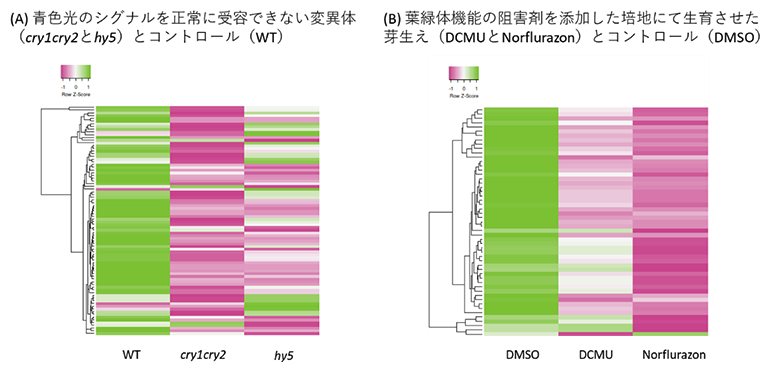
2023-01-20 理化学研究所理化学研究所(理研)環境資源科学研究センター 合成ゲノミクス研究グループの栗原 志夫 研究員(研究当時、現 客員研究員)、赤木 千佳 研修生、松井 南 グループディレクターらの共同研究チームは、植物では、翻...
 細胞遺伝子工学
細胞遺伝子工学  医療・健康
医療・健康 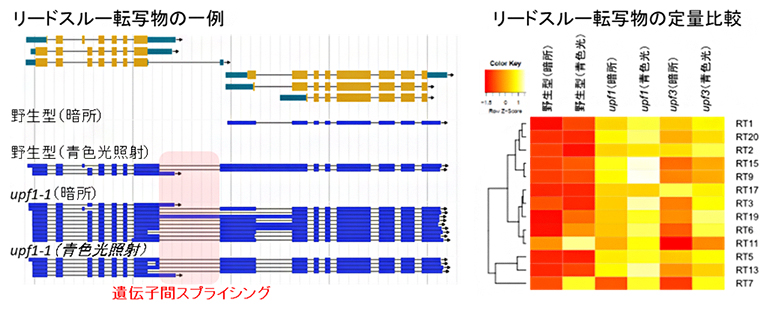 細胞遺伝子工学
細胞遺伝子工学  有機化学・薬学
有機化学・薬学 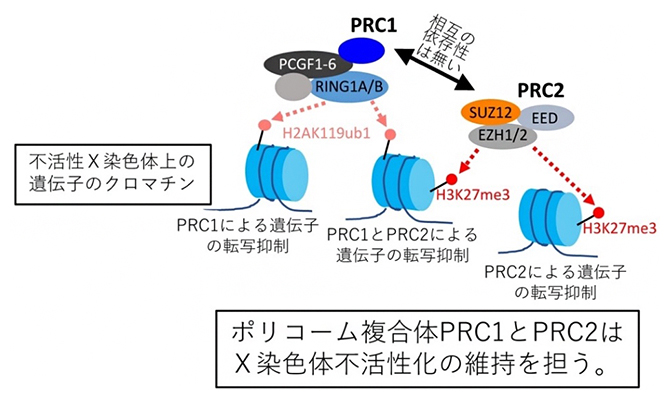 細胞遺伝子工学
細胞遺伝子工学 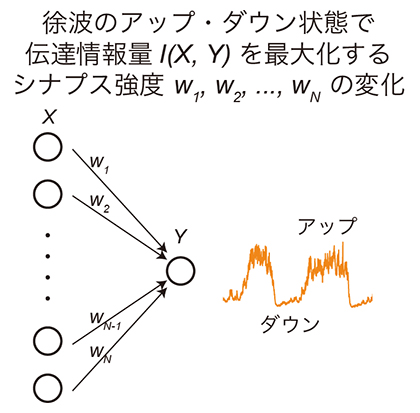 医療・健康
医療・健康 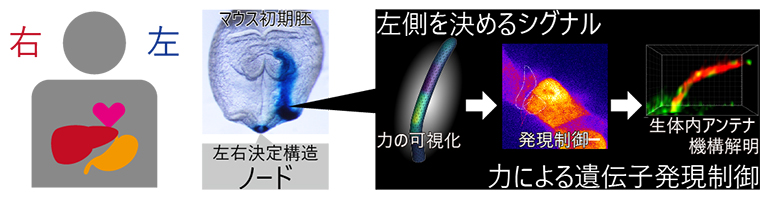 生物化学工学
生物化学工学 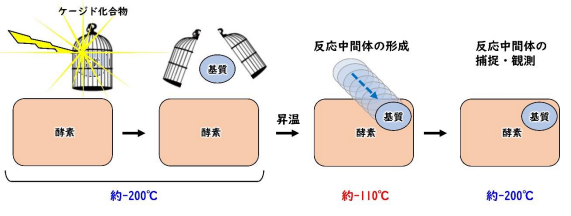 生物工学一般
生物工学一般 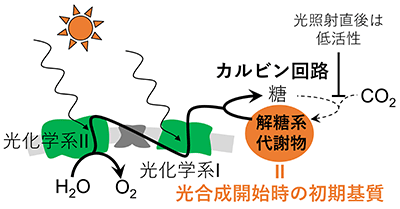 生物化学工学
生物化学工学 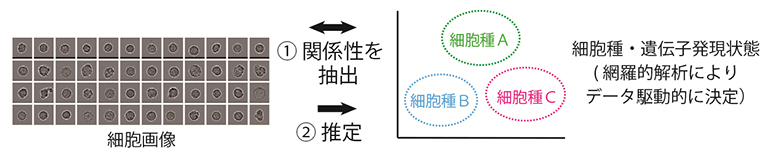 細胞遺伝子工学
細胞遺伝子工学 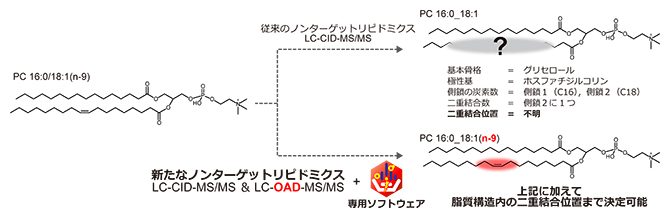 有機化学・薬学
有機化学・薬学  有機化学・薬学
有機化学・薬学