2022-06-14 東京大学,神奈川県立産業技術総合研究所,理化学研究所,東京都立大学,科学技術振興機構
発表者
桑﨑 勇人(東京大学 大学院総合文化研究科 広域科学専攻 大学院生(研究当時))
山本 翔太(東京大学 大学院総合文化研究科 広域科学専攻 特別研究員(研究当時))
小田部 尭広(東京大学 大学院総合文化研究科 広域科学専攻 特任研究員(研究当時))
中嶋 隆浩(神奈川県立産業技術総合研究所 常勤研究員)
清水 義宏(理化学研究所 生命機能科学研究センター 無細胞タンパク質合成研究チーム チームリーダー)
成川 礼(東京都立大学 大学院理学研究科 生命科学専攻 准教授)
矢澤 真幸(コロンビア大学 リハビリテーション再生医療学科・薬理学科 助教授)
佐藤 守俊(東京大学 大学院総合文化研究科 広域科学専攻 教授)
発表のポイント
- 生命現象を赤色光でコントロールできる基盤技術を開発。
- 具体的には、赤色光による遺伝子発現とDNA組換え反応の光操作を実現。
- 生体深部における生体分子や遺伝子の機能解明への展開に期待。
発表概要
東京大学大学院総合文化研究科の桑﨑勇人大学院生(研究当時)と佐藤守俊教授は、同研究科の山本翔太研究員(研究当時)、小田部尭広研究員(研究当時)、神奈川県立産業技術総合研究所の中嶋隆浩研究員、および理化学研究所生命機能科学研究センターの清水義宏チームリーダー、東京都立大学大学院理学研究科の成川礼准教授、コロンビア大学リハビリテーション再生医療学科・薬理学科の矢澤真幸助教授らとの共同研究により、生体組織透過性が極めて高い赤色光で生体深部の生命現象を操作できる光スイッチタンパク質(MagRed:マグレッド)の開発に成功しました。光スイッチタンパク質は、細胞内や生体内のさまざまな生体分子の機能を光で操作するための基盤技術となるツールです。赤色光による光スイッチタンパク質は既にいくつか報告されていましたが、哺乳類には無い色素の添加を要する点や光制御能が著しく低い点、汎用性が無い点など、大きな課題が残されていました。本研究で開発したMagRedは、外来性の色素の添加を必要とせず、赤色光のON・OFFのみで極めて高い制御能を有するとともに、その高い汎用性により、遺伝子発現やDNA組換え反応の光操作を実現しました。この新しい赤色光スイッチタンパク質は、生命現象の光操作の応用可能性を大きく広げることが期待されます。
本研究成果は、英国科学誌「Nature Biotechnology」(オンライン版:6月13日(英国夏時間))に掲載されました。
本研究成果は、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業(CREST)「光の特性を活用した生命機能の時空間制御技術の開発と応用」(研究総括:影山龍一郎 理化学研究所脳神経科学研究センター センター長)における「ゲノムの光操作技術の開発と生命現象解明への応用」(研究代表者:佐藤守俊、課題番号:JPMJCR1653)、神奈川県立産業技術総合研究所(KISTEC)の戦略的研究シーズ育成事業(研究代表者:佐藤守俊)、UTEC-UTokyo FSI Research Grant Program(研究代表者:佐藤守俊)、日本学術振興会(JSPS)特別研究員DC2(研究代表者:桑﨑勇人、課題番号:JP20J14492)の一環として得られました。
発表詳細
研究背景
近年、生命現象や疾患において重要な役割を果たす遺伝子や生体分子を光で自由自在に操作できる技術に関心が持たれています。特に、「生体の窓(注1)」と呼ばれる波長領域(650~800 nm)に相当する赤色光は生体組織に吸収されにくく、生体深部にまで届きやすいため、赤色光による光操作技術の開発が期待されています。先行技術が既にいくつか報告されてきましたが、いずれも汎用性や一般性が無く、光照射に関係なく作動してしまうため光制御能が著しく低いといった課題や、哺乳類には無い光合成生物由来の色素の添加が必要といった不便さを抱えていました。このような背景から、既存の技術の問題を克服できる、新たな赤色光による光操作基盤技術の開発が強く求められていました。
研究内容
本研究グループは、さまざまなバクテリアが持つ赤色光受容体タンパク質のバクテリオフィトクロム(BphP)(注2)の中で、特に放射線抵抗性細菌(Deinococcus radiodurans)が有するBphP(DrBphP)に着目しました。DrBphPは哺乳類細胞に内在する色素のビリベルジン(BV、注3)を補因子として結合し、赤色光(~ 660 nm)に応答して構造が大きく変化する性質を持っています。このDrBphPの構造変化を認識して結合するタンパク質(以下、バインダー)を開発することで、赤色光スイッチタンパク質を開発できると考えました(図1)。抗体様分子であるアフィボディ(注4)の変異体ライブラリを作製し、リボソームディスプレイ法(注5)を用いて、赤色光を照射した条件でのみDrBphPと結合するアフィボディをバインダー候補として単離しました。この進化分子工学的アプローチ(注6)で得られたバインダー候補に対してアミノ酸変異や末端のアミノ酸の削除といった改変を加えることで、赤色光照射時の結合効率を改善したバインダーの開発に成功しました。このDrBphPとアフィボディ(バインダー)からなる光スイッチタンパク質は、本研究グループが以前開発した青色光スイッチタンパク質“Magnet”(マグネット、注7)の赤色バージョンという意味を込めて“MagRed”(マグレッド)と名付けました(図1)。
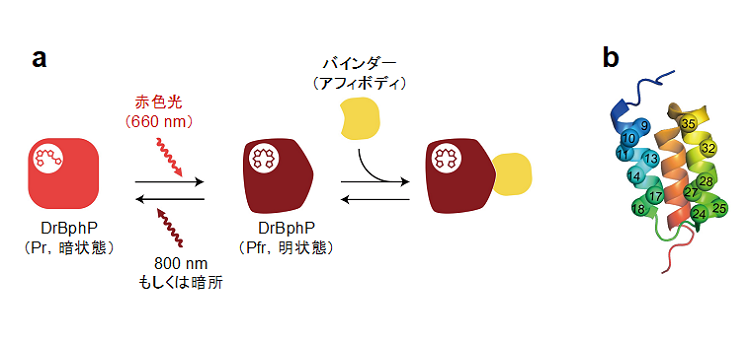
図1.本研究で開発した赤色光スイッチタンパク質“MagRed”(マグレッド)。
(a)MagRedは放射線抵抗性細菌(Deinococcus radiodurans)が持つ赤色光受容体(DrBphP)とその結合タンパク質(アフィボディ)からなる。DrBphP(Pr型、暗状態)は赤色光(~ 660 nm)を吸収すると構造変化してPfr型(明状態)となりアフィボディと結合する。ここで800 nmの光を照射することや、暗環境下に放置することで、DrBphPが元の構造(Pr型、暗状態)に戻り、アフィボディは解離する。
(b)抗体様分子のアフィボディの構造。αヘリックスの表面を構成する13個のアミノ酸は可変なので、これを改変することで抗原特異的なアフィボディを開発することができる。本研究では、進化分子工学的アプローチ等を駆使して、赤色光(~ 660 nm)を吸収したDrBphPに特異的に結合するアフィボディを開発した。
次に、遺伝子発現の光操作技術(CPTS)(注8)へのMagRedの応用を検討しました(図2)。CPTSは本研究グループが以前、青色光スイッチタンパク質とCRISPR-Cas9システム(注9)を用いて報告した遺伝子発現の光操作技術です。他の研究グループから報告された2つの赤色光スイッチタンパク質(RpBphP1-PpsR2、RpBphP1-QPAS1)をCPTSへ応用すると、いずれも暗環境下であるにもかかわらず高い遺伝子発現活性が検出されました(図3)。このことから、既存の赤色光スイッチタンパク質では光制御能が著しく低いことがわかりました。一方、MagRedを用いたCPTS(Red-CPTS)では、暗環境下での活性がほとんど検出されず、赤色光照射で効率良く遺伝子発現を誘導できることから、MagRedが極めて高い光制御能を有することがわかりました(図3)。またRed-CPTSを用いることで、赤色光照射によってゲノムにコードされた複数の内在性遺伝子でも同時に活性化することに成功しました(赤色光照射によって内在性遺伝子の発現を最大で378倍活性化)。
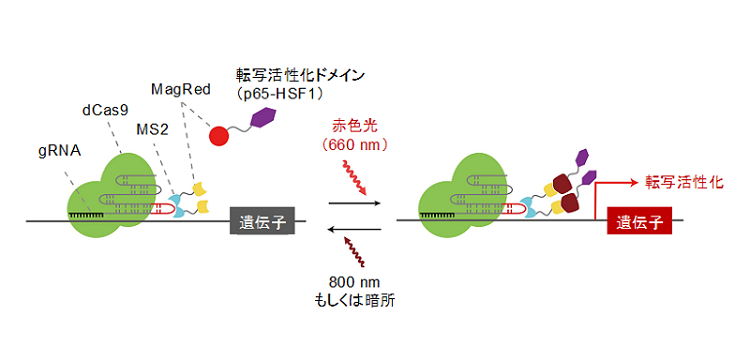
図2.MagRedを用いて開発した赤色光による遺伝子発現の光操作技術“Red-CPTS”。ゲノム上の狙った遺伝子の発現を操作するために、変異を加えてDNA切断活性を失わせたCas9(dCas9)を用いる。dCas9をDNAに結合させるための案内役となるガイドRNAとして、MS2 RNA アプタマーを挿入したものを用いる。MS2タンパク質と転写活性化ドメイン(p65-HSF1)にはMagRedを連結しておく。赤色光を照射するとMagRedが結合し、dCas9が結合している遺伝子領域に転写活性化ドメインが呼び寄せられるため、当該遺伝子の発現を狙って活性化できる。
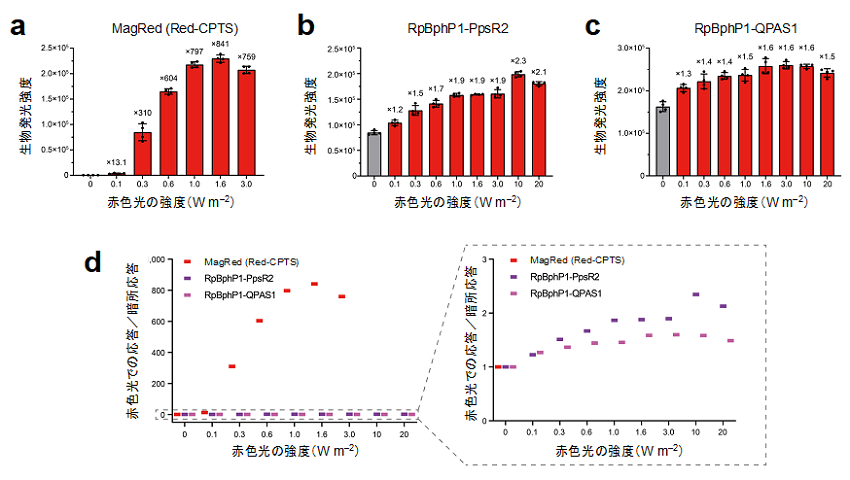
図3.既存の赤色光スイッチタンパク質との比較。
(a)MagRedを用いたRed-CPTSは暗環境下ではほとんど遺伝子発現活性を持たず、赤色光の照射強度に応答して高い遺伝子発現活性を示すことを生物発光レポーターを用いて示した。
(b, c)MagRedの代わりに既存の赤色光スイッチタンパク質(b:RpBphP1-PpsR2、c:RpBphP1-QPAS1)を用いて遺伝子発現の光操作技術を構築すると、いずれも暗環境下で高い遺伝子発現活性を示し、赤色光に対する応答性が著しく低いことがわかった。
(d)a, b, cの赤色光照射時の応答をそれぞれの暗環境下での応答で規格化した。MagRedは既存の赤色光スイッチタンパク質よりも光制御能が著しく高いことがわかる。
さらに、MagRedを用いた赤色光によるDNA組換え反応の光操作技術への応用も検討しました。DNA組換え反応を触媒するCreリコンビナーゼ(注10)は、狙った遺伝子の塩基配列をゲノムからノックアウト(削除)するための酵素として世界中の研究室で広く利用されています。そこでCreリコンビナーゼを2つに分割して不活性化し、この分割体(split-Cre)にMagRedを連結することで、暗環境下ではDNA組換え活性を持たず、赤色光照射によって高い活性が出現するDNA組換え酵素(RedPA-Cre)を開発しました(図4)。赤色光で制御する4種類の従来技術と今回開発したRedPA-Creを比較したところ、RedPA-Creの方がはるかに効率良くDNA組換え反応を光操作できることがわかりました(赤色光と暗環境下での応答の比率を比べると、RedPA-Creは既存の技術よりも27倍から46倍効率良くDNA組換え反応を操作できました)。さらに、RedPA-Creと上述のRed-CPTSをそれぞれマウスの肝臓に導入し、生体外から非侵襲的に赤色光を照射することで、いずれも当該臓器において遺伝子の働きを効率良く操作できることを明らかにしました(図5、図6)。
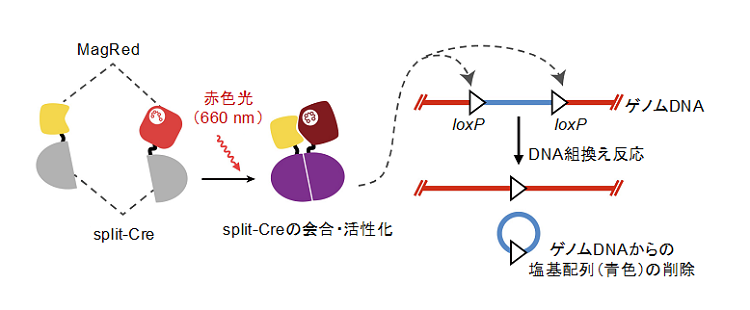
図4.MagRedを用いて開発した赤色光によるDNA組換え反応の光操作技術“RedPA-Cre”。Creリコンビナーゼを2つに分割・不活性化して作製したsplit-CreにMagRedを連結することで、赤色によって会合し、DNA組換え活性が出現する酵素(RedPA-Cre)を開発した。赤色光で活性化したRedPA-Creは、loxPと呼ばれる34塩基の配列で挟まれた塩基配列(遺伝子など)をゲノムから削除することができる。このDNA組換え反応を使って、赤色光で狙って遺伝子をノックアウトすることや、遺伝子を活性化することが可能になった。
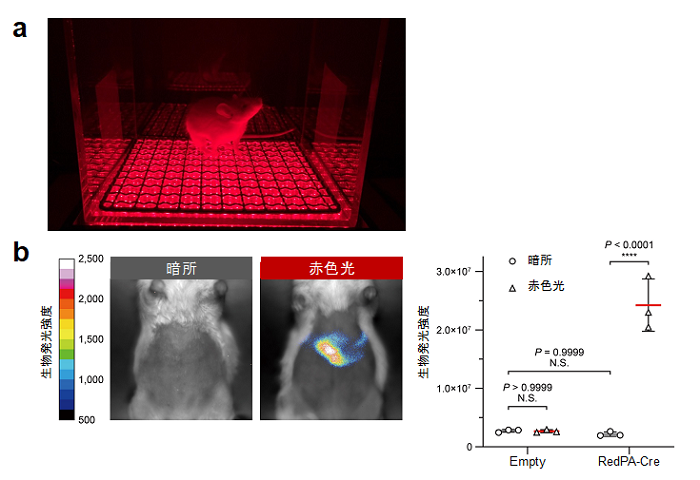
図5.RedPA-Creを用いて、マウスの生体深部(肝臓)でDNA組換え反応を光操作。
(a)LEDでマウスの生体外から非侵襲的に赤色光を照射している様子。
(b)肝臓にRedPA-Creと生物発光レポーター(活性化したRedPA-Creと反応し、生物発光を生起するレポーター)を導入したマウスは、生体外からの赤色光照射によって肝臓からの生物発光シグナルが観察された。この結果は、生体外からの光照射であってもマウスの生体深部において、RedPA-Creが高い効率でDNA組換え反応を誘導できることを示している。図中の「P」はP値を示す。「N.S.」は有意差が無いことを示す。
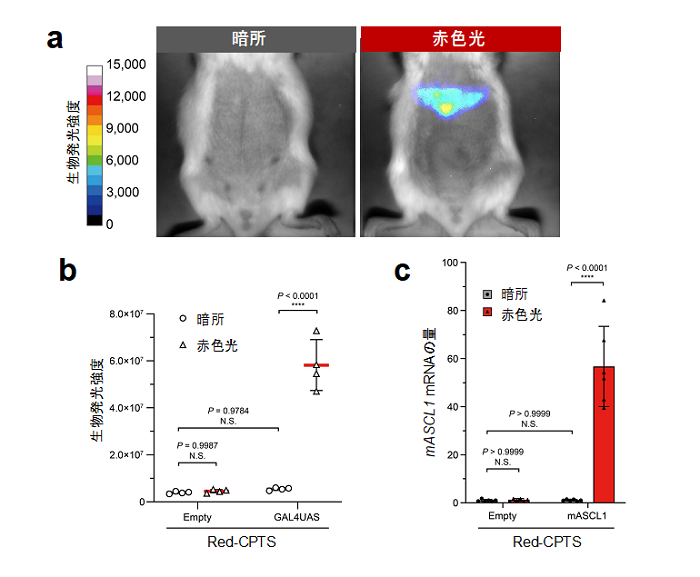
図6.Red-CPTSを用いて、マウスの生体深部(肝臓)で遺伝子の発現を光操作。
(a)肝臓にRed-CPTSと生物発光レポーター(GAL4UAS:活性化したRed-CPTSと反応し、生物発光を生起するレポーター)を導入したマウスは暗環境下では生物発光シグナルを示さないが、生体外から非侵襲的に赤色光を照射すると当該マウスの肝臓から生物発光シグナルが観察された。
(b)(a)の実験で得られた画像データを数値データとして示し、統計的処理を加えた。生物発光レポーター(GAL4UAS)の代わりに空のベクター(Empty)を用いたコントロール実験の結果も示す。暗環境下での生物発光シグナルとコントロール実験の生物発光シグナルに有意差がないことから、Red-CPTSには暗環境下での活性がほとんどなく、マウスの生体(in vivo)でも高い光制御能を有することが示された。
(c)Red-CPTSを用いてマウスの肝臓のゲノムにコードされた内在性遺伝子(mASCL1を例に)の発現を生体外からの非侵襲的な赤色光照射で光操作できることを示した。
上述のように本研究グループは、赤色光による生命現象の光操作の基盤技術(プラットホーム・テクノロジー)として、赤色光に応答する光スイッチタンパク質“MagRed”を開発するとともに、MagRedを応用した遺伝子発現の光操作技術“Red-CPTS”とDNA組換え反応の光操作技術“RedPA-Cre”の開発に成功しました。本成果は、生体深部における生命現象の解明や、遺伝子疾患や細胞治療など生命科学・医学分野を含む幅広い研究分野において役立つことが期待されます。
問い合わせ先
<研究に関すること>
東京大学 大学院総合文化研究科
教授 佐藤 守俊(さとう もりとし)
理化学研究所 生命機能科学研究センター 無細胞タンパク質合成研究チーム
チームリーダー 清水 義宏(しみず よしひろ)
東京都立大学 大学院理学研究科 生命科学専攻
准教授 成川 礼(なりかわ れい)
<JST事業に関すること>
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
保田 睦子(やすだ むつこ)
<KISTEC事業に関すること>
神奈川県立産業技術総合研究所
研究開発部 地域イノベーション推進課 地域イノベーション推進グループ
滝元 宏治(たきもと こうじ)
<報道に関すること>
東京大学 教養学部等総務課 広報・情報企画チーム
理化学研究所 広報室 報道担当
東京都公立大学法人
東京都立大学管理部 企画広報課 広報係
科学技術振興機構 広報課
用語解説
(注1)生体組織において光を吸収する主な物質はヘモグロビンと水である。ヘモグロビンは650 nmよりも短波長の光に対し強い吸収を持ち、水は800 nmよりも長波長の光に対し強い吸収を持つ。ヘモグロビンと水の吸収が弱い650~800 nmの波長領域は、生体組織に対する光の透過性が非常に高いため「生体の窓」と呼ばれる。
(注2)バクテリオフィトクロム(BphP)はバクテリアに保存されているフィトクロム様光受容タンパク質。光を吸収するための補因子として、哺乳類細胞に内在する色素のビリベルジン(BV)を結合する。BphP はPr型(暗状態)とPfr型(明状態)という2つの構造を持ち、Pr型が赤色光を吸収するとPfr型に変化する。Pfr型は赤色光よりもさらに長波長の光を照射することや、暗環境下に放置することでPr型に戻る。Pr型とPfr型の間の構造変化(光変換)は可逆的である。
(注3)開環テトラピロールのビリベルジン(BV)はヘムの代謝産物であり、BphPのCys残基に共有結合する。赤色光の照射によりBVのC15位とC16位の間の二重結合にZ/E異性化が起こるとBphP の構造変化(Pr型/Pfr型)が起こる。
(注4)アフィボディは、黄色ブドウ球菌のプロテインAのZドメインに由来する58アミノ酸からなる小さなタンパク質。αヘリックスの表面を構成する13個のアミノ酸は可変なので、これを改変することで、さまざまなタンパク質に特異的に結合するアフィボディを開発できる。
(注5)リボソームディスプレイ法は、ランダムなアミノ酸配列のペプチドから有用な配列の分子を選別する手法の1つ。ペプチド-リボソーム-mRNA複合体を用いて、標的分子に対する親和性の高い複合体を回収し、そのmRNAを逆転写PCRすることで親和性の高いペプチドだけを増幅できる。本研究では、上述したアフィボディの13個のアミノ酸にランダム変異を導入した変異体ライブラリを作製し、赤色光を吸収したDrBphPに特異的に結合するアフィボディを単離した。
(注6)進化分子工学的アプローチとは、地球上で行われてきた突然変異と淘汰(選別)の繰り返しによる生物の進化のサイクルを、試験管の中で実験的に早回しで再現し、分子(タンパク質など)の機能に改良を加えていく研究アプローチを指す。選別の方法を工夫することで、求める機能に最も適した変異体を選び出して改良する「指向性進化(directed evolution)」が可能になる。
(注7)Magnetは、アカパンカビ(Neurospora crassa)が有する青色光受容体(Vivid)に対して多角的にプロテインエンジニアリングを施して開発された2つのタンパク質(pMagとnMag)のペア。pMagとnMagは暗所などの青色光非存在下の状況では、それぞれ単量体として存在する。青色光を受容すると、互いに結合する。本研究グループにより開発・報告された(Nat. Commun. 6, 6256 (2015). doi: 10.1038/ncomms7256)。
(注8)CPTS(CRISPR-Cas9-based photoactivatable transcription system)は、切断活性を欠失したCas9(dCas9)、標的遺伝子の上流にdCas9が結合するように設計されたgRNA、光スイッチタンパク質、転写活性化ドメインから構成される。光照射によって転写活性化ドメインが標的遺伝子上流に引き寄せられ、標的遺伝子の転写を活性化することができる。本研究グループにより開発・報告された(Nat. Methods. 14, 963-966 (2017). doi: 10.1038/nmeth.4430)。
(注9)CRISPR-Cas9システムは、バクテリオファージに対する原核生物の免疫システムとして発見され、現在はゲノムの切断を人為的に行うためのゲノム編集技術として利用されている。Cas9と呼ばれるDNA切断酵素がガイドRNA(gRNA)とともにDNAに結合し、そのDNA配列を部位特異的に切断する。ガイドRNAの5’末端の塩基配列(20塩基程度)を適切に設計するだけで、ゲノムの切断部位を決定できるメリットを持つ。
(注10)Creリコンビナーゼはバクテリオファージから発見された酵素で、loxPと呼ばれる34塩基対からなるDNA配列を認識してDNA組換え反応を触媒する。任意のDNA配列(遺伝子など)を2つのloxP配列で挟むことで、そのDNA配列をゲノム上からノックアウト(削除)できる。また、転写終結配列(poly Aなど)を除去することや、標的遺伝子を反転させることによって、標的遺伝子の発現(オン・オフ)をコントロールすることも可能である。
論文情報
Yuto Kuwasaki, Kazushi Suzuki, Gaigai Yu, Shota Yamamoto, Takahiro Otabe, Yuki Kakihara, Michiru Nishiwaki, Keita Miyake, Keiji Fushimi, Ramsey Bekdash, Yoshihiro Shimizu, Rei Narikawa, Takahiro Nakajima, Masayuki Yazawa, Moritoshi Sato*, “A red light–responsive photoswitch for deep tissue optogenetics,” Nature Biotechnology: 2022年6月13日, doi:10.1038/s41587-022-01351-w.
論文へのリンク (掲載誌)