二次性がんが生じにくい治療法の開発や発がんリスク予測への応用を期待
2022-08-04 国立がん研究センター
発表のポイント
- 今回、通常のDNA検体を用いて安価に、超低頻度の突然変異を正確に定量する技術「EcoSeq(Enzymatically Cleaved and Optimal Sequencing)」法を開発しました。「EcoSeq」法では、一千万塩基対に1個という超低頻度の突然変異*1でも定量可能でした。
- 「EcoSeq」法で小児肉腫患者の血液細胞を解析した結果、抗がん剤治療後の血液細胞では治療前に比べて突然変異の蓄積が増加していること、その蓄積は抗がん剤治療終了後1年以上経過しても残存しており、骨髄の細胞に誘発された点突然変異であることが示唆されました。
- 今後、殺細胞性の抗がん剤使用による二次性白血病の発症リスクの予測や、変異が蓄積しにくい治療薬の開発が可能になると考えられます。また、大人でも正常に見える組織を解析することで発がんリスクを予測できるようになることが期待されます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)は、正常に見える組織に蓄積した超低頻度の遺伝子の突然変異を正確に測定する方法を新規に開発し、小児肉腫患者の末梢血において、抗がん剤治療後に正常に見える血液細胞でも微量ながら遺伝子の突然変異が蓄積することを明らかにしました。
本研究で新規測定法が開発され、二次性白血病の発症機構と考えられる突然変異の蓄積が確認されたことにより、今後、二次性白血病が生じるリスクの予測や、抗がん剤治療後に突然変異が蓄積しにくい治療法の開発が期待されます。本研究は、国立がん研究センター研究所 エピゲノム解析分野長牛島俊和(当時、現在:星薬科大学 学長)と中央病院 小児腫瘍科 小川千登世ら研究チームにより行われたもので、研究成果は、国際総合学術雑誌「Proceedings of the National Academy of Sciences of the United States of America(PNAS)」に7月27日に掲載されました。
背景
正常な組織にも遺伝子の突然変異が存在し、発がんリスクや発がん物質曝露と関係
がんは遺伝子の突然変異やエピゲノム異常(DNAメチル化異常)*2などが、細胞分裂後も消えずに、細胞の増殖や分化を制御する遺伝子が異常に働くことや、逆に働かなくなる(ドライバー変異)ことで発生します。近年のがんゲノム解析(がん組織を次世代シークエンス解析すること)で、多くのドライバー変異が見つかりました。同時に、細胞の性質を直接変化させない、たまたま、見つかってくる突然変異(パッセンジャー変異)も、非常に多数見つかりました。
また近年は、がん組織ではなく、正常な組織での突然変異の解析も行われるようになり、がん患者さんの正常に見える組織には既に微量の突然変異が存在することが明らかになってきました。微量ながら、蓄積した突然変異の量と発がんリスクとが関連したり、突然変異のパターンを見ると喫煙歴や発がん物質への曝露と関連したりすることが分かり始めています。
正常組織での突然変異は検出が困難
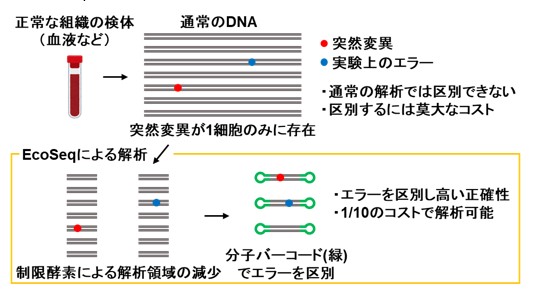
しかし、正常組織での遺伝子の突然変異の検出は実は難しいものです。がんはもともと1個の細胞が増殖したもので、がん細胞には1種類の細胞(クローン)しかありません。つまり、ある突然変異が存在する場合は、原則、全てのがん細胞に存在します。従って、がん組織のDNAを解析すると、同じ突然変異が多くのDNA分子に共通して存在します。一方で、次世代シークエンス技術を用いた研究の際に避けられない実験上のエラー(PCR時のエラー、シークエンスの際のエラー)による偽の突然変異はごく一部のDNA分子にしか存在しません。従って、本当の突然変異と実験上のエラーとは容易に区別できます。
一方、正常組織は、もともと、106を超える多数の種類の細胞(クローン)からなり、そのうちの1種類に突然変異が入ります。その場合、本当の突然変異と実験上のエラーによる偽の突然変異との区別が極めて困難になります。この問題を解決するために、これまで、解析する細胞の種類を少なくする方法や、実験上のエラーを少なくする方法が開発されてきました。しかし、多数の検体を解析する際に重要となる「DNAでの解析」「低コスト」という条件を満たす方法はなく、特別な方法で準備した検体と莫大な解析費用が必要でした。
研究内容
新規の低コストな超低頻度突然変異定量法「EcoSeq」を開発
本研究では、上記の課題を克服して、正常な組織に蓄積する超低頻度な遺伝子の突然変異を正確に見つけるために、新しい遺伝子解析方法「EcoSeq(エコセック:Enzymatically Cleaved and Optimal Sequencing)」を開発しました。この解析方法は、DNAの一個一個の分子を分子バーコードにより区別し、低頻度な変異と実験上のエラーを区別する技術(Duplex sequencing; 図1)を改良してヒト検体にも応用可能としたもので、107塩基対に1個という超低頻度の突然変異(DNA上のA, G, C, Tの文字列のうち、1文字だけ変化する点突然変異)でも定量可能です。解析するゲノム領域を制限酵素によって大幅に減らし、数が多いパッセンジャー変異に着目することで、次世代シークエンスのコストを1 /10とし(図2)、また、DNAさえあれば解析可能なため既存の検体の活用範囲も大きく広がります。
「EcoSeq」を用いて抗がん剤治療による突然変異増加を小児がんで確認
従来より使用される殺細胞性の抗がん剤の多くは、がん細胞を死滅させる代わりに、正常な細胞に突然変異を誘発します。これらの抗がん剤は現在のがんを治すメリットの方が、突然変異誘発による将来のがんの危険のデメリットを大きく上回るために広く使われ、治療に不可欠になっています。同時に、小児がん患者さんなどでは、抗がん剤で最初のがんは治癒しても、抗がん剤の影響と思われる二次性白血病が将来発生する可能性があり、抗がん剤治療を受けない場合と比較し3-6倍に達します。その仕組みとして、抗がん剤治療により、白血病のもととなる骨髄の細胞に突然変異が誘発されるであろうことは推測されてきましたが、証明はされていませんでした。
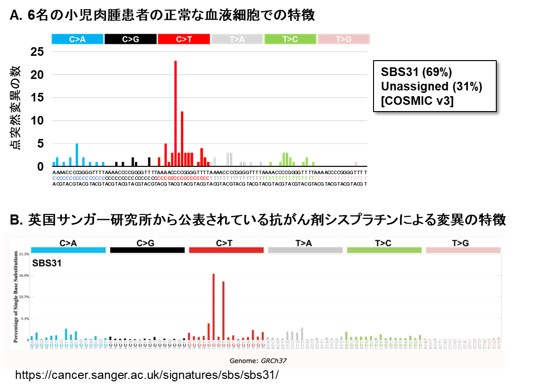
そこで、「EcoSeq」を用いて、抗がん剤治療を受けた小児肉腫患者10名と別の未治療の小児肉腫患者10名について、正常の血液細胞に蓄積した点突然変異を解析しました。その結果、抗がん剤治療を受けた患者の血液細胞に、より多くの点突然変異が蓄積していることが明らかになりました。さらに抗がん剤治療を受けた小児肉腫患者6名について、抗がん剤治療前と治療後1年以上経過した時点での正常の血液細胞を解析したところ、6名全員が抗がん剤治療後により多くの点突然変異蓄積を示すようになり、治療後1年以上経過してもその蓄積が維持されていたことが分かりました(図3)。また、治療後の血液細胞で見つかった変異の特徴は、一般的な殺細胞性の抗がん剤で起こりやすい点突然変異の特徴とも一致していました(図4)。抗がん剤治療によって何らかの遺伝子変異が正常な組織にも蓄積していることは予想されていましたが、実際に二次がん発症前の正常な組織(血液細胞)でその蓄積を証明したのは世界で初めての報告です。
今後の展望
今回、新規に開発した「EcoSeq」を用いることで、正常な組織における超低頻度な遺伝子変異の蓄積を、通常の検体処理で得られたDNAを用いて比較的安価に解析することが可能になりました。また「EcoSeq」での小児の血液細胞を解析した結果、抗がん剤によって正常な血液細胞に低頻度な遺伝子変異が蓄積している発症機構が実証されました。
これらの研究成果より、以下のことが今後期待されます。
抗がん剤治療後の正常な血液細胞を解析することで、将来の二次性白血病が生じるリスクの予測や二次性がんが生じにくい治療薬の開発が期待される。
より多くの患者さんについて正常な血液細胞の解析を行うことで、抗がん剤によって蓄積する低頻度な遺伝子変異の量と二次性白血病発症との関連が明らかになれば、治療後に採血検査を行うことで、二次性白血病が発生する可能性を予測することが可能になります。また、2種類の治療法が同程度の治療効果の場合には遺伝子変異が蓄積しにくい方の治療法を選択するといったことが可能になります。また、変異が蓄積しにくい治療薬の開発にもつながることが期待されます。
血液以外の臓器でも、正常な組織を解析することで、将来の発がんリスク予測が可能になることが期待される。
大人でも、喫煙などにより正常に見える組織に既に微量の突然変異が蓄積していることが分かっています。例えば、喫煙や飲酒による肺や消化管の正常な組織への低頻度な遺伝子変異の蓄積量を解析することで、より高い精度での発がんリスクの予測が可能になることが期待されます。
発表論文
雑誌名:
Proceedings of the National Academy of Sciences of the United States of America (PNAS)
タイトル:
A quantification method of somatic mutations in normal tissues and their accumulation in pediatric patients with chemotherapy
著者名:
Sho Ueda, Satoshi Yamashita, Miho Nakajima, Tadashi Kumamoto, Chitose Ogawa, Yu-yu Liu, Harumi Yamada, Emi Kubo, Naoko Hattori, Hideyuki Takeshima, Mika Wakabayashi, Naoko Iida, Yuichi Shiraishi, Masayuki Noguchi, Yukio Sato, Toshikazu Ushijima
掲載日: 2022年7月27日
DOI: https://doi.org/10.1073/pnas.2123241119
本研究への支援
- 国立研究開発法人日本医療研究開発機構(AMED)
「エピゲノム不安定性の機構とAYA癌予防戦略の解明(21gm1310006)」
「ピロリ菌除菌後健康人を対象とした世界初エピゲノム発がんリスク診断の実用化(21ck0106552)」
「多能性幹細胞利用再生医療での造腫瘍性とがん関連ゲノム異常の関連にかかる規制科学的検討(21bk0104097)」
- 日本学術振興会科学研究費補助金(科研費)
「エピゲノム合成致死創薬の開発:個別サイレンシングと構造異常の両面から(21H02773)」
「線形&非線形分離を考慮したデータマインニングによる新規バイオマーカー同定法の確立(19K07744)」
「ヒト正常組織での変異シグネチャー解析実現による個人別発がん要因特定(19K07745)」
報道関係からのお問い合わせ先
研究に関するお問い合わせ先
学校法人星薬科大学
学長 牛島俊和
機関窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
図表
図1 Duplex Sequencing法
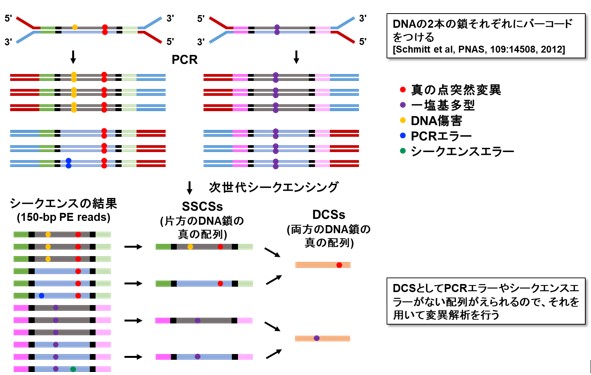
図2 EcoSeq法の特徴
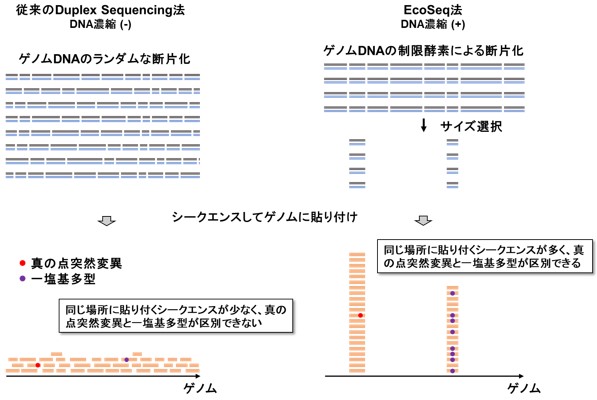
図3 がん化学療法後の正常に見える血液細胞での突然変異の増加
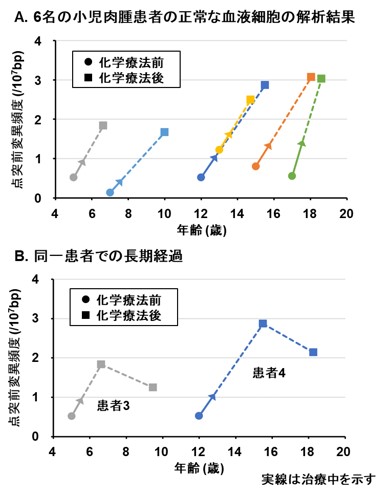
図4 点突然変異の特徴
付図 EcoSeqの概念の簡略図
用語の解説
*1突然変異と点突然変異
突然変異とは、DNA上のA, G, C, Tの文字列が正常な並び方から変化してしまう変化を指します。1文字だけ変化する場合(点突然変異)に加え、何十文字とか何万文字まとめて変化する場合(欠失や挿入)もあります。点突然変異の場合、その結果、作られるタンパク質の機能が大きく変化する場合があることから、発がんに重要とされます。遺伝子の欠失ではその遺伝子の機能が低下し、挿入では増強します。
*2エピゲノム異常(DNAメチル化異常)
細胞増殖を抑えてがん化を抑制する遺伝子(がん抑制遺伝子)の機能がなくなることが、がん化に重要であると知られています。遺伝子の機能をなくす仕組みとして、上述の遺伝子の欠失は点突然変異に加えて、その遺伝子のスイッチオン・オフを決めているエピゲノム制御の異常も知られています。エピゲノム制御の中でも、DNAメチル化による制御は主要なもので、その異常は、突然変異同様に、一度おこると通常はもとには戻らないことが知られています。