2022-09-30 フランクフルト大学
フランクフルトの研究チームは、X線構造解析を用いて、MHC I分子にどのようにペプチドが結合し、どのようにペプチドが選択されるのかを明らかにすることに成功した。
研究チームは、細胞がどのようにしてタンパク質断片またはペプチドを選択するのかを明らかにした。
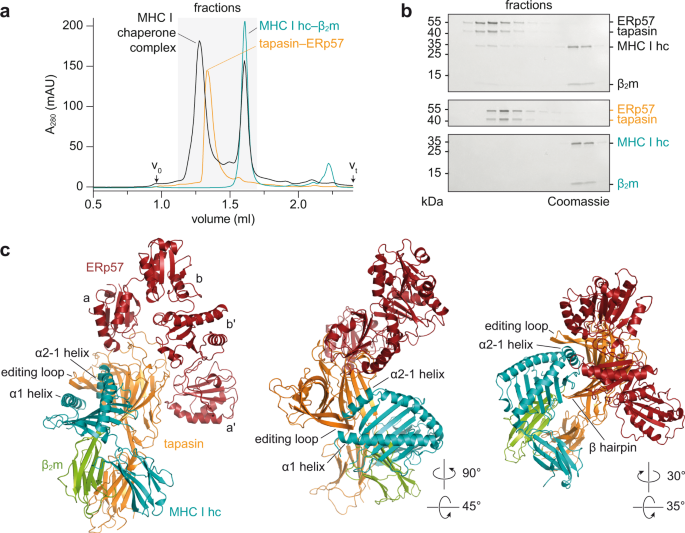
X線構造解析によって、シャペロンとMHC I分子の短時間の相互作用を可視化することに初めて成功した。
この研究では、膜に埋め込まれていない2つの相互作用パートナーの変異体を作り、それらを精製して結合させた。まず、MHC I分子に高親和性ペプチドを結合させ、安定した複合体を形成させた。次に、光信号によってペプチドを切断すると、MHC I分子と結合する能力が大幅に低下した。すると、すぐにタパシンが登場し、ペプチドを欠いたMHC I分子に結合したままになっていた。
結晶のX線構造解析により、タパシンがMHC I分子のペプチド結合ポケットを広げ、それによってペプチド結合の強さを試している様子が明らかになった。
1つのシャペロンが多様性に富むMHC I分子とどのように相互作用するのかも明らかになった。
<関連情報>
- https://aktuelles.uni-frankfurt.de/englisch/x-ray-structure-analysis-shows-how-mhc-i-molecules-are-prepared-for-peptide-loading/
- https://www.nature.com/articles/s41467-022-32841-9
MHC I-tapasin-ERp57編集複合体の構造から、シャペロンのプロミスキューティを明らかにする Structure of an MHC I–tapasin–ERp57 editing complex defines chaperone promiscuity
Ines Katharina Müller,Christian Winter,Christoph Thomas,Robbert M. Spaapen,Simon Trowitzsch & Robert Tampé
Nature Communications Published:14 September 2022
DOI:https://doi.org/10.1038/s41467-022-32841-9
Abstract
Adaptive immunity depends on cell surface presentation of antigenic peptides by major histocompatibility complex class I (MHC I) molecules and on stringent ER quality control in the secretory pathway. The chaperone tapasin in conjunction with the oxidoreductase ERp57 is crucial for MHC I assembly and for shaping the epitope repertoire for high immunogenicity. However, how the tapasin–ERp57 complex engages MHC I clients has not yet been determined at atomic detail. Here, we present the 2.7-Å crystal structure of a tapasin–ERp57 heterodimer in complex with peptide-receptive MHC I. Our study unveils molecular details of client recognition by the multichaperone complex and highlights elements indispensable for peptide proofreading. The structure of this transient ER quality control complex provides the mechanistic basis for the selector function of tapasin and showcases how the numerous MHC I allomorphs are chaperoned during peptide loading and editing.