2022-10-25 スイス連邦工科大学ローザンヌ校(EPFL)
研究グループは、『Nature』誌に掲載された新しい研究において、STING(Stimulator of interferon genes)の活性を停止させるタンパク質を同定した。このタンパク質は、アダプタータンパク質複合体-1(AP-1)と名付けられ、STINGを小胞に封じ込める。小胞は、細胞膜を形成するのと同じ脂質二重層でできた小さな密閉されたさやのようなものである。
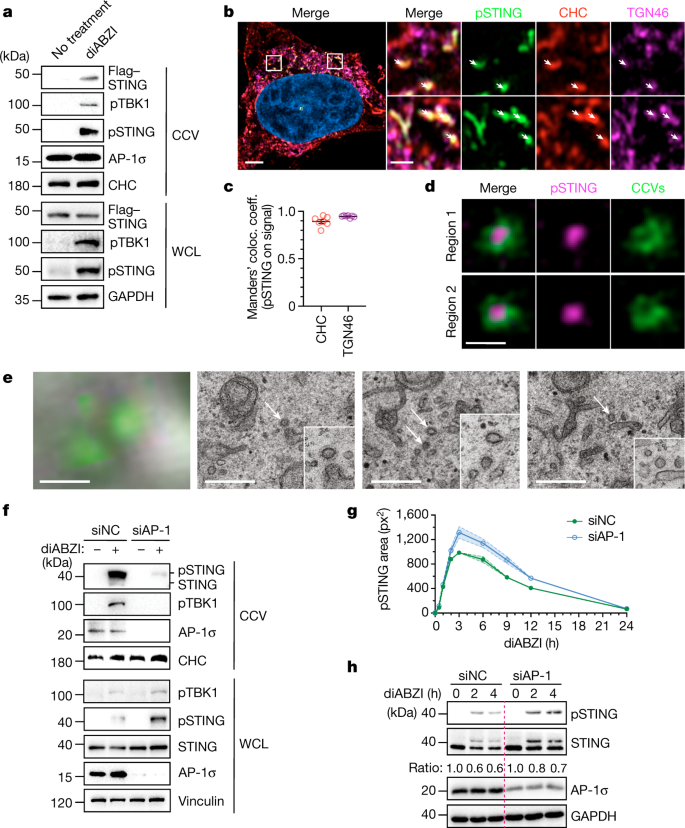
研究チームは、AP-1がSTINGタンパク質の細胞質側の末端にある特定のパターン、具体的には、AP-1をタンパク質に関与させる2つのロイシン・アミノ酸を認識することを見いだした。さらに、低温電子顕微鏡を用いてAP-1の構造を解析し、AP-1がSTINGのリン酸化を制御することで、STINGのオンとオフを切り替えていることを突き止めた。
さらに研究チームは、AP-1が抑制されると、STINGによる免疫反応が悪化することも明らかにした。
<関連情報>
- https://actu.epfl.ch/news/how-a-key-immune-protein-is-regulated-in-the-cell/
- https://www.nature.com/articles/s41586-022-05354-0
クラスリンと関連するAP-1はSTINGシグナルの終結を制御する Clathrin-associated AP-1 controls termination of STING signalling
Ying Liu,Pengbiao Xu,Sophie Rivara,Chong Liu,Jonathan Ricci,Xuefeng Ren,James H. Hurley & Andrea Ablasser
Nature Published:19 October 2022
DOI:https://doi.org/10.1038/s41586-022-05354-0
Abstract
Stimulator of interferon genes (STING) functions downstream of cyclic GMP-AMP synthase in DNA sensing or as a direct receptor for bacterial cyclic dinucleotides and small molecules to activate immunity during infection, cancer and immunotherapy1,2,3,4,5,6,7,8,9,10. Precise regulation of STING is essential to ensure balanced immune responses and prevent detrimental autoinflammation11,12,13,14,15,16. After activation, STING, a transmembrane protein, traffics from the endoplasmic reticulum to the Golgi, where its phosphorylation by the protein kinase TBK1 enables signal transduction17,18,19,20. The mechanism that ends STING signalling at the Golgi remains unknown. Here we show that adaptor protein complex 1 (AP-1) controls the termination of STING-dependent immune activation. We find that AP-1 sorts phosphorylated STING into clathrin-coated transport vesicles for delivery to the endolysosomal system, where STING is degraded21. We identify a highly conserved dileucine motif in the cytosolic C-terminal tail (CTT) of STING that, together with TBK1-dependent CTT phosphorylation, dictates the AP-1 engagement of STING. A cryo-electron microscopy structure of AP-1 in complex with phosphorylated STING explains the enhanced recognition of TBK1-activated STING. We show that suppression of AP-1 exacerbates STING-induced immune responses. Our results reveal a structural mechanism of negative regulation of STING and establish that the initiation of signalling is inextricably associated with its termination to enable transient activation of immunity.