2022-11-17 理化学研究所
理化学研究所(理研)⽣命機能科学研究センター 集積バイオデバイス研究チームの太田 亘俊 研究員、田中 陽 チームリーダー(研究当時)らの研究チームは、複数のガラスキャピラリーを組み込んだマイクロ流体デバイス[1]を用いて、数百万個の培養細胞のうち、数個~2,000個の細胞のみを化学刺激する手法を開発し、少数細胞周辺のマイクロ環境(細胞分泌物を含む細胞周辺の局所的な液体環境)の制御が可能であることを実証しました。
本研究成果は、マイクロ環境を介した細胞間相互作用の解明を促進するとともに、細胞組織分析や生物組織工学へ広く応用されると期待できます。
生体内の細胞はさまざまな物質を分泌し、細胞組織に応じたマイクロ環境を形成することが知られています。マイクロ環境はがんの発生などにも関与することから、培養細胞とマイクロ流体デバイスを用いた実験系の確立が試みられています。しかし従来の手法では、マイクロ環境の液体操作を行う際に培養中の細胞を狭い空間に閉じ込めるため、細胞の分泌物産生への影響が課題でした。
今回、研究チームは、複数のガラスキャピラリーを通じたマイクロ流体操作により、培養細胞を狭い空間に閉じ込めることなく、少数の細胞だけを化学刺激することに成功しました。また、隣接する空間に培養された同種の細胞に対して異なる化学刺激を与えると、それぞれのマイクロ環境中の細胞分泌物濃度が異なる変化を示すことも確認しました。
本研究は、科学雑誌『Analytical Chemistry』オンライン版(11月16日付:日本時間11月17日)に掲載されました。
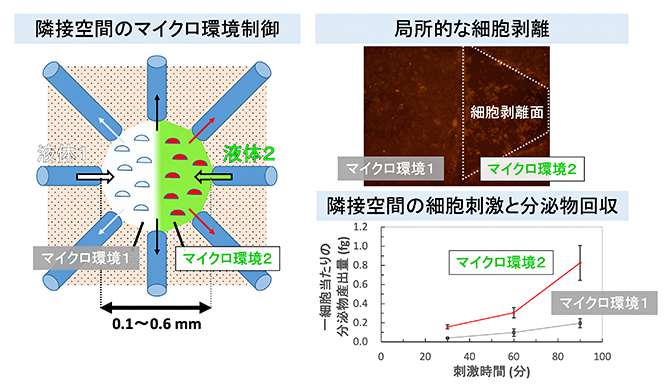
マイクロ流体操作による細胞環境の局所的な制御
背景
生物の臓器や細胞組織の高度な機能は、さまざまな細胞活動を巧妙に組み合わせることで発現します。細胞活動の一つとして、細胞分泌物による局所的な液体環境(マイクロ環境)の形成が挙げられます。細胞周辺のマイクロ環境は、1辺が1mm以下の小さな空間に集まった数十~数千程度の細胞によって生み出されます。例えば、脳組織の視交叉上核[2]の体内時計機能や、初期がん組織の周辺細胞をがん化する機能は、マイクロ環境中に存在する特異な細胞分泌物と密接な関係があると考えられています。
しかし、マイクロ環境を高精度に操作する方法は確立されていません。ピペットなどを用いた手作業では、マイクロ環境のような小さな空間の液体を高精度に取り扱うことが困難です。また、マイクロ流体を操作できる従来のマイクロ流体デバイスは、細胞に覆いかぶせるように設置するため、対象となる細胞は狭い空間に閉じ込められた状態となります。そのためデバイスを長時間使用すると、細胞の呼吸や栄養分の取り込みが妨げられ、細胞の分泌物産生に影響します。
そこで本研究では、複数のガラスキャピラリーを組み合わせることで、細胞の呼吸や栄養補給を妨げないような開放空間が維持できるマイクロ流体デバイスを作製しました。このデバイスを用いて、一様に培養された数百万個の細胞の中から数個~2,000個の細胞を選択し、その細胞付近に化学刺激を送ることで、対象細胞付近のマイクロ環境操作を試みました。
研究手法と成果
研究チームは、1辺が1mm以下の小さな領域で精度良く流体操作ができるよう、複数のガラスキャピラリーを組み込んだマイクロ流体制御用のデバイスを作製しました(図1)。このデバイスは、細胞を狭い空間に閉じ込めることなく液体操作ができるほか、デバイスに組み込むキャピラリーを簡単に交換できるため、対象とする細胞の数に応じたキャピラリーの大きさを選択し、マイクロ流体操作を行うことができます。加えて、流体の出入口を任意に選択できるため、導入流体の流れる方向や範囲を柔軟に設定することができます(図2)。
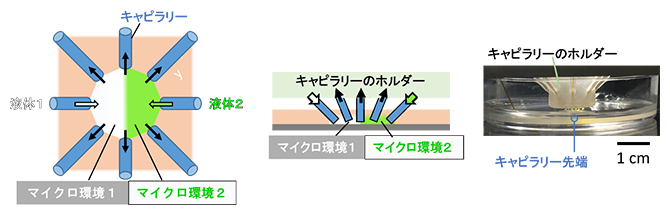
図1 ガラスキャピラリーを収束してマイクロ流体制御を行ったデバイス
左図デバイスの俯瞰図。左右のキャピラリーから内向きの矢印の方向に2種類の異なる液体を導入し、その他のキャピラリーから外向きの矢印の方向に液体を回収して、隣接する二つの領域で異なるマイクロ環境を作ることができる。
中図デバイスの断面図。
右図デバイスを細胞培養皿上に設置し、側面から撮影した写真。
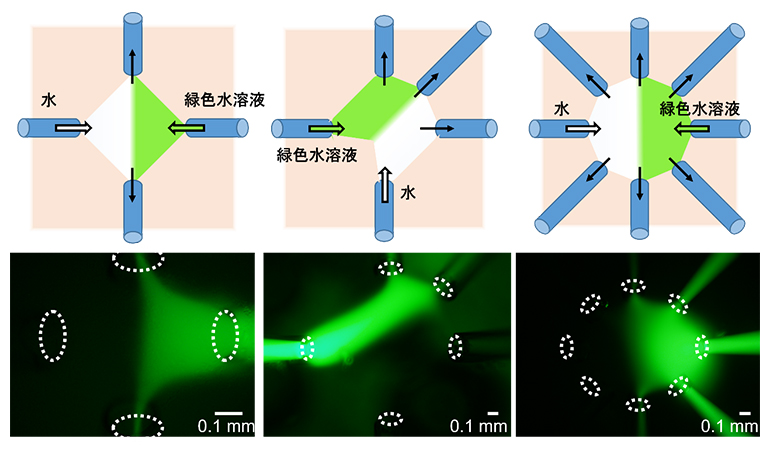
図2 デバイスによるマイクロ流体操作
流体操作に使用するキャピラリーの位置と本数によって、操作するマイクロ環境の大きさと形状が変わる。上段は液体の流入と回収方向を示したイラスト、下段は実際に流体操作を行った結果。点線の楕円はキャピラリーの先端位置を示す。(左)液体導入口2本と液体回収口2本、(中)液体導入口2本と液体回収口3本、(右)液体導入口2本と液体回収口6本のキャピラリーによる流体操作。
次に、開発したデバイスのマイクロ流体制御能力を検証するため、プラスチック製培養皿の底面を覆い尽くした状態の筋芽細胞[3]に対する化学刺激を試みました(図3)。一方のキャピラリーから細胞剥離作用を持つトリプシン[4]水溶液を導入し、対面に位置するキャピラリーからトリプシンを含まない水溶液を導入したところ、マイクロ環境中にトリプシンが導入された細胞のみ局所的に剥離し、その他の領域の細胞は培養皿に接着したままでした。さらに、キャピラリーの内径を0.04mm、トリプシン水溶液の流量を毎分10ナノリットル(nL、1nLは百万分の1mL)と小さくすることで、平均して0.0038平方ミリメートル(0.06mm×0.06mm程度の面積)の細胞のみを剥離できました。この面積は、細胞数としては10細胞以下(7.6±2.0個)に相当します。

図3 デバイスを用いた細胞剥離
左図細胞剥離時の俯瞰図。右のキャピラリーからトリプシン水溶液、左のキャピラリーからトリプシンを含まない水溶液が導入された。上下のキャピラリーから液体を回収して、隣接する二つの領域にトリプシン導入環境と非トリプシン導入環境を作る。
中図各水溶液を導入する前の赤色蛍光標識を施した細胞の写真。点線の楕円は、液体流出入に用いたキャピラリーの先端位置を示す。
右図各水溶液を導入した後の赤色蛍光標識を施した細胞の写真。局所的な細胞剥離が起きた部分は蛍光発色しないため暗く見える。
さらに、化学刺激によるマイクロ環境に含まれる細胞分泌物濃度の経時変化を観察するため、リポ多糖[5]による刺激を単球細胞[6]に対して行いました。リポ多糖は免疫細胞を活性化する作用があり、単球細胞に対しては、炎症時に多く産出されるTNFα[6]の分泌を促進します。リポ多糖刺激を受けた単球細胞のマイクロ環境中で見られたTNFα濃度は、刺激されなかった細胞のマイクロ環境中でのTNFα濃度より常に高く、濃度差は時間経過により大きくなりました(図4右上)。
また、この実験系におけるマイクロ環境中の細胞数(1,500~1,900細胞)と検出されたTNFα濃度をもとに一細胞当たりのTNFα産出量を計算すると、リポ多糖で刺激された単球細胞は、隣接環境中の刺激されなかった単球細胞に比べて、3~4倍のTNFα産出量を示しました(図4右下)。リポ多糖による刺激を受けると、単球細胞は30分程度でTNFαを産出するため、本デバイスによるリポ多糖導入は、対象とした単球細胞のマイクロ環境にのみ行われたといえます。
以上の結果から、本デバイスにより、一様に培養された数百万個の細胞の中から数個~2,000個の細胞を選択して化学刺激を送るマイクロ環境操作が可能であることが実証されました。
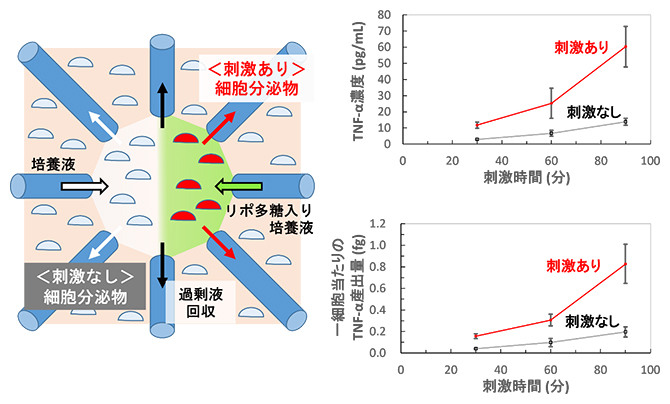
図4 マイクロ環境へのリポ多糖刺激の導入と産出された細胞分泌物(TNFα)の量
左図 細胞刺激時の俯瞰図。右のキャピラリーからリポ多糖を含んだ細胞培養液、左のキャピラリーからリポ多糖を含まない細胞培養液が導入された。リポ多糖刺激を受けた細胞の分泌物を赤矢印のキャピラリーから回収し、刺激を受けなかった細胞の分泌物を白矢印のキャピラリーから回収した。なお黒矢印のキャピラリーは、過剰な導入液体を回収し、隣接する領域にリポ多糖導入環境と非リポ多糖導入環境を設定するために機能する。
右上図 リポ多糖刺激を受けた細胞と刺激を受けなかった細胞の各マイクロ環境中でのTNFα濃度の経時変化を示したグラフ。計測は、刺激開始後30分、60分、90分に行った。1ピコグラム(pg)は1兆分の1g。
右下図 リポ多糖刺激を受けた細胞と刺激を受けなかった細胞から分泌された、一細胞当たりのTNFα産出量を計算したグラフ。計測は、刺激開始後30分、60分、90分に行った。1フェムトグラム(fg)は1000兆分の1g。
今後の期待
本研究ではマイクロ流体操作により、数百万個の細胞が培養される細胞培養液中で、数個~数千個の少数の細胞に影響を与えるマイクロ環境に対して化学刺激を導入し、細胞からマイクロ環境中に分泌された分子を測定することに成功しました。これまでのマイクロ流体デバイスと異なり、狭い空間に細胞を閉じ込めることがないため、より生理的環境に近い状態にある細胞のマイクロ環境を操作し、細胞分泌物の分析を行うことができます。
本研究の応用例として、局所的な細胞組織からマイクロ環境に分泌されるRNAなどの遺伝物質の分析、多数の細胞の中から任意の細胞のみに対する分化誘導、一様な細胞から臓器形成につながるような複数種類の細胞のパターニング、トリプシンを用いた3次元的な細胞組織構造(オルガノイド[7])の造形などが想定されます。これらの実験により、初期がん細胞のような病的な生物組織が発生するメカニズムの理解や、細胞組織の治療法確立に役立つと考えられます。このように、本研究は細胞組織分析や生物組織工学へ広く応用されると期待できます。
補足説明
1.マイクロ流体デバイス
半導体製造技術を用いて、微細な流路を樹脂やガラスなどの基板に形成することで、流路中の液体もしくは液体中を流れる物質の操作をマイクロスケールで行うためのデバイス。
2.視交叉上核
脳の視床下部に存在する神経核。哺乳類の概日リズムの中枢であり、動物の視交叉上核を破壊すると概日リズムがなくなることが知られている。
3.筋芽細胞
筋肉の形成において、筋線維のもとになる細胞。
4.トリプシン
タンパク質の一種。壁面に接着した細胞を剥がす作用があり、培養細胞の剥離に広く用いられる。
5.リポ多糖
大腸菌などのグラム陰性菌の細胞壁に含まれる成分。
6.単球細胞、TNFα
単球は白血球の一種であり、炎症時などにリポ多糖を検知すると、炎症誘導物質であるTNFαなどの細胞分泌物を活発に産出する。
7.オルガノイド
幹細胞から人工的に作製した「ミニ臓器」。臓器形成の仕組みの解明や、臓器を標的とした創薬、再生医療への応用などが期待されている。
研究チーム
理化学研究所 生命機能科学研究センター 集積バイオデバイス研究チーム
チームリーダー(研究当時)田中 陽(タナカ・ヨウ)
上級研究員 田中 信行(タナカ・ノブユキ)
研究員 太田 亘俊(オオタ・ノブトシ)
テクニカルスタッフ 佐藤 麻子(サトウ・アサコ)
客員研究員 ヤリクン・ヤシャイラ(YalikunYaxiaer)
研修生(研究当時)沈 毅剛(シン・キゴウ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業若手研究「細胞間コミュニケーション分析に向けた多点細胞分泌物採取デバイスの開発(研究代表者:太田亘俊)」、同基盤研究(B)「細胞の3次元パターニングによるオンチップ心臓創成(研究代表者:田中陽)」、同新学術領域研究「自励振動ゲルを用いたソフトマイクロポンプ(研究代表者:田中陽)」による助成を受けて行われました。
原論文情報
Nobutoshi Ota, Nobuyuki Tanaka, Asako Sato, Yigang Shen, Yaxiaer Yalikun and Yo Tanaka, “Microenvironmental analysis and control for local cells under confluent conditions via capillary-based microfluidic device”, Analytical Chemistry, 10.1021/acs.analchem.2c02815
発表者
理化学研究所
⽣命機能科学研究センター 集積バイオデバイス研究チーム
研究員 太田 亘俊(オオタ・ノブトシ)
チームリーダー(研究当時)田中 陽(タナカ・ヨウ)
報道担当
理化学研究所 広報室 報道担当

