言語や視覚の問題など、稀な症状を説明するのに役立つ可能性があります。 Findings could help explain rare symptoms such as problems with language, vision
2022-11-16 ワシントン大学セントルイス
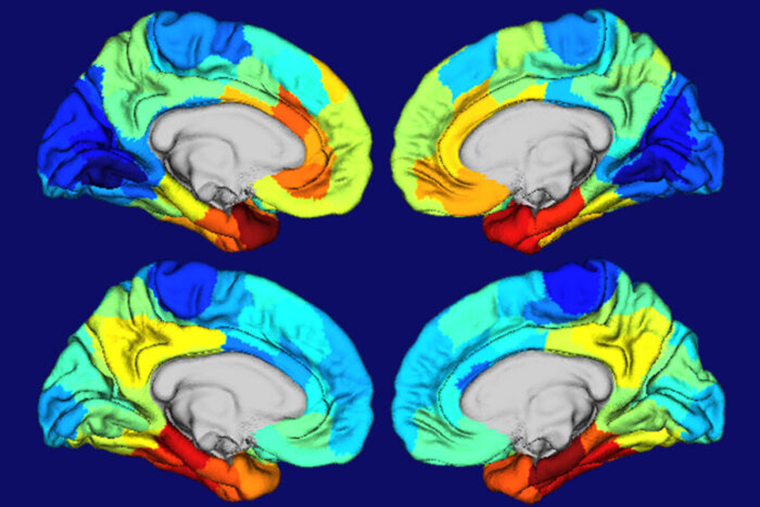
Red and orange areas on these heat maps of human brains show where the gene APOE is most active (top two brain images) and where tangles of the protein tau are most concentrated (bottom two brain images). APOE is the biggest genetic risk factor for Alzheimer’s, and tau tangles drive brain damage in the disease. The similarities in the two sets of maps suggested to researchers at Washington University School of Medicine in St. Louis that APOE plays a role in making certain brain areas particularly vulnerable to Alzheimer’s damage. (Image: Diana Hobbs)
この研究結果は、アルツハイマー病の症状が時々異なる理由を説明するのに役立つとともに、アルツハイマー病においてまだ発見されていない生物学的メカニズムが重要な役割を果たしている可能性を示唆する、研究されていない側面に光を当てている。
アルツハイマー病の脳障害がなぜ起こるのかを理解するために、記憶と老化の研究にボランティアとして参加している350人を調査しました。参加者は脳スキャンを受け、アミロイド斑とタウの絡まりの量と位置、および脳のさまざまな領域の体積を測定することができた。
研究者らは、ボランティアのタンパク質の塊や組織の損傷のパターンを、Allen Institute for Brain Sciencesが編集したヒト脳の遺伝子発現の詳細な地図であるAllen Human Brain Atlasに描かれているAPOEや他のアルツハイマー病に関連する遺伝子の発現パターンと比較した。
APOEの高発現が見られる場所と、タウの絡まりや組織の損傷が見られる場所が、ほぼ一致していた。
APOEだけではなく、例えば、アルツハイマー病に関連する遺伝子の上位20個を見てみると、どれも側頭葉で同じようなパターンで発現している。これらの領域には、アルツハイマー病の脳に損傷を与えやすい何か根本的な違いがあり、その違いは、おそらく生まれつきのもので、その人の遺伝子の影響を受けている。
研究グループは、APOEの高リスク変異体がタウによる脳障害に及ぼす影響を評価するため、参加者を高リスク変異体保有者と非保有者に分類し、彼らの脳におけるタンパク質クラスターと萎縮を分析した。
APOE4キャリアは、アミロイドを蓄積し始める可能性が高いので、アルツハイマー病への道を歩むことになる。そして、同じ量のアミロイドに対して、より多くのタウの絡まりが生じ、これがより多くの萎縮をもたらす。
<関連情報>
- https://source.wustl.edu/2022/11/study-yields-clues-to-why-alzheimers-disease-damages-certain-parts-of-the-brain/
- https://www.science.org/doi/10.1126/scitranslmed.abl7646
APOE ε4遺伝子型、アミロイドβ、および性別は、APOE mRNA高発現領域におけるタウを予測するために相互作用する。 APOE ε4 genotype, amyloid-β, and sex interact to predict tau in regions of high APOE mRNA expression
Aylin Dincer,Charles D. Chen,Nicole S. McKay,Lauren N. Koenig,Austin McCullough,Shaney Flores,Sarah J. Keefe,Stephanie A. Schultz,Rebecca L. Feldman,Nelly Joseph-Mathurin,Russ C. Hornbeck,Carlos Cruchaga,Suzanne E. Schindler,David M. Holtzman,John C. Morris,Anne M. Fagan,Tammie L.S. Benzinger,Brian A. Gordon
Science Translational Medicine Published:16 Nov 2022
DOI: 10.1126/scitranslmed.abl7646
The genetic of tau pathology
APOE ε4 allele is associated with increased risk of developing late-onset Alzheimer’s disease (AD). However, the relationship between the APOE ε4 allele and the major hallmarks of AD pathophysiology remains to be completely elucidated. Now, Dincer et al. used imaging data, cerebrospinal fluid, and mRNA from APOE ε4 carrier and noncarrier participants and showed that APOE ε4 influenced brain Aβ, tau, and CSF ptau181. Moreover, APOE ε4 was associated with increased tau burden in regions with high APOE mRNA expression. The results suggest that the severity of brain pathology might be driven by gene expression. APOE status should be considered when evaluating disease progression and clinical trials.
Abstract
The apolipoprotein E (APOE) ε4 allele is strongly linked with cerebral β-amyloidosis, but its relationship with tauopathy is less established. We investigated the relationship between APOE ε4 carrier status, regional amyloid-β (Aβ), magnetic resonance imaging (MRI) volumetrics, tau positron emission tomography (PET), APOE messenger RNA (mRNA) expression maps, and cerebrospinal fluid phosphorylated tau (CSF ptau181). Three hundred fifty participants underwent imaging, and 270 had ptau181. We used computational models to evaluate the main effect of APOE ε4 carrier status on regional neuroimaging values and then the interaction of ε4 status and global Aβ on regional tau PET and brain volumes as well as CSF ptau181. Separately, we also examined the additional interactive influence of sex. We found that, for the same degree of Aβ burden, APOE ε4 carriers showed greater tau PET signal relative to noncarriers in temporal regions, but no interaction was present for MRI volumes or CSF ptau181. This potentiation of tau aggregation irrespective of sex occurred in brain regions with high APOE mRNA expression, suggesting local vulnerabilities to tauopathy. There were greater effects of APOE genotype in females, although the interactive sex effects did not strongly mirror mRNA expression. Pathology is not homogeneously expressed throughout the brain but mirrors underlying biological patterns such as gene expression.