2023-01-13 理化学研究所
理化学研究所(理研)生命医科学研究センター 免疫器官形成研究チームの増井 修 研究員、古関 明彦 チームリーダーらの国際共同研究グループは、X染色体不活性化[1]の維持を担う新たな分子メカニズムを発見しました。
本研究成果は、将来的にゲノム上の任意の遺伝子の転写を制御する技術の開発に役立つと期待できます。
X染色体不活性化は、哺乳類の雌の生存に必須の生命現象です。X染色体不活性化の前半部分である開始から確立に至る過程のメカニズムについては理解が進んできていますが、後半部分の維持についてはよく分かっていませんでした。
今回、国際共同研究グループは、転写抑制に関わるポリコーム複合体[2]PRC1とPRC2のどちらかが欠失するマウスを用いて解析した結果、X染色体不活性化の維持にはPRC1とPRC2の双方が独立してそれぞれ必須であることを明らかにしました。類似したメカニズムは、一般的な遺伝子の転写活性の制御にも使われている可能性が高いと考えられます。
本研究は、科学雑誌『Nature Cell Biology』オンライン版(1月12日付:日本時間1月13日)に掲載されました。
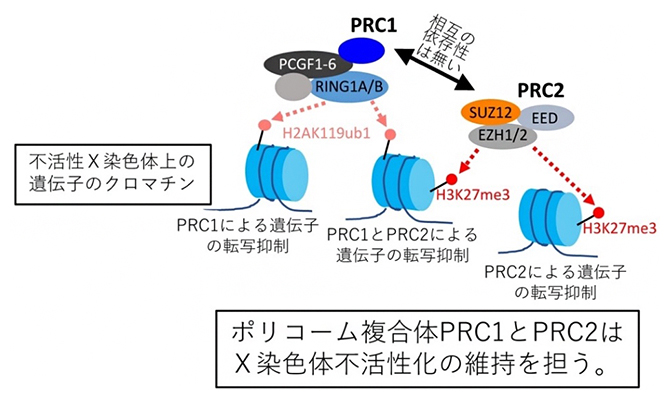
X染色体不活性化を維持するメカニズム
背景
哺乳類の性染色体の構成は、雄がXY、雌はXXです。Y染色体は50個ほどの遺伝子しか持たないのに対し、X染色体には約1,000個の遺伝子が存在しています。このXY性染色体間の遺伝子量(転写量)の不均衡を是正するために、生物は「遺伝子量補正[3]」というメカニズムを進化の過程で獲得してきました。遺伝子量補正のメカニズムは生物種によって異なっており、哺乳類の場合は雌の2本のX染色体のうちの1本が「X染色体不活性化」という仕組みによって、遺伝子が働かなくなった「不活性X染色体[4]」を形成します。
X染色体不活性化は、雌の個体発生や恒常性の維持に必須の生命現象です。X染色体不活性化は個体発生の初期に開始して確立しますが、その不備は雌胎仔の胎生致死につながります。また、X染色体不活性化はいったん確立した後、幾多の細胞分裂を経て安定に維持され、娘細胞に引き継がれていく必要があり、その破綻は血球や乳腺細胞をがん化させることが知られています。つまり、2本のX染色体が転写し続ける状態は雌には有害なため、雌の各細胞は1本のX染色体を転写不活性化しているともいえます。従って、X染色体不活性化がどのように確立して維持されるかを理解することは、雌個体の健康を保持するメカニズムの理解につながると考えられ、研究が進められています。
X染色体不活性化の過程[5]は、前半部分の開始段階と後半部分の維持段階の大きく二つの段階に分けて考えられます。これまでに、X染色体不活性化の前半部分である開始から確立に至る過程のメカニズムについては徐々に理解が進んできていますが、後半部分の維持についてはよく分かっていませんでした。一方、ポリコーム複合体(タンパク質複合体)のPRC1とPRC2というエピジェネティクス修飾[6]因子は標的遺伝子の転写抑制に関与しており、X染色体不活性化の開始と維持の両方の期間にわたって不活性X染色体上に蓄積することが知られていました。これまでに、ポリコーム複合体はX染色体不活性化の開始に関与することは知られていましたが、維持の方にも役割があるかどうかはよく分かっていませんでした。
これらの背景を踏まえて、本研究では、ポリコーム複合体PRC1とPRC2のX染色体不活性化の維持への関わりを明らかにするための実験を行いました。
研究手法と成果
国際共同研究グループは、まずタモキシフェンという薬剤の投与によってPRC1を欠失できる遺伝子改変マウスを作製しました。このマウスを用いて、胎生5.5日目の胎仔においてPRC1の欠失を誘導し、2日後の胎生7.5日目の胎仔を用いて、不活性X染色体上のAtrxとHuwe1遺伝子の転写の状態をRNA FISH[7]という方法で調べました。その結果、対照群となる正常なPRC1を持つ雌胎仔では、胚体組織と胚体外組織[8]の両方においてAtrxとHuwe1遺伝子は不活性X染色体からほとんど転写されていなかったのに対し、PRC1を欠失させた雌の胎仔では、両遺伝子の不活性X染色体からの転写が検出されました。
しかし、この不活性X染色体からの転写は胚体外組織では観察されましたが、胚体組織では観察されませんでした(図1)。この時期の胚体外組織では、不活性X染色体はすでに十分に確立しており維持の段階に入っていることから、ポリコーム複合体PRC1は胚体外組織において、不活性X染色体上の遺伝子の転写不活性化を維持する役割を持つことが分かりました。
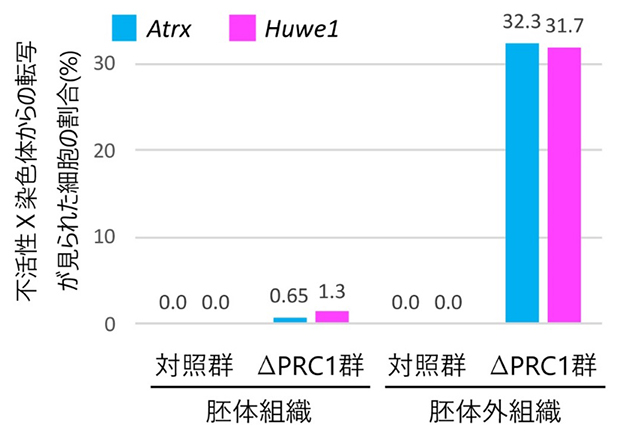
図1 PRC1による胚体外組織でのX染色体不活性化の維持
対照群とPRC1ノックアウト(欠失)群(∆PRC1群)のマウス7.5日目胚を用いて、RNA FISHにより不活性X染色体上の遺伝子(AtrxとHuwe1)から転写されたmRNAを検出した。同時に不活性X染色体のマーカーであるXist RNAを検出して、不活性X染色体からの転写が生じた細胞の割合を算出した。PRC1の欠失により、AtrxとHuwe1遺伝子の不活性X染色体での転写不活性化が解除される様子が胚体外組織で見られるが、胚体組織ではほとんど見られない。
次に、不活性X染色体上のAtrxとHuwe1以外の遺伝子も、同様に胚体外組織でPRC1による転写不活性化の維持を受けるかどうかをRNA-seq[9]という手法を用いて検証しました。その結果、PRC1を欠失させたマウス胚の胚体外組織では、27.6%の遺伝子が不活性X染色体から転写されることが明らかになりました。同様の実験をもう一つのポリコーム複合体であるPRC2を欠失させたマウスを用いて行ったところ、15.1%の遺伝子が不活性X染色体から転写されました(図2)。
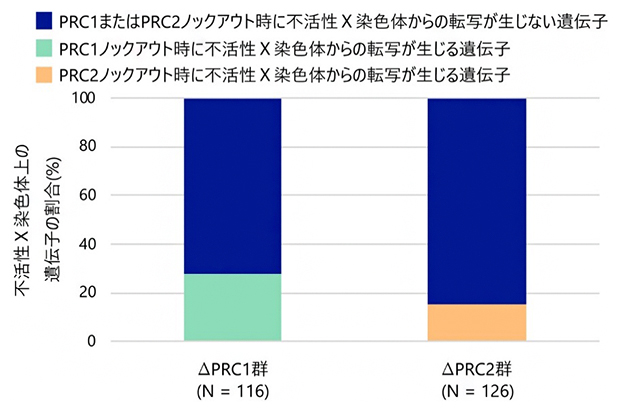
図2 PRC1またはPRC2の欠失により不活性X染色体から転写される遺伝子の割合
PRC1ノックアウト(欠失)群(∆PRC1群)、またはPRC2ノックアウト(欠失)群(∆PRC2群)のマウス7.5日目胚の胚体外組織を用いて、RNA-seqにより不活性X染色体上から転写される遺伝子を検出した。∆PRC1群では不活性X染色体上の27.6%の遺伝子が、∆PRC2群では15.1%の遺伝子が、転写抑制の状態を維持できずに不活性X染色体から転写された。
次に、これらのPRC1またはPRC2に依存して不活性X染色体上で転写不活性化が維持されている遺伝子群(PRC1:31遺伝子、PRC2:19遺伝子)について、両者の間にどの程度の重複が見られるかを検証しました。その結果、両者の間にはある程度の重複が見られ、これらの遺伝子はPRC1とPRC2の両方に依存して転写抑制の維持を受けていると考えられました。一方、多くの遺伝子は、PRC1またはPRC2のどちらかの遺伝子を欠失させたときに不活性X染色体上での転写抑制が解除されることが分かりました(図3)。これらの結果から、不活性X染色体上の多くの遺伝子がPRC1またはPRC2単独で転写抑制状態を維持されていると考えられます。
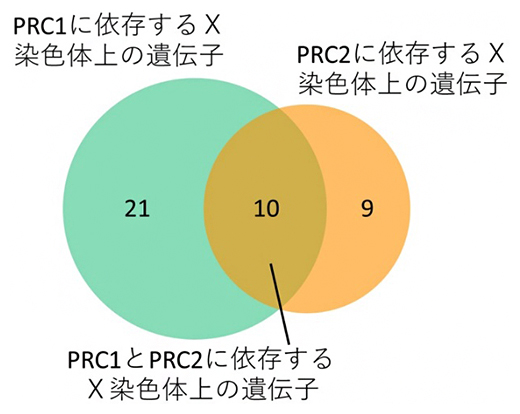
図3 PRC1またはPRC2の欠失により不活性X染色体から転写される遺伝子群の重複度合い
図2の実験で同定した、PRC1欠失(∆PRC1)またはPRC2欠失(∆PRC2)のマウス7.5日目胚の胚体外組織において、不活性X染色体上から転写される遺伝子群の重複の度合いを比較した。重複を示した10の遺伝子は、PRC1またはPRC2の欠失によって不活性X染色体上から転写されるが、21の遺伝子はPRC1のみの欠失、9の遺伝子はPRC2のみの欠失により、それぞれ不活性X染色体上での転写抑制が維持できずに転写された。
X染色体不活性化の開始段階では、PRC1を欠失させると不活性X染色体上に蓄積していたPRC2が消失することから、二つのポリコーム複合体の間には明確な依存性がある、すなわちPRC2はPRC1に依存して不活性X染色体上に蓄積する、ということが以前に報告されていました注)。そこで、X染色体不活性化の維持段階においても、同様のポリコーム複合体間の依存性が存在するかどうかを検証しました。
前述した薬剤投与によってPRC1またはPRC2を欠失できる遺伝子改変マウスを用いて、X染色体不活性化の維持段階においてPRC1を欠失させたときのPRC2の不活性X染色体上への蓄積と、逆にPRC2を欠失させたときのPRC1の不活性X染色体上への蓄積が消失するかどうかを免疫染色[10]という方法により解析しました。その結果、PRC1またはPRC2を欠失させても、もう一方のPRC2またはPRC1は不活性X染色体上に蓄積したまま保持されることが分かりました。
これらの結果から、X染色体不活性化の開始段階に見られたPRC1とPRC2の間の依存性は、その後の維持段階においては消失していると結論しました(図4)。このことは、二つのポリコーム複合体が発生や分化の段階に応じて複雑に制御されていることを示しています。
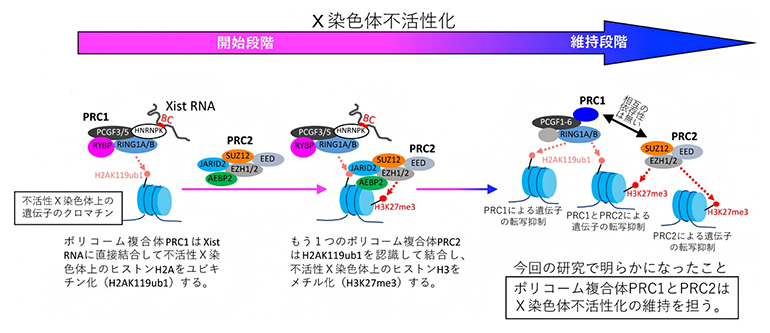
図4 今回の研究結果を含むX染色体不活性化におけるポリコーム複合体の役割の概略
(左・中央)X染色体不活性化の開始段階におけるポリコーム複合体の役割を示す。PRC2は、PRC1に依存して不活性X染色体上に蓄積する。
(右)今回の研究で明らかになった、X染色体不活性化の維持段階におけるポリコーム複合体の役割を示す。PRC1とPRC2の間に依存性は存在せず、両者は独立して不活性X染色体上に蓄積し、遺伝子の転写不活性化を維持する役割を担う。
今回の実験結果から、X染色体不活性化の維持に関して以下の項目が明らかになりました。
1.ポリコーム複合体PRC1とPRC2の双方が、マウス胎仔の胚体外組織においてX染色体不活性化の維持に必須の役割を持つ。
2.PRC1とPRC2は不活性X染色体上において必ずしも同じ遺伝子の転写を抑制するわけではなく、PRC1、PRC2のどちらかにのみによって転写抑制が維持されるものも多く存在する。
3.X染色体不活性化の開始段階で見られるPRC1とPRC2の間の依存性は、その後の維持段階では消失する。
注)Almeida, M. et al. PCGF3/5-PRC1 initiates Polycomb recruitment in X chromosome inactivation. Science 356, 1081-1084 (2017)
今後の期待
今回の研究では、雌の生存に不可欠なX染色体不活性化の維持に、遺伝子の転写抑制に関与するポリコーム複合体PRC1とPRC2が重要な役割を持つことが明らかになりました。この分子メカニズムは、胎盤などの胎仔の成長を支持する胚体外組織で機能しています。一方、胎仔そのものへと発生していく胚体組織ではポリコーム複合体に加えて、他の分子がバックアップの役割を果たして強固にX染色体不活性化を維持していると考えられます。このことは、出産後に周囲の激しい環境変化にさらされる中で恒常性を保つ必要がある胚体組織では、妊娠期間中という比較的短い間、かつ子宮という安定した安全な環境の中で胎仔の生育を支えればよい胚体外組織とは異なるX染色体不活性化の維持メカニズムを哺乳類が獲得してきたことを示唆しています。
今後は、胚体組織においてX染色体不活性化の維持を担うポリコーム複合体以外の分子メカニズムの解明が期待されます。また、同様の分子メカニズムはX染色体不活性化だけに限らず、より一般的な遺伝子制御の基盤メカニズムとして働いている可能性が考えられ、今後の研究による解明が待たれます。
近年の研究から、がんを含む多くの病気は私たちが内包する遺伝子の発現(転写)の異常が原因となる場合が多いことが分かってきています。本研究およびこれに続く基礎研究によって、複雑な遺伝子の発現制御の分子メカニズムを理解することは、それらを人為的に制御する技術の開発につながる可能性を持っています。将来的には、それらの遺伝子発現異常が原因となる病気に対する新しい治療法の開発へとつながると期待できます。
補足説明
1.X染色体不活性化
英国の遺伝学者Mary F. Lyon博士により発見された生命現象で、哺乳類の雌の細胞で、2本のX染色体のうちの1本の染色体全体が転写不活性化を受けること。X染色体からの遺伝子転写量を雌雄間で補正して調節する、遺伝子量補正の役割を持つ。
2.ポリコーム複合体
進化上、昆虫からヒトに至るまで多くの生物で保存されているタンパク質複合体で、PRC1とPRC2の二つに大別される。標的とする遺伝子領域に結合して、その部分にエピジェネティクス修飾を付加することで、周辺に存在する遺伝子の発現(転写)を抑制する。
3.遺伝子量補正
X染色体はY染色体に比べて染色体上の遺伝子の数が多いことから、雌(XX)は雄(XY)に比べて、X染色体からの遺伝子転写量が2倍多い。この差を補正するために、生物は遺伝子量補正と呼ばれる多様なメカニズムを進化させてきた。哺乳類の場合はX染色体不活性化により雌のX染色体の1本を転写不活性化して遺伝子量補正を行っている。
4.不活性X染色体
X染色体不活性化により転写不活性化されたX染色体のこと。
5.X染色体不活性化の過程
X染色体不活性化の形成過程は、前半部分の開始段階と後半部分の維持段階の二つに分けて考えられる。開始段階では、Xistと呼ばれるRNA分子がポリコーム複合体を含めた転写抑制に関わるタンパク質因子をX染色体上に蓄積させて、転写不活性化を開始して不活性X染色体を形成する。一方、維持段階では、形成された不活性X染色体が細胞分裂を経ながらも長期間安定に維持される。維持段階の分子メカニズムは、これまでによく分かっていなかった。
6.エピジェネティクス修飾
生物の遺伝情報はゲノムDNA上に保持されており、多くの生物においてゲノムDNAはヒストンタンパク質の周囲に巻きついた状態で、コンパクトな状態で収納されている。ゲノムDNAそのもの、またはヒストンタンパク質はさまざまな化学修飾を受けることで、周辺の遺伝子の機能を調節しており、それらの化学修飾を総じてエピジェネティクス修飾と呼ぶ。
7.RNA FISH
遺伝子から転写されたmRNA分子に蛍光ラベルした核酸プローブを結合(ハイブリダイズ)させて、蛍光顕微鏡によって蛍光シグナルとして検出する実験方法。RNA fluorescent in situ hybridization の略語。
8.胚体組織と胚体外組織
精子と卵子が受精した後に形成される受精卵はその後に胚へと成長し、子宮への着床前後に胚体組織と胚体外組織の二つの組織へと分化する。その後胚体組織は胎仔本体へと分化し、胚体外組織は胎盤など胎仔の成長を支持する組織へと分化していく。
9.RNA-seq
RNA sequencingとも呼ぶ。試料から調製したmRNA(メッセンジャーRNA)分子の塩基配列を解読して、どの遺伝子がどの程度発現(転写)しているかを定量的に解析する手法。ここでは不活性X染色体から転写されたmRNAを検出するために用いた。
10.免疫染色
抗体タンパク質が特定の物質に特異的に結合する性質を利用して、直接または間接に蛍光標識した抗体を用いて、細胞内の特定の物質(多くの場合はタンパク質)を蛍光シグナルとして蛍光顕微鏡により検出する方法。本研究ではPRC1またはPRC2に対する抗体を用いて、不活性X染色体上にPRC1やPRC2が蓄積するかどうかの検証に使用した。
国際共同研究グループ
理化学研究所 生命医科学研究センター
免疫器官形成研究チーム
研究員 増井 修(マスイ・オサム)
テクニカルスタッフ 塩谷 芙由子(シオタニ・フユコ)
テクニカルスタッフ(研究当時)公文 麻美(クモン・マミ)
テクニカルスタッフ 古関 庸子(コセキ・ヨウコ)
チームリーダー 古関 明彦(コセキ・ハルヒコ)
統合ゲノミクス研究チーム
技師 遠藤 高帆(エンドウ・タカホ)
キュリー研究所(フランス)哺乳類発生エピジェネティクスグループ
研究員(研究当時)キャトリーン・コーベル(CatherineCorbel)
テクニカルスタッフ(研究当時)パトリシア・ディアバンゴーヤ(PatriciaDiabangouaya)
グループリーダー(研究当時)エディス・ハード(EdithHeard)
(現 欧州分子生物学研究所(ドイツ)Directorgeneral、コレージュ・ド・フランス教授)
大阪大学大学院 理学研究科 染色体構造機能学研究室
准教授 長尾 恒治(ナガオ・コウジ)
教授 小布 施力史(オブセ・チカシ)
かずさDNA研究所 オミックス医科学研究室
染色体工学ユニット長 中山 学(ナカヤマ・マナブ)
研究支援
本研究は日本学術振興会(JSPS)科学研究費助成事業新学術領域(研究領域提案型)「多様かつ堅牢な細胞形質を支える非ゲノム情報複製機構(領域代表:中西真)」の計画研究課題「ポリコム群による抑制ドメインの複製機構の解明(研究代表者:古関明彦)」、同基盤研究(A)「ポリコム群抑制クロマチン形成におけるCpG配列認識の意義の解明(研究代表者:古関明彦)」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)「エピゲノム研究に基づく診断・治療へ向けた新技術の創出(研究総括:山本雅之)」の研究課題「エピジェネティクスによるエンハンサー動態制御メカニズムの解明と細胞機能制御への応用(研究代表者:古関明彦)」、科学技術振興機構(JST)戦略的創造研究推進事業個人型研究(PRESTO、さきがけ)「エピジェネティクスの制御と生命機能(研究総括:向井常博)」の研究課題「Long non-coding RNA による転写抑制機構の解明(研究者:増井修)」の助成を受けて行われました。
原論文情報
Osamu Masui*, Catherine Corbel*, Koji Nagao, Takaho A. Endo, Fuyuko Kezuka, Patricia Diabangouaya, Manabu Nakayama, Mami Kumon, Yoko Koseki, Chikashi Obuse, Haruhiko Koseki#, Edith Heard#*共同筆頭著者、#共同責任著者, “Polycomb repressive complexes 1 and 2 are each essential for maintenance of X inactivation in extraembryonic lineages”, Nature Cell Biology, 10.1038/s41556-022-01047-y
発表者
理化学研究所
生命医科学研究センター 免疫器官形成研究チーム
研究員 増井 修(マスイ・オサム)
チームリーダー 古関 明彦(コセキ・ハルヒコ)
報道担当
理化学研究所 広報室 報道担当