2023-07-17 理化学研究所
理化学研究所(理研)生命機能科学研究センター エピジェネティクス制御研究チーム(研究当時)の梅原 崇史 チームリーダー(研究当時、現 創薬タンパク質解析基盤ユニット 上級研究員)、菊地 正樹 研究員(研究当時)、森田 鋭 技師(研究当時)、タンパク質機能・構造研究チームの白水 美香子 チームリーダー、環境資源科学研究センター 技術基盤部門の堂前 直 副部門長らの研究グループは、後成遺伝情報[1](エピジェネティック情報)を担うヒストン[2]のアセチル化修飾[3]が酵素によってどのように「読み書き」され、どのように自己増殖するかについての仕組みを解明しました。
本研究成果は、真核生物の細胞で特定の遺伝子が転写[4]されるために必要な後成遺伝情報の継承と発現の原理の理解につながると期待できます。
真核細胞のゲノムDNAはヌクレオソーム[5]という構造を単位として凝縮しており、エピゲノム[1]はどの遺伝子のヌクレオソームをその転写前に解きほぐすかを制御しています。
今回、研究グループは構造生物学・生化学の手法を用いて、p300[6]およびCBP[6]というヒストンアセチル化酵素の機能を解析した結果、p300/CBPはヒストンH4のN末端テイル[7]のアセチル化状態を認識し(読み)、同じヌクレオソームに存在するヒストンH2BやヒストンH3のN末端テイルをアセチル化する(書く)ことが分かりました。さらに、ヒストンのアセチル化修飾がどのようにして自己増殖し、特定の遺伝子を転写に導くのかを簡潔に説明する「エピセントラル・モデル」を提唱しました。
本研究は、科学雑誌『Nature Communications』のオンライン版(7月17日付:日本時間7月17日)に掲載されました。
背景
細胞やウイルスが増殖して機能するためには、環境に応じて特定の遺伝子が適切な場所・時期で発現する必要があります。この遺伝子発現の最も重要な制御は、ゲノムやエピゲノムからどの遺伝子を転写するかを決める段階で行われます。どの遺伝子を転写するかは、転写因子と呼ばれるタンパク質がDNAに結合することで調節されます。転写因子による遺伝子発現制御は、ヒトや酵母をはじめとする真核生物[8]とバクテリアなどの原核生物[9]に共通した仕組みです。一方、長大なゲノムDNAを持つ真核生物の細胞核には、DNAが凝縮した「ヌクレオソーム」と呼ばれる構造があり、エピゲノムはどの遺伝子のヌクレオソームを転写前に解きほぐすかを制御しています。そのため、真核生物のエピゲノムで特定の遺伝子を適切に発現させる仕組みには、原核生物で知られている制御機構を超えた仕組みがあると考えられてきました。
ヌクレオソームは、145~147塩基対のDNAがヒストンH3-H4四量体一つとヒストンH2A-H2B二量体二つからなるヒストン八量体に巻き付いて構成されています(図1上)。ヌクレオソームでは、この4種類8個のヒストンからそれぞれN末端テイルがDNAの外側に突き出ており、これらのN末端テイルにさまざまな種類の化学修飾が「書かれ」、「読まれ」、「消される」ことで、遺伝子発現が制御されていると考えられています(図1下)。代表的な化学修飾にヒストンN末端テイルのリシン(K)残基の「アセチル化」があり、ヒストンのアセチル化修飾は真核生物において遺伝子転写の活性化と相関しています。
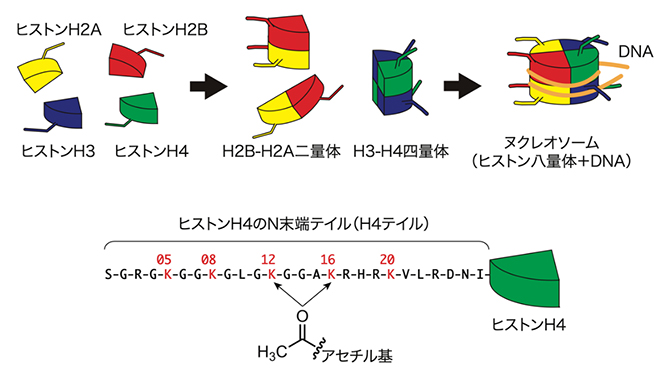
図1 ヌクレオソームの構造とヒストンのアセチル化修飾
上:4種類のヒストンタンパク質とヌクレオソーム構造の模式図。ヒストンタンパク質から突き出ている部分はN末端テイルを示す。
下:ヒストンH4のN末端テイル(H4テイル)のアミノ酸配列。H4テイルにはアセチル化を受けるリシン(K)残基が5カ所ある。このうち12番目と16番目がアセチル化されたH4テイルにp300は最も結合しやすい。アセチル化によって付加されるアセチル基の化学構造式をアミノ酸配列の下に示す。
ヒトをはじめとする後生動物[8]においてリシン残基をアセチル化する代表的な書き手、つまりヒストンアセチル化酵素にはp300とその近縁のCBPがあり、これら二つは4種類のヒストン全てをアセチル化します。また、p300/CBPはアセチル化されたリシン残基の位置を読み取って結合するブロモドメイン[10]を持ち、アセチル化の「書き」だけでなく「読み」も担うことが示されていました。特に最近の研究から、p300によるヒストンH2Bのアセチル化が遺伝子発現をつかさどるエンハンサー[11]を活性化する鍵であり、p300が関わるほぼ全てのエンハンサーとその標的遺伝子のプロモーター[12]において、RNAポリメラーゼII[4]による転写を促進することが知られています。しかし、p300/CBPがどのようにヌクレオソームのヒストンアセチル化を「読み書き」し、特定の遺伝子の転写を促すのかは不明でした。
研究手法と成果
p300は、12番目と16番目のリシン残基(H4K12とH4K16)がアセチル化されたヒストンH4のN末端テイル(H4テイル)に最も結合しやすいことが知られています(図1下)。そこで研究グループは、p300とヒストンの結合を詳しく観察するため、まず、遺伝暗号の拡張技術注1)と無細胞タンパク質合成技術[13]を用いて、この2カ所をアセチル化リシン残基に置き換えたヒストンH4組換えタンパク質を合成しました。これに、他の3種類のヒストン(H2A、H2B、H3)とリンカーDNA[5]を含む180塩基対のDNAを混合して、ヌクレオソームを試験管内で再構成しました。このヌクレオソームとp300を用いて生化学的な酵素アッセイを行った結果、ヌクレオソームのH4テイルがアセチル化していると、p300はH2Bテイルのアセチル化を著しく促進し、H3テイルのアセチル化も有意に促進することが分かりました。
さらに、この再構成したアセチル化ヌクレオソームとp300の立体構造をクライオ電子顕微鏡[14]を用いて解析したところ、リシンアセチル化を「読む」機能を持つp300のブロモドメインは確かにアセチル化したヒストンH4に結合し、アセチル化の「書き」を行うアセチル化酵素ドメインはH2BのN末端テイルに近接していました(図2)。この構造から、p300は1個のヌクレオソーム内で、ブロモドメインによるアセチル化の「読み」とアセチル化酵素ドメインによるアセチル化の「書き」を同時に担うことが示唆されました。
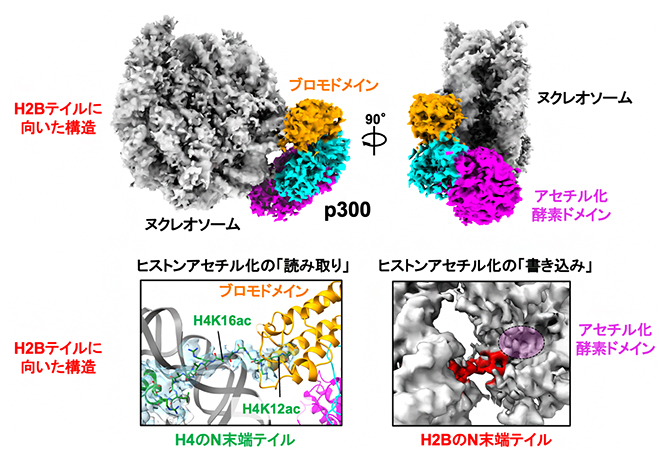
図2 p300/CBPがヌクレオソームのアセチル化を「読み書き」する仕組み
(上)p300とヌクレオソームの複合体のクライオ電子顕微鏡構造。クライオ電子顕微鏡密度マップの全体像を示す。p300はブロモドメイン(橙)とアセチル化酵素ドメイン(ピンク)を介して、曲がった状態でヌクレオソーム(灰色)に結合している。p300において、ブロモドメインとアセチル化酵素ドメインをつなぐ領域を水色で示す。
(左下)p300のブロモドメインによるヌクレオソームへの結合様式。ヒストンH4テイルのクライオ電子顕微鏡密度マップを水色で示し、その構造モデルを緑で示す。H4テイルの12番目のアセチル化リシン残基と16番目のアセチル化リシン残基の位置を、それぞれH4K12acとH4K16acのラベルで示す。
(右下)p300のアセチル化酵素ドメインによるヌクレオソームへの結合様式。ヒストンH2Bテイルのクライオ電子顕微鏡密度マップを赤で示す。H2Bテイルが、ヌクレオソーム(左側の灰色)からp300のアセチル化酵素ドメイン(右側のピンク)の付近に伸びていることが観察される。
次に、p300/CBPがアセチル化ヌクレオソームを「読み書き」する分子機構を詳しく解析するため、p300またはCBPとアセチル化ヌクレオソームとの複合体構造を多数の例で観察しました。観察した全ての複合体において、p300/CBPのブロモドメインはアセチル化されたH4テイルに結合していましたが、アセチル化酵素ドメインがヌクレオソームに結合する位置はそれぞれ大きく異なっていました。特にアセチル化酵素ドメインがH3テイルに近接した複合体では、アセチル化酵素ドメインとヌクレオソームDNAとの多点での相互作用が認められました。これは、無修飾のヌクレオソームでもH3テイルはp300/CBPによってアセチル化されやすかった今回の知見と整合性があります。
ブロモドメインは常にH4テイルに結合するにもかかわらず、なぜアセチル化酵素ドメインはさまざまなヒストン(H2A、H2B、H3)のテイルに誘導されるのでしょうか。ブロモドメインとH4テイルの相互作用を立体構造で確認すると、ブロモドメインはそのくぼみ状構造の内側でアセチル化されたH4テイルに結合しながら、そのくぼみのすぐ外側でヌクレオソーム二本鎖DNAの副溝[15]とさまざまな様式で結合していることが分かりました(図3)。興味深いことに、p300/CBPのブロモドメインはDNAと相互作用するものの、DNAの塩基配列は認識していませんでした。この仕組みにより、ヌクレオソームがエピゲノム中でどのようなDNA配列で構成されている場合でも、p300/CBPはアセチル化されたH4テイルに結合したブロモドメインを軸として、ヌクレオソーム上で回転しながらH4テイル以外の複数のヒストンテイルをアセチル化できることが示唆されました。
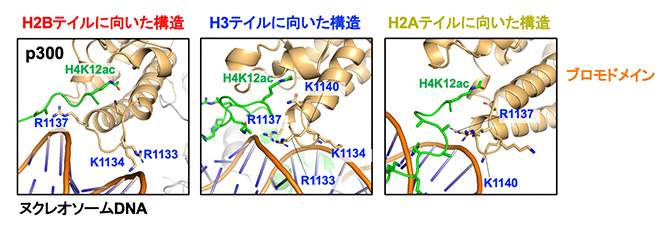
図3 ブロモドメインによる結合を介したp300のヌクレオソーム上での回転位置
p300のアセチル化酵素ドメインが、ヌクレオソーム中の3種類のヒストンのテイルに向いた構造を比較して示す。p300のブロモドメインは各パネルの右上に橙色で示されている。ヌクレオソーム中のDNAは各パネルの左下にスティックで示されている。H4テイル(緑)における12番目のアセチル化リシンの位置をH4K12acのラベルで示す。2本のDNA鎖の間はDNAの副溝で、この部位に結合するp300のリシン(K)またはアルギニン(R)の残基と残基番号を青色で示す。
ここまでの実験は、ヒストンH4のアセチル化に焦点を当ててきましたが、H4以外のヒストンのN末端テイルがアセチル化している場合については未解析です。そこで、各ヒストンテイルのアセチル化が他のヒストンのアセチル化にどのような影響を及ぼすのか系統的に調べました。その結果、p300がヒストンテイル間でアセチル化を「読み書き」する方向性は、大きく分けて2種類に分類されることが分かりました。すなわち、H4テイルとH3テイルの間では、双方向にアセチル化の「読み書き」が進行する(どちらかがアセチル化されていればもう一方のアセチル化が誘導される)一方、H4テイルとH2Bテイルの間またはH3テイルとH2Bテイルの間では、前者から後者に一方向に「読み書き」が進行します(図4)。
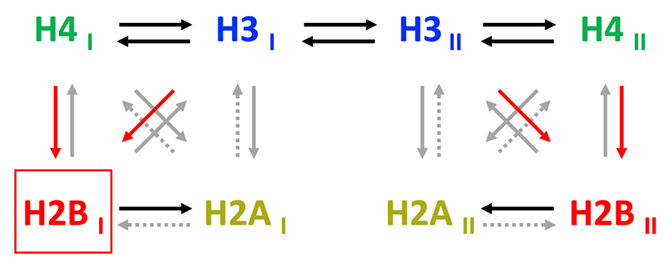
図4 p300がヒストンテイル間でアセチル化を読み書きする方向性
1個のヌクレオソーム中に存在する4組のヒストン(H2A、H2B、H3、H4)のペアのそれぞれのタンパク質をIとIIで示す。矢印は、ヒストンアセチル化の「読み書き」が行われる方向性とその強弱を色分けで示している。赤矢印はシグナル対ノイズ比(S/N比)が高い、黒矢印はS/N比が中程度、灰色矢印はシグナルが微弱か存在しない、点線の灰色矢印は未検討であることを示している。なお、同じヒストンのペアではH3とH4のうちのH3のみが、1本のH3テイルからもう1本のH3テイルにアセチル化を「読み書き」できる(H3I ⇄ H3II)ことがアセチル化酵素活性の解析から示唆された。
最後に、H2Bテイルのアセチル化の意義を調べました。H2BテイルにはH4テイルと同様にアセチル化されるリシン残基が多数存在し、アミノ酸配列においてリシン残基同士の間隔が似ている箇所があります。H4テイルのアセチル化はブロモドメインを持つタンパク質の結合を促し、がん細胞におけるエピゲノムの特徴となっています注2)。そこで、アセチル化されたH2Bテイルに何らかのタンパク質が結合する可能性を生化学的に検証しました。すると、p300やBRD4[16]と呼ばれるタンパク質に存在するブロモドメインはアセチル化されたH4テイルとはよく結合しましたが、アセチル化されたH2Bテイルとはほとんど結合しないことが分かりました。
この結果から、H2Bテイルのアセチル化は他のタンパク質の結合を促すのではなく、転写における情報伝達の終点として直接的に機能する可能性が考えられました。H2Bテイルのアセチル化の度合いは、その領域の転写のエンハンサー活性と強く相関することが分かっています。このことから、H2Bがアセチル化されることでH2A-H2B二量体がヌクレオソームから脱離し、転写が引き起こされる仮説が考えられました。この仮説を検証するため、ヌクレオソームの熱安定性に対するH2Bテイルのアセチル化の影響を調べたところ、H2Bテイルのアセチル化はヌクレオソームからH2A-H2B二量体を選択的に解離させることが分かりました。これらの結果から、ヒストンのH3テイルまたはH4テイルにあらかじめ存在するアセチル化されたリシン残基は、その情報(アセチル化修飾)をH2Bテイルに「転写」し、それによってヌクレオソームがH2A-H2B二量体を脱離しやすくなるため、転写因子と結合したp300/CBPが接触するヌクレオソームにある特定の遺伝子が特異的に転写される「エピセントラル・モデル」を提唱しました(図5)。
エピセントラル・モデルでは、H3-H4四量体とH2A-H2B二量体のアセチル化は異なる役割を担っています。DNAが遺伝情報の記憶装置であるように、p300/CBPはH3-H4四量体内のヒストンアセチル化を「複製」し、アセチル化されたH3-H4四量体は後成遺伝情報の記憶装置として永続します(図4のH3、H4を結ぶ双方向の黒矢印、図5)。また、RNAがDNAに書かれた遺伝情報の処理装置の役割を担うように、p300/CBPはH3-H4四量体内からH2B-H2A二量体にヒストンアセチル化を「転写」し、アセチル化されたH2B-H2A二量体は自らがヌクレオソームから離脱して特定の遺伝子を転写しやすくすることで、後成遺伝情報の処理装置の役割を担います(図4のH3、H4からH2Bを結ぶ一方向の赤矢印、図5)。つまり、真核生物特有の遺伝子制御の本質は、ヌクレオソームが後成遺伝情報を受け継ぐH3-H4四量体と、その情報を発現するH2A-H2B二量体をあわせ持つ点にあると考えられます。一つのヌクレオソーム内のリシン残基のアセチル化は、それがどのヒストンにあるかによって後成遺伝情報の継承と発現の二重性を持つことを意味します。
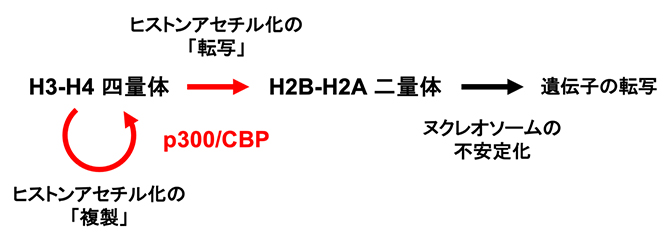
図5 遺伝子転写制御のエピセントラル・モデル
矢印は生命情報の流れを示し、ヒストンアセチル化の情報は赤色で示す。転写因子に結合したp300/CBPは自身が接触できるエピゲノムのうち、ヒストンH3-H4四量体のアセチル化の度合いが通常より高いヌクレオソームに対してヒストンのアセチル化を「複製」し、細胞分裂後の娘細胞にもヒストンアセチル化の後成遺伝情報を継承する。同時に、同じヌクレオソームのH2B-H2A二量体にヒストンのアセチル化を「転写」することでヌクレオソームが物理的に不安定化され、H2B-H2A二量体の解離が促進される。RNAポリメラーゼIIは、この不安定化されたヌクレオソームが存在する遺伝子を特異的に転写し、転写するごとにH2B-H2A二量体を交換する。この仕組みでヒストンアセチル化の後成遺伝情報が発現・消去される。
注1)2015年5月18日プレスリリース「DNA情報の変換ルールを人為的に改変」
注2)2018年8月8日プレスリリース「『がんエピゲノム』を検出する新手法」
今後の期待
ヒストンのアセチル化は、Vincent G. Allfreyらが1964年に発表した論文以降数多くの研究がなされており、真核生物において遺伝子の転写を活性化する重要な化学修飾と認識されています注3)。ヒストンのアセチル化を担う酵素の中でも、とりわけp300/CBPはさまざまな転写因子と結合し、自身のアセチル化酵素活性によって特定遺伝子の転写を活性化することで、多様な細胞応答やがんなどの疾患の制御に重要な役割を果たしています。
本研究で判明したp300/CBPによるヒストンアセチル化の「読み書き」の仕組みは、ヌクレオソーム内のヒストンの化学修飾が酵素を介して自己増殖するシステムを示す初めての構造的な証拠です。H3-H4四量体のアセチル化は、DNAの塩基配列に基づいてゲノムの特定の部位に結合した転写因子と結合したp300/CBPが接触するヌクレオソームで自己増殖すると考えられます。このヌクレオソームはH2B-H2A二量体のアセチル化によって不安定化し、転写因子が結合したゲノムの特定の部位に依存して特定の遺伝子を特異的に発現させると考えられます。
今回の成果に基づいて、ヒストンのアセチル化を介した後成遺伝情報発現の「エピセントラル・モデル」を提唱しました。このモデルは、従来複雑と考えられていた後生動物における遺伝子転写の特異性決定機構が、1)転写因子、2)p300/CBP、3)ヒストンH3-H4四量体のN末端テイルのアセチル化の3要素で決まるという簡潔なモデルです。このモデルは、細胞がエピゲノムに蓄えている後成遺伝情報の継承と発現を一つのヌクレオソームの内部で両立させる新しいビジョンをもたらしました。今後、エピセントラル・モデルは他の研究グループによる検証を経た上で、遺伝情報発現制御の原理を説明するモデルと位置づけられる可能性が期待できます。
注3)2020年11月26日プレスリリース「エピゲノムの制御を受けた転写の方程式」
補足説明
1.後成遺伝情報、エピゲノム
細胞内のDNAには、遺伝情報が塩基配列として記録されている。細胞には、DNAの塩基配列以外にも細胞の個性を記憶する個々の情報が存在しており、それらはDNAやヒストンなどに対する化学修飾として記録されている。このDNAの周辺に付加されるDNAの塩基配列以外の生命情報を後成遺伝情報(エピジェネティック情報)と呼ぶ。「ゲノム」が細胞内の全てのDNAの塩基配列として記録された遺伝情報の総体を指すのに対し、「エピゲノム」はDNAやヒストンの化学修飾などによって細胞の個性を記憶する情報の総体を指す。
2.ヒストン
DNAを巻き付けることで長大なDNAを核内に納めるタンパク質。代表的なヒストンとしてはH1、H2A、H2B、H3、H4の5種類があり、このうち、H2A、H2B、H3、H4の4種類のコアヒストンが2個ずつ集まってヒストン八量体を形成している。ヒストン八量体は、ヒストンH3とH4が2個ずつ集まったH3-H4四量体一つとヒストンH2AとH2Bが1個ずつ集まったH2A-H2B二量体二つで構成されている。ヒストンは酵母からヒトに至る真核生物のタンパク質で極めて保存性が高く、特にヒストンH4はアミノ酸配列が生物種間で最も高く保存されたタンパク質である。
3.アセチル化修飾
細胞内のタンパク質には、構成するアミノ酸の官能基にアセチル化などのさまざまな化学修飾が起こる。アセチル化修飾はタンパク質のリシン残基の側鎖アミンやN末端残基の主鎖アミンにアセチル基(CH3CO-)が結合する。ヒストンの場合、N末端テイルと呼ばれる特定の構造を持たない部分に存在するリシン残基の側鎖は、アセチル化酵素と脱アセチル化酵素による可逆的な酵素反応を介して、アセチル化修飾があるかないかの2状態のいずれかの状態として存在する。
4.転写、RNAポリメラーゼII
遺伝子DNAの塩基配列をRNAポリメラーゼが読み取り、2本鎖DNAの片方の塩基配列に対応するRNAを合成する反応を「転写」と呼ぶ。RNAポリメラーゼは、DNAを鋳型としてRNAを構成する基本単位のリボヌクレオチドを重合する酵素であり、原核生物では1種類のRNAポリメラーゼ、真核生物ではRNAポリメラーゼI、II、IIIの3種類が存在する。多くの遺伝子はその本体部分だけでは転写が起こらずに、遺伝子の上流または下流に転写反応を質的・量的に変化させるDNA配列が必要である。これらはその位置や機能に応じてエンハンサーやプロモーターと呼ばれる。
5.ヌクレオソーム、リンカーDNA
真核生物の細胞核内において、DNAとヒストン八量体が周期的に巻き付いて形成された複合体をヌクレオソームと呼ぶ。ヌクレオソームの中心部分は145~147塩基対のDNAにヒストン八量体が巻きついたコア粒子であり、通常はその両端にリンカーDNAと呼ばれる数十塩基対のDNAが存在する。
6.p300、CBP
p300とCBP(CREB結合タンパク質)は近縁のタンパク質であり、どちらも全長が2,400アミノ酸を超える巨大なタンパク質(ヒストンアセチル化酵素)である。分子内に多種類のドメインを持ち、300種類以上のタンパク質と相互作用する。とりわけ、DNA結合性の転写因子と結合するドメイン、ヒストンをアセチル化する酵素ドメイン、ヒストンのアセチル化を認識するドメイン(ブロモドメイン)などを持つ特徴があり、これらの機能を介して特定の遺伝子の転写を調節する。
7.N末端テイル
ヒストンのN末端領域は、特定の構造を持たないテイル(尾部)として溶液中で揺らいでいる。ヒストンテイルは、N末端側の1残基目から数えて5番目、8番目、12番目、16番目、20番目の5カ所のアミノ酸が塩基性のリシン残基(K)で構成される。この5カ所のリシン残基のうち、5番目、8番目、12番目、16番目の4カ所のリシン残基側鎖のアミノ基は、アセチル化修飾されると遺伝子発現の活性化と相関することが知られている。
8.真核生物、後生動物
真核生物は核膜で包まれた核やその他の小器官を持つ細胞から成る生物。ゲノムDNAはヌクレオソームを基本単位とする凝縮した構造を形成して、細胞周期の大部分を占める間期においては細胞核の中に収納された状態で存在する。代表的な生物として、単細胞の真核生物としては酵母が知られ、多細胞の真核生物としては線虫やマウス、ヒトなどが知られる。単細胞の原生動物以外の多細胞の動物は後生動物と呼ばれ、p300/CBPに相同なタンパク質を持っている。
9.原核生物
核膜で包まれた核を持たない細胞から成る生物。ゲノムDNAは細胞内にむき出しの状態で存在する。代表的な生物として大腸菌が知られている。
10.ブロモドメイン
110~120アミノ酸から成るタンパク質の折り畳み構造。この折り畳み構造の中心部分にくぼみを持ち、このくぼみを介してヒストンのN末端テイルなどに存在するリシン残基のアセチル化状態を特異的に認識できる。
11.エンハンサー
DNA上で特定の遺伝子(RNA)の転写を活性化するDNA塩基配列を含む領域。通常はそのDNA塩基配列を特異的に認識して結合できる転写因子(転写調節因子)を介して、遺伝子転写の活性化が導かれる。エンハンサーは遺伝子の転写開始位置から離れた場所に存在することが多い。DNAがループを形成することにより、エンハンサーが特定の遺伝子の転写開始位置に近接して、その転写を活性化すると考えられている。
12.プロモーター
DNA上で遺伝子(RNA)の転写が開始される位置の近くにあり、遺伝子を発現させる機能を持つ塩基配列。数多くの基本転写因子とRNAポリメラーゼがプロモーターに結合することで、遺伝子を転写する位置や転写する量が決まると考えられている。
13.無細胞タンパク質合成技術
大腸菌などの細胞内に存在する酵素や基質などを利用してタンパク質を合成する技術。大腸菌などの生きた細胞を使用しないため、細胞の毒性の問題がなくタンパク質を合成できる利点がある。本研究では、転写(DNAからRNAを合成する段階)と翻訳(RNAからタンパク質を合成する段階)の反応を同じ試験管の中で同時進行させる技術を用いた。
14.クライオ電子顕微鏡
冷却環境において電子線を分子に照射することで分子の立体構造を観察する装置。タンパク質などの生体分子を急速凍結して観察することで、生体分子の立体構造の情報を溶液環境に近い状態で取得できる。本研究では、8種類のp300/CBPとヌクレオソームの複合体の構造を3.2~4.8Å分解能で決定した。
15.DNAの副溝
DNAは二重らせん構造で成り立っており、それらは主溝と副溝と呼ばれる2種類の溝を構成している。主溝の幅は副溝より広いため、多くの転写因子はαヘリックスなどの構造体を主溝に結合させることでDNAの塩基配列を認識できる。副溝の幅は狭いため、DNAの副溝に結合するタンパク質の種類は限られている。
16.BRD4
ヒトの核内に存在する一部のタンパク質に共通して含まれるブロモドメインと余剰末端(Bromodomain and Extra-Terminal domain: BETドメイン)を持つタンパク質。BRD4のブロモドメインは、ヒストンH4が高度にアセチル化された状態を強く認識する。BRD4は多くのがん細胞で高発現して、腫瘍促進遺伝子の発現調節に関与する。
研究グループ
理化学研究所
生命機能科学研究センター
エピジェネティクス制御研究チーム(研究当時)
チームリーダー(研究当時)梅原 崇史(ウメハラ・タカシ)
(現 創薬タンパク質解析基盤ユニット 上級研究員)
研究員(研究当時)菊地 正樹(キクチ・マサキ)
技師(研究当時)森田 鋭(モリタ・サトシ)
技師(研究当時)若森 昌聡(ワカモリ・マサトシ)
技師(研究当時)佐藤 心(サトウ・シン)
タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(シロウズ・ミカコ)
専門技術員 内窪(加茂)友美(ウチクボ(カモ)・トモミ)
環境資源科学研究センター 技術基盤部門
副部門長 堂前 直(ドウマエ・ナオシ)
生命分子解析ユニット
専任技師 鈴木 健裕(スズキ・タケヒロ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、科学技術振興機構(JST)戦略的創造研究推進事業個人型研究(PRESTO、さきがけ)「細胞機能の構成的な理解と制御(研究領域総括:上田泰己)」の研究課題「『エピヌクレオソーム』の精密な再構成による遺伝子発現制御解析(研究代表者:梅原崇史)」、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(A)「DNAの物性から理解するゲノムモダリティ(領域代表者:西山朋子)」、同基盤研究(B)「がん細胞で頑強に維持される超アセチル化エピゲノムを操作する(研究代表者:梅原崇史)」、同若手研究「p300によるヌクレオソームアセチル化の構造基盤(研究代表者:菊地正樹)」などによる助成を受けて行われました。
原論文情報
Masaki Kikuchi, Satoshi Morita, Masatoshi Wakamori, Shin Sato, Tomomi Uchikubo-Kamo, Takehiro Suzuki, Naoshi Dohmae, Mikako Shirouzu and Takashi Umehara*, “Epigenetic mechanisms to propagate histone acetylation by p300/CBP”, Nature Communications, 10.1038/s41467-023-39735-4
発表者
理化学研究所
生命機能科学研究センター エピジェネティクス制御研究チーム(研究当時)
チームリーダー(研究当時)梅原 崇史(ウメハラ・タカシ)
(現 創薬タンパク質解析基盤ユニット 上級研究員)
研究員(研究当時)菊地 正樹(キクチ・マサキ)
技師(研究当時)森田 鋭(モリタ・サトシ)
タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(シロウズ・ミカコ)
環境資源科学研究センター 技術基盤部門
副部門長 堂前 直(ドウマエ・ナオシ)
報道担当
理化学研究所 広報室 報道担当