ターゲットとなりうる600遺伝子を発見
2019-05-07 京都大学
遊佐宏介 ウイルス・再生医科学研究所教授らの研究グループは、ゲノム編集技術CRISPR-Cas9を用いた遺伝子スクリーニング法を30がん種にわたる300以上のがん細胞株に適用し、新しい治療薬のターゲットとなる可能性のある約600遺伝子を発見しました。
この中から、大腸がんや胃がんの一部に見られるマイクロサテライト不安定性を示すがんが、その増殖にWRN遺伝子の働きに依存していることを見出しました。WRNタンパク質が持つヘリケース活性が重要な役割を示すことが明らかとなり、このWRNヘリケースの働きを抑える薬を開発することで、これらのがん種に対する新しい治療法を提供できるものと考えられます。
今回発見されたその他の候補遺伝子を詳しく解析することで、さらに有望な創薬ターゲット候補が見つかり、より多くの治療選択が可能となることが期待されます。
本研究成果は、2019年4月10日に、国際学術誌「Nature」のオンライン版に掲載されました。
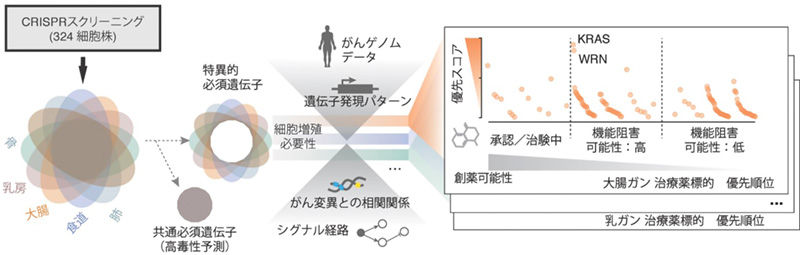
図:研究全体の流れ (Nature 2019より改変)
書誌情報
【DOI】 https://doi.org/10.1038/s41586-019-1103-9
Fiona M. Behan, Francesco Iorio, Gabriele Picco, Emanuel Gonçalves, Charlotte M. Beaver, Giorgia Migliardi, Rita Santos, Yanhua Rao, Francesco Sassi, Marika Pinnelli, Rizwan Ansari, Sarah Harper, David Adam Jackson, Rebecca McRae, Rachel Pooley, Piers Wilkinson, Dieudonne van der Meer, David Dow, Carolyn Buser-Doepner, Andrea Bertotti, Livio Trusolino, Euan A. Stronach, Julio Saez-Rodriguez, Kosuke Yusa & Mathew J. Garnett (2019). Prioritization of cancer therapeutic targets using CRISPR-Cas9 screens. Nature, 568, 511-516.
詳しい研究内容について
CRISPR スクリーニングによりがん治療薬候補を網羅的に同定
―ターゲットとなりうる 600 遺伝子を発見―
概要
京都大学ウイルス・再生医科学研究所 遊佐宏介 教授らの研究グループは、ゲノム編集技術 CRISPR-Cas9 を用いた遺伝子スクリーニング法を 30 がん種にわたる 300 以上のがん細胞株に適用し、新しい治療薬のター ゲットとなる可能性のある約 600 遺伝子を発見しました。この中から、大腸がんや胃がんの一部に見られるマ イクロサテライト不安定性を示すがんが、その増殖に WRN 遺伝子の働きに依存していることを見出しました。 WRN タンパク質が持つヘリケース活性が重要な役割を示すことが明らかとなり、この WRN ヘリケースの働 きを抑える薬を開発することで、これらのがん種に対する新しい治療法を提供できるものと考えられます。今 回発見されたその他の候補遺伝子を詳しく解析することで、さらに有望な創薬ターゲット候補が見つかり、よ り多くの治療選択が可能となることが期待されます。
本成果は、2019 年 4 月 10 日に英国の科学雑誌「Nature」にオンライン出版されました。
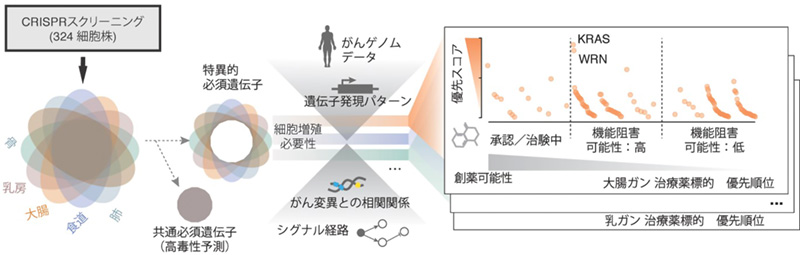
研究全体の流れ (Nature 2019 より改変)
1.背景
がんは過去約 40 年間日本人の死因第一位で、三大成人病と言われるがん、心疾患、脳血管疾患のうち、が んのみで死亡数、罹患率の上昇が続いています。がんの治療成績は年々向上していますが、この上昇は高齢化 に伴うもので、高齢者の絶対数の増加に伴い今後もこの傾向が続くと考えられます。がんの治療には、比較的 初期のがんには外科的切除が用いられますが、進行したがんには化学療法や放射線治療といった正常細胞をも 傷つけてしまう方法が主体です。また、がんを手術により切除した後にもこれらの治療法が補助療法として用 いられることもあります。近年、がん細胞の増殖や転移に関する遺伝子の理解が進み、これらに関わる遺伝子 産物の機能を特異的に抑制することで、がんの進行を止めようとする分子標的薬の開発 ・臨床応用が進んでい ます。がん細胞を狙い撃ちするため、正常細胞への毒性が従来の治療法に比べ少ない利点があります。これら に加え、現在ではがん免疫療法の導入も進んでいます。利点の多いがん分子標的薬ですが、その開発には 1 剤 あたり 200〜300 億円もの多額の費用と 10 年以上に及ぶ長い時間を必要とし、また 90%の新薬開発計画は途 中で中止されてしまうという非常に難しいものです。この主な理由の一つが期待された効果が臨床試験で得ら れないというものです。新薬開発の成功率を上げ、がん患者さんにより多くの新薬を届けるには、最初により 良い創薬標的を選定することが重要といえます。
2.研究手法・成果
我々の研究グループは、2014 年にゲノム編集技術 CRISPR-Cas9 を用いた全遺伝子スクリーニング法 (CRISPR スクリーニング法)を開発し、発表しました。これはヒトが持つたんぱく質をコードする全 2 万遺 伝子を個別に破壊し、その変異細胞が示す異常を調べる手法です。がん細胞株に適用することで、どの遺伝子 ががん細胞の増殖に必要であるのかを調べることができます。そして、増殖に必要な遺伝子の働きを止める薬 を作れば、がんの増殖を止めることができ、がんの治療薬となると考えられます。
今回、30 がん種にわたる 324 細胞株において CRISPR スクリーニングを実施し、各がん細胞株における細 胞の生存・増殖に必須の遺伝子のリストを得て、約 7000 個の遺伝子が少なくとも一つの細胞株の増殖に必要 であることが明らかとなりました。これらの遺伝子は全てその機能を抑制するとがん細胞の増殖を止められる 可能性がありますが、この膨大な候補の中から、毒性は低く、がん抑制効果は高く、また治療の対象となるが ん種がはっきりしている創薬の候補遺伝子を絞り込まなくてはいけません。
そこで、我々の研究グループでは今回得られたデータと過去に蓄積されたがんゲノムデータを使って様々な コンピューター解析を行い、解析結果を統合することで、より有用性の高いがん創薬ターゲットに優先順位を つけるシステムを構築しました(図1)。まず、がん種ごとに解析が行われ、各遺伝子に優先スコアがつけら れます。ここでは、① 共通必須遺伝子の同定、② がん変異遺伝子と細胞増殖に与える影響の相関関係の二点 が特に重要な解析となります。大多数の細胞株の増殖を止めてしまうような遺伝子は、細胞の基礎的活動へ作 用している可能性が高く、正常細胞への影響が懸念され、細胞毒性が高いことが予測されます。このような遺 伝子に対する創薬は避けたほうがいいと考えられます。一方、② の相関関係が明らかになると、ある特定の がん変異を有するがん患者さん (バイオマーカーを持つ患者さん)に高い効き目を示す薬を作ることが可能と なります。逆の言い方をすると、治療薬をどのがん患者さんに使えば高い効果が得られるかがわかり、適切な 処方を可能にします。最後に、こうして付けられた優先スコアと各遺伝子の創薬可能性(druggability あるい は tractability)を比較することで、どの遺伝子に対して創薬を行うのが適切であるかの情報を得ることができ ます。

図1 研究全体の流れ (Nature 2019 より改変)
これらの解析から得られた創薬優先順位の高い遺伝子の中に、Werner 症候群 RecQ ヘリケース (WRN) を 見出しました。この遺伝子はマイクロサテライト不安定性を示すがんにおいてのみ、がん細胞の増殖に必要で あることがわかりました (図2)。マイクロサテライト不安定性は、大腸がんの 15%、胃がんの 28%の他、卵 巣がん等でみられ、DNA 損傷修復経路の一つ、ミスマッチ修復に関わる遺伝子の変異が原因となっています。
解析を進めた結果、この依存性は WRN タンパク質が持つヘリケース活性によるものであることが明らかと なり、また、異種移植モデルにおいて WRN 遺伝子を破壊すると腫瘍の退縮が見られることが実験的に確認さ れ、WRN のヘリケース活性を阻害するような薬がマイクロサテライト不安定性を示すがんに対する分子標的 薬となる可能性が示されました。
我々が今回取得した各がん細胞株の必須遺伝子プロファイル、優先順位スコア等は全て専用のwebサイト (https://score.depmap.sanger.ac.uk/) から公開しており、世界中のがん研究者、製薬会社に有用な情報を 提供するものと考えられます。このデータの利用を通して、さらにがん細胞の増殖機構の科学的知見が得ら れ、新しい創薬につながることを研究チームは期待しています。
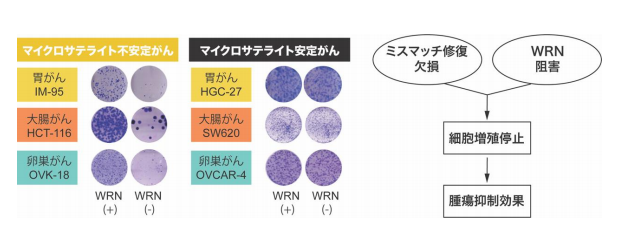
図2 マイクロサテライト不安定性を示すがん細胞株は、その増殖に WRN 遺伝子の働きを必要とする。マイクロサテラ イト不安定性の原因となるミスマッチ修復遺伝子の異常と WRN 遺伝子の機能阻害が合わさった時に細胞増殖が停止する ことから、正常細胞への影響は少ないと考えられる。
3.波及効果、今後の予定
今回の研究より、マイクロサテライト不安定性を示すがんに WRN 阻害剤が有効である可能性が示され、今 後、創薬プロセスが開始され、将来、新しい治療薬が開発されるものと期待されます。マイクロサテライト不 安定性を示すがんに対しては、免疫チェックポイント阻害剤(抗 PD-1 や抗 PD-L1 抗体)の有効性が示され ていますが、またその効き目は 100%でないこともいわれています。WRN 阻害剤は、こうした免疫チェックポ イント阻害剤との併用や、効き目が弱い患者さんへの選択薬になる可能性があると考えられます。
また、WRN 以外にも多数の創薬候補が明らかとなっています。今後、大規模データから得られた候補を個々 に検証し、どのような活性ががん細胞の増殖に必要なのかを明らかにし、創薬ストラテジーを立てる必要があ ります。また、細胞増殖をどのようなメカニズムで支えているのか基礎的な研究を進めていくことも、薬の作 用点を理解する上で重要です。
このように新しい創薬のターゲットを探す上で強力なツールとなる CRISPR スクリーニングですが、そのデ ータの有効性はどのようながん細胞株を使ったかに依存します。既存の研究によく使われるがん細胞株は実際 のがん患者さんに見られるすべてのがん変異を反映したものとはなっていません。そのため、まだ見落として いる有用性の高い創薬候補がある可能性があります。今後、新しいがん細胞株を作成し、さらに CRISPR スク リーニングを進めていくことが、さらに新しい創薬候補を見つける上で重要です。
4.研究プロジェクトについて
本研究は、OpenTarget (OTAR015 研究代表者:遊佐宏介, Mathew Garnette, Jurio Saez-Rodriguez)、 Wellcome Trust (研究代表者:遊佐宏介, Mathew Garnette)、SU2C(研究代表者:Mathew Garnette)など の支援を受けて実施されました。
<用語解説>
マイクロサテライト不安定性:DNA 損傷修復システムの一つ、ミスマッチ修復機構の破綻により引き起こさ れる異常の一つ。ゲノム DNA には GT のように2塩基が複数回繰り返している部分がある。正常細胞ではそ の反復回数は正確に複製されるが、ミスマッチ修復異常細胞では反復回数の増加がみられ、これをマイクロサ テライト不安定性という。
ヘリケース活性:対合した DNA や RNA をほどく酵素活性。例えば、DNA は二本の鎖がらせん状につながっ た構造をしていて、両鎖の間では相補な塩基が水素結合により対合している。DNA の複製や RNA の転写時、 二本鎖を解く必要があるが、自然にはほどくことがでない。そこで、ヘリケース活性を有する酵素が DNA 二 重らせんをほどき、他の酵素が DNA にアクセスできるようにしている。
<研究者のコメント>
CRISPR スクリーニング法を開発できたことで、このような 300 細胞株以上という大規模な遺伝子スクリー ニングを高い検出感度をもって実施することができました。これまでに臨床応用されている cell-intrinsic な 作用により効果を発揮する分子標的薬のターゲットはほぼ同定されており、我々の方法の検出感度の高さを示 しています。このデータを元に、新しいがん治療法の開発につなげていくための研究を進めたいと考えています。
<論文タイトルと著者>
タイトル:Prioritization of cancer therapeutic targets using CRISPR-Cas9 screens CRISPR-Cas9 スクリーニングを用いたがん治療標的の優先順位づけ
著 者:Fiona M. Behan, Francesco Iorio, Gabriele Picco, Emanuel Gonçalves, Charlotte M. Beaver, Giorgia Migliardi, Rita Santos, Yanhua Rao, Francesco Sassi, Marika Pinnelli, Rizwan Ansari, Sarah Harper, David Adam Jackson, Rebecca McRae, Rachel Pooley, Piers Wilkinson, Dieudonne van der Meer, David Dow, Carolyn BuserDoepner, Andrea Bertotti, Livio Trusolino, Euan A. Stronach, Julio SaezRodriguez, Kosuke Yusa, Mathew J. Garnett
掲 載 誌:Nature
DOI:doi.org/10.1038/s41586-019-1103-9