2022-06-09 東京大学,日本医療研究開発機構
発表者
候 聡志(東京大学大学院医学系研究科重症心不全治療開発講座/東京大学医学部附属病院循環器内科 特任助教)
野村 征太郎(東京大学大学院医学系研究科重症心不全治療開発講座/東京大学医学部附属病院循環器内科 特任助教)
山田 臣太郎(東京大学医学部附属病院循環器内科 特任研究員)
油谷 浩幸(東京大学 名誉教授)
小室 一成(東京大学大学院医学系研究科循環器内科学/東京大学医学部附属病院循環器内科 教授)
発表のポイント
- 心臓にある線維芽細胞はHtra3という遺伝子を介してタンパク質TGF-βを分解することによって過度に線維化促進が起こらないよう恒常性を維持し、間接的に心筋細胞にも影響して心不全の発症に関与することを明らかにしました。
- 心臓を保護する因子としてHtra3を新しく発見したほか、心不全患者の心筋細胞が分泌するタンパク質IGFBP7を評価することで心不全の重症度の予測に役立つことを明らかにしました。
- 本研究成果は、線維芽細胞と心筋細胞の間の相互作用に基づいた新しい心不全治療法の開発や心不全患者の重症度や予後を予測する手法の開発に貢献すると考えられます。
発表概要
社会の高齢化が進む中、日本のみならず先進国では軒並み慢性心不全(注1)の患者数が増加し続けています。長年の治療開発の進歩にもかかわらず、慢性心不全の治療成績は依然として悪性腫瘍と同等ないしはそれ以上に悪いことが知られています。この度、東京大学医学部附属病院 循環器内科の候聡志特任助教、野村征太郎特任助教、山田臣太郎特任研究員、小室一成教授、奈良先端科学技術大学院大学先端科学技術研究科の岡千緒助教、東京大学先端科学技術研究センターの油谷浩幸名誉教授らの研究グループは、心臓にある線維芽細胞(注2)と心筋細胞の相互作用に着目して解析することで、線維芽細胞に存在するHtra3というタンパク質の働きが失われると、心臓に負担がかかった時に線維芽細胞や心筋細胞に異常が生じて心不全が悪化すること、また異常になった心筋細胞が分泌する様々なタンパク質のうちIGFBP7を定量評価することで心不全患者の重症度予測(注3)に役立つことを世界で初めて発見しました。今回の研究結果により、心不全に対する新しい治療法や心不全患者の予後予測手法の開発へつながることが期待されます。
本研究結果は2022年6月7日に英国科学雑誌Nature Communicationsにて発表されました。なお、本研究は、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(PRIME)「心臓ストレス応答における個体シングルセル四次元ダイナミクス」(研究開発代表者:野村征太郎)、ゲノム医療実現バイオバンク利活用プログラム:B-cure(ゲノム医療実現推進プラットフォーム・先端ゲノム研究開発:GRIFIN)事業「マルチオミックス連関による循環器疾患における次世代型精密医療の実現(研究開発代表者:小室一成)」、革新的先端研究開発支援事業(AMED-CREST)「心筋メカノバイオロジー機構の解明による心不全治療法の開発」(研究開発代表者:小室一成)、日本学術振興会科学研究費助成事業 基盤研究S「非分裂細胞である心筋細胞のDNA損傷と老化による心不全発症機序の解明と応用(21H05045,研究代表者:小室一成)」、日本学術振興会科学研究費助成事業 基盤研究A「複合的アプローチによる心臓システム構造の統合的理解とその制御(22H00471,研究代表者:野村征太郎)」、日本学術振興会科学研究費助成事業若手研究「心筋梗塞後組織修復及びリモデリングにおける一細胞レベル病態ダイナミクスの解明(19K17587,研究代表者:候聡志)」等の支援により行われました。
発表内容
研究の背景
近年、世界的に心不全患者は増加の一途を辿っており、高齢化の影響もあって患者数は2030年には米国で約800万人、日本で約130万人に達すると推計されています。様々な内科的・外科的治療が試みられていますが、依然として心不全患者の生存率は悪く、通常、心不全と診断されてから5年間の死亡率は約50%であると考えられています。これまでの心不全の研究では、心筋細胞など特定の種類の細胞を対象とした解析がなされてきましたが、心不全の発症や進展の過程で、心臓内にある異なる種類の細胞間の相互作用に着目した研究はほとんどありませんでした。
研究の内容
研究グループはシングルセル解析(注4)という手法を用いてマウス心臓内に存在する様々な細胞集団の網羅的遺伝子発現解析(注4)を行ったところ、特に心臓線維芽細胞と心筋細胞間でシグナルのやり取り(相互作用)が多いことが分かり、心臓のポンプ機能を司る心筋細胞は線維芽細胞から影響を受けていると考えられました。次に心臓線維芽細胞の遺伝子発現解析から、機能未知の遺伝子であるHtra3を見出し、そのノックアウトマウス(注5)を作成して解析した結果、Htra3の働きがなくなることで、圧負荷や心筋梗塞など、様々な負荷が心臓に加わった時に重症の心不全に陥ることが分かりました。そのメカニズムとして、Htra3の働きがなくなることにより、本来Htra3によって分解されるはずのTGF-β(注6)というタンパク質が増えることで、線維芽細胞自身がたくさん線維を作って心臓を硬くしてしまうほか、TGF-βによって心筋細胞内で誘導されるNox4というタンパク質によって酸化ストレスが増してDNAが損傷されるなど、間接的に心筋細胞も影響を受けてその性質が変化することが明らかとなりました(図参照)。反対にHtra3を過剰発現(注5)させてその働きを強めると、心不全改善効果があることも分かりました。また興味深いことに、心不全に際して性質が変化してしまった心筋細胞では沢山の種類のタンパク質を分泌することがわかり、健常者及び様々な重症度の心不全患者の血清中のタンパク質の解析データを検証した結果、こうした心不全心筋細胞が分泌するタンパク質のうちで特にIGFBP7は心不全の重症度を予測する高精度なバイオマーカーとなることが明らかになりました。
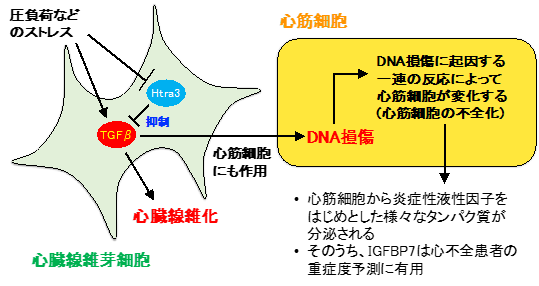
図 心臓線維芽細胞はHtra3を介して自身及び心筋細胞に影響を与える心臓にある線維芽細胞はHtra3によって自身の恒常性を維持し、間接的に心筋細胞にも影響を与えることが明らかになり、新たな心不全治療法の開発や予後予測に寄与すると期待される。
本研究の社会的意義と今後の予定
本研究で見出したHtra3は、それを産生する心臓線維芽細胞自身のみならず、TGF-βシグナルの調整を介して間接的に心筋細胞にも影響を与えており、心不全治療における新しい標的分子として期待されます。また、本研究で解析した心不全患者の血清中タンパク質のうち、IGFBP7は患者の重症度の予測に有用であることがわかりました。今後はIGFBP7の働きを解明して、どのように心不全の発症や進展に関与していくのかを明らかにしていくことを目指します。
発表雑誌
- 雑誌名
- 「Nature Communications」(オンライン版:2022年6月7日)
- 論文タイトル
- Cardiac fibroblasts regulate the development of heart failure via Htra3-TGF-β-IGFBP7 axis
- 著者
- Toshiyuki Ko, Seitaro Nomura*, Shintaro Yamada, Kanna Fujita, Takanori Fujita, Masahiro Satoh, Chio Oka, Manami Katoh, Masamichi Ito, Mikako Katagiri, Tatsuro Sassa, Bo Zhang, Satoshi Hatsuse, Takanobu Yamada, Mutsuo Harada, Haruhiro Toko, Eisuke Amiya, Masaru Hatano, Osamu Kinoshita, Kan Nawata, Hiroyuki Abe, Tetsuo Ushiku, Minoru Ono, Masashi Ikeuchi, Hiroyuki Morita, Hiroyuki Aburatani*, Issei Komuro*
- DOI番号
- 10.1038/s41467-022-30630-y
- アブストラクトURL
- https://rdcu.be/cO9Gm
用語解説
- (注1)慢性心不全
- 心不全とは、心臓の機能が低下することで息切れやむくみを来たし、寿命を縮める病気です。心臓の機能が低下する原因は多岐にわたりますが、心不全が突然発症する場合や症状が急激に悪化した場合を“急性心不全”、心臓の機能が低下した状態が続き、症状や容態が安定ないしは徐々に進行している場合を“慢性心不全”と言います。心不全の治療は個々の患者さんの病状に応じて内科的治療(薬物治療)やカテーテル治療、デバイス治療、外科的治療(手術治療)などが行われますが、それでも通常は徐々に心機能や容態が悪化していくことが多いのが現状です。
- (注2)線維芽細胞
- 心臓は収縮を行うことでポンプ機能を直接担う心筋細胞のほか、血管の細胞や免疫細胞など、様々な種類の細胞によって構成されています。この中で、心臓線維芽細胞は細胞同士の結合に関わるコラーゲンなどの線維物質など、様々なタンパク質を分泌し、細胞数としては心臓内で最も数が多い細胞種です。心不全などの病態では心筋細胞数の減少に伴い心臓線維芽細胞が増殖して線維を沢山分泌し、心不全を一層悪化させることが知られています。
- (注3)重症度予測
- 前述のように心不全の治療は多岐にわたりますが、治療への反応性や病状の経過は患者さん一人一人で大きく異なります。このような治療に対する効果や病状の経過を前もって評価(=重症度・予後予測)することができれば、適切な治療戦略の選択や医療資源の節約につながると期待されます。
- (注4)シングルセル解析(Single-cell RNA sequencing)・網羅的遺伝子発現解析
- 生命活動を担うために、生体を構成する細胞は必要に応じてタンパク質の設計図である遺伝子を基にメッセンジャーRNAと呼ばれる物質を作ります。こうした全てのメッセンジャーRNAの情報を次世代シークエンサーと呼ばれる機器を用いて調べることを網羅的遺伝子発現解析と呼び、本研究では特に細胞一つ一つを区別して網羅的遺伝子発現解析を行ったことから、シングルセル解析(Single-cell RNA sequencing)と呼びます。すなわち、シングルセル解析では一つの細胞に含まれる全てのメッセンジャーRNAの量を解析する手法となります。
- (注5)ノックアウトマウス、過剰発現
- ノックアウトマウスとは、遺伝子操作によって、特定の遺伝子の配列部分を欠損させてその働きをなくした(ノックアウト)マウスです。逆に特定の遺伝子の働きを過剰に(強制的に)強くすることを過剰発現と言います。このような遺伝子操作手法を用いることで、特定の遺伝子の機能やその 遺伝子に起因する生体内の変化を知ることができます。
- (注6)TGF-β
- 正式名称をTransforming growth factor-βと言い、細胞に作用して細胞増殖、細胞死、細胞分化、免疫調節、細胞運動等多彩な生理作用を及ぼす分泌タンパク質(サイトカイン)である。様々な細胞がTGF-βを産生し、作用する細胞に応じてその効果が異なることが多いが、TGF-βを産生する最も代表的な細胞種は線維芽細胞である。通常では線維芽細胞が産生するTGF-βは線維化を促進することで傷の修復など、生理的に大事な役割を果たしているが、一方で様々な病気ではTGF-βの作用が強すぎることで過剰な線維化や炎症が生じて組織に害をなすことも知られており、そのバランス調整についてはまだ完全に解明されているわけではない。
お問い合わせ先
研究内容に関するお問い合わせ先
東京大学医学部附属病院循環器内科
教授 小室 一成(こむろ いっせい)
東京大学医学部附属病院 循環器内科/重症心不全治療開発講座
特任助教 野村 征太郎(のむら せいたろう)
東京大学医学部附属病院 循環器内科/重症心不全治療開発講座
特任助教 候 聡志(こう としゆき)
取材・報道に関するお問い合わせ先
東京大学医学部附属病院 パブリック・リレーションセンター
担当:渡部、小岩井
AMED事業に関するお問い合わせ先
革新的先端研究開発支援事業について
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
ゲノム医療実現バイオバンク利活用プログラム:B-cure(ゲノム医療実現推進プラットフォーム・先端ゲノム研究開発:GRIFIN)について
日本医療研究開発機構(AMED)
ゲノム・データ基盤事業部 ゲノム医療基盤研究開発課