2023-02-09 理化学研究所
理化学研究所(理研)生命機能科学研究センター 転写制御構造生物学研究チームの関根 俊一 チームリーダー、村山 祐子 研究員らの研究チームは、転写中のRNAポリメラーゼ(RNAP)[1]に、「転写終結[2]」を促進する因子である「Rho[2]」が結合した複合体の立体構造を明らかにしました。
本研究成果は、RNAPによる転写(遺伝子の読み取り)の最終段階であり、遺伝子発現の適切な制御に重要な役割を担う転写終結のメカニズムの理解に貢献すると期待できます。
RNAPは全ての生物において遺伝情報の転写をつかさどる、巨大なタンパク質複合体です。転写の最終段階が、転写を終えたRNAPが鋳型DNAや新生RNAから解離して転写装置を解体する転写終結です。Rhoはこの反応を促進するタンパク質として50年以上前に発見されましたが、転写終結の仕組みは謎でした。
今回、研究チームは、細菌(細胞核を持たない原核生物)に広く保存された転写終結因子Rhoが転写中のRNAPに結合した複合体の立体構造を、クライオ電子顕微鏡[3]を用いた構造解析により明らかにしました。RhoはRNAPのRNA送出トンネル[4]を覆うように結合しており、新生RNAはRNA送出トンネルから一続きとなったRhoのRNA結合トンネルへと送り出されていました。今回決定された構造は、転写終結因子がRNAPに結合して転写終結を促す姿を初めて捉えたものです。
本研究は、科学雑誌『Science Advances』オンライン版(2月8日付:日本時間2月9日)に掲載されました。
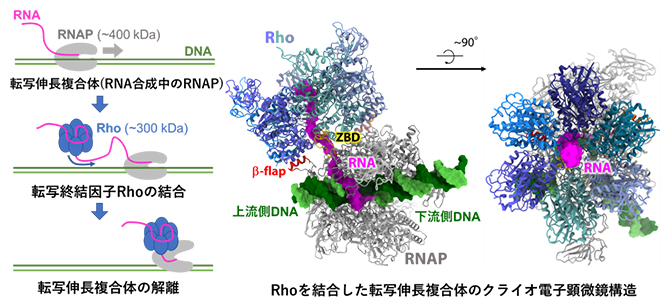
Rho依存的転写終結の模式図と、Rhoを結合した転写伸長複合体のクライオ電子顕微鏡構造
背景
RNAポリメラーゼ(RNAP)は巨大なタンパク質複合体(分子量約400kDa[5])で、DNA上の遺伝情報をRNAへと転写する役割を担っています。転写は、DNA上の特定の領域を正確に読み取る必要があり、RNAPが特定の場所から読み取りを開始し、特定の場所で終了することで、初めて正しい長さのRNAが転写されます。転写の最終段階で、転写中のRNAP(転写伸長複合体[4])はRNA合成を停止し、鋳型DNAおよび新生RNAを解離します(図1)。この過程は「転写終結」と呼ばれ、遺伝子の末端や境界を正確に決定し、遺伝子発現を適切に制御するために重要です。
「Rho」は細菌(細胞核を持たない原核生物)に広く保存されたタンパク質で、多くの遺伝子において転写終結を促進し、正確な長さのRNAの合成に寄与するほか、何らかの理由で翻訳されてないメッセンジャーRNA(mRNA)の転写を中止させるなど、細胞の恒常性維持にも関わっています。Rhoはリング型の六量体(分子量約300kDa)を形成し、転写伸長複合体から送り出されてくる新生RNAに結合します(図1B)。その後Rhoは転写伸長複合体に相互作用し、ATP[6]依存的に転写終結を引き起こすことが知られていますが(図1C)、その具体的なメカニズムは明らかになっていませんでした。
本研究では、クライオ電子顕微鏡を用いた構造生物学的解析により、Rho依存的転写終結がどのように起きるのかの解明を試みました。
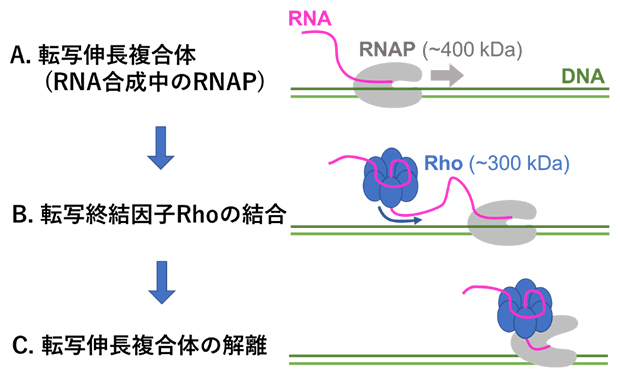
図1 Rho依存的転写終結の模式図
A.RNAポリメラーゼ(RNAP)は鋳型DNA(緑)および新生RNA(ピンク)と転写伸長複合体を形成し、DNA上を図の右方向に向かって移動しながらRNAを合成する。
B.転写終結因子Rhoは、自身のリングの中央にあるRNA結合トンネルに新生RNAを通す形で結合し、新生RNA上を転写伸長複合体を追いかけるように移動する。
C.Rhoが転写伸長複合体に追いつくと、転写伸長複合体の解離が引き起こされる。
研究手法と成果
研究チームは、まずRho依存的転写終結を試験管内で再現するための実験系を確立しました。Rhoは転写伸長複合体から送り出された新生RNAを介して転写中のRNAPに動員されますが、効率よくRhoをRNAPに結合させるためには100ヌクレオチド程度の長いRNAが必要となります。本研究ではRNAPに実際に転写を行わせることで、このような長いRNAを持つ転写伸長複合体を調製しました(図2A)。この実験系でRho依存的転写終結が確かに起きているかを調べるため、磁気ビーズに固定したDNA上で転写を行わせ、そこにRhoおよびATPを加えました。すると、Rhoの働きで転写伸長複合体が解体され、RNAが磁気ビーズから溶液中へと放出されるのが確認できました(図2B)。
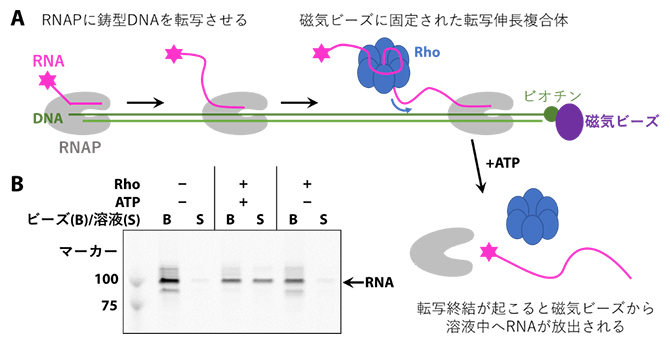
図2 Rho依存的転写終結を再現した実験系
A.Rho依存的転写終結を再現した実験系の模式図。磁気ビーズに固定した鋳型DNA上で転写反応を行い、約120ヌクレオチドのRNAを含む転写伸長複合体を調製した。この転写伸長複合体にRhoおよびATPを加えると、RNAが鋳型DNAから解離し、溶液中に放出される。
B.ビーズ画分(B)と溶液画分(S)に含まれるRNAを、ポリアクリルアミドゲル電気泳動により分析した。RhoとATPの両方を加えたときにのみ、溶液画分にRNAが放出される。
次に、この転写伸長複合体にRhoを加えた試料を用いて、クライオ電子顕微鏡による構造解析を行いました。Rhoの六量体は、転写伸長複合体のRNAの出口の部分を取り囲むように結合していました(図3)。その結果、転写伸長複合体のRNA送出トンネルとRho六量体の中央にあるRNA結合トンネルが一続きのRNAの通り道となっていました。
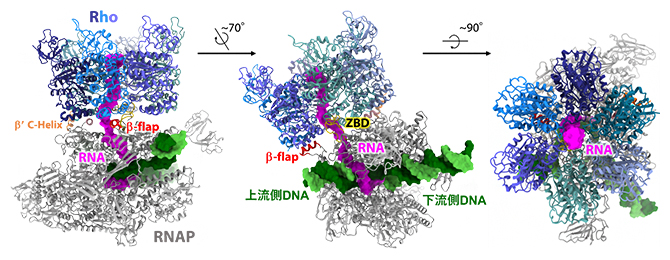
図3 Rhoを結合した転写伸長複合体の立体構造
Rhoを結合した転写伸長複合体の構造モデルを三つの向きから示す。左は、RNAPから出ていくDNAの側(上流側DNA)から見た図、中央は、RNAPの活性部位(RNAが作られる部位)を正面から見た図、右は、新生RNAが送り出される側から見た図。DNA(鋳型鎖:緑色、非鋳型鎖:黄緑色)およびRNA(マゼンタ)を表面モデルで、Rho(青色系統でサブユニットごとに色分け)およびRNAP(灰色)をリボンモデルで表現した。Rhoと直接結合しているRNAPの部位(β-flap、ZBD、βʹ C-helix)を色分けしている。
RhoとRNAPのどの部位の結合が重要なのかを探るため、RNA送出トンネル付近に変異を導入したRNAPを作製し、Rho依存的RNA放出活性への影響を調べました。その結果、RNA送出トンネルの一部を形成するβ-flapと呼ばれる部位の先端部分が、Rho依存的なRNA放出に重要であることが示されました(図4)。
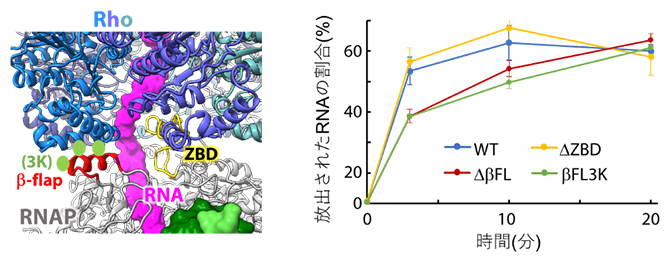
図4 RNAP変異体を用いたRho依存RNA放出実験
Rhoとの結合部位に変異を導入したRNAPを用いて、図2と同様のRNA放出実験を行った。ZBD(黄色)を欠失させたRNAP(ΔZBD)は野生型RNAP(WT)と同程度のRNA放出活性を示したが、β-flapの先端部分(赤色)を欠失させたRNAP(ΔβFL)はRNA放出活性が低下した。β-flap先端の三つのアミノ酸残基(Rhoに直接結合すると思われる残基;黄緑色)をリジン残基に置換した変異体(βFL3K)は、欠失変異体(ΔβFL)とほぼ同等のRNA放出活性を示したことから、β-flap先端とRhoの相互作用がRNA放出活性に重要であることが示された。
RNAPは「カニのはさみ」のような全体構造をしており、中央の溝にDNAとRNAを挟むように結合します。今回決定された構造は、転写伸長複合体にRhoが追いついた直後の状態を再現しており、RNAPの「はさみ」は閉じた状態でDNAとRNAをしっかりとつかんでいます(図5左)。RhoはATPのエネルギーを使ってRNAを引っ張る活性を持っており、RNAPに取り付いて新生RNAを引き抜くと考えられています。このとき、RNAPのはさみは開いた状態となり(図5右)、DNAが外れて転写伸長複合体の解体が促されると考えられます。
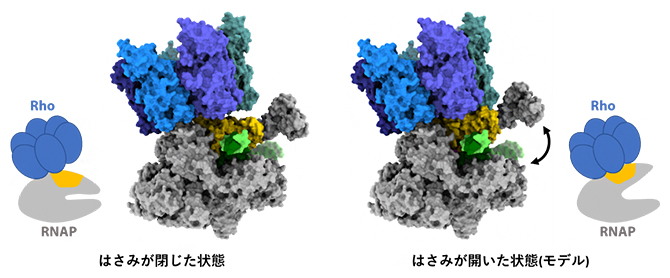
図5 RNAPの「はさみ」が開いた状態の構造モデル
今回決定された「はさみ」が閉じた状態の構造(左)をもとに、RNAP部分を「はさみ」が開いた状態のものに差し替えた構造モデル(右)を作製した。「はさみ」が開くと、RNAPの黄色で示した部分がRhoの底の部分にフィットし、挟まれた状態のDNA(緑色)が外れるようになると考えられる。
細胞核がない細菌では、RNAPによって転写されたmRNAは直ちにリボソーム[7]によって翻訳されます。つまり、転写と翻訳が同時に同所で起きるわけで、これは「転写翻訳共役[8]」と呼ばれ、リボソームとRNAPが直接相互作用しています。今回解明された構造において、RhoのRNAPへの結合部位はリボソームの結合部位とは重なっており、両者は同時にRNAPに結合できないことが分かります(図6A)。このことから、翻訳中のmRNAにはRhoが結合せず、翻訳が停止するとRhoの結合部位が露出して転写終結が引き起こされる、という転写終結と翻訳の協調の仕組みをうまく説明することができます(図6B)。
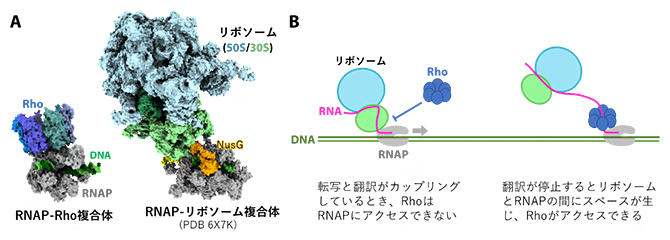
図6 リボソームとRhoのRNAPへの結合は互いに排他的
A.今回決定されたRNAP-Rho複合体と、転写翻訳カップリング中のRNAP-リボソーム複合体(PDB 6X7K)の構造の構造比較。Rhoとリボソームは共にRNAPのRNA送出トンネル付近に結合する。
B.転写終結と翻訳が協調する仕組み。転写翻訳カップリング中はリボソームがRNAPと新生RNAを覆っているため、Rhoは転写伸長複合体にアクセスできず、転写終結が抑制されている。翻訳が停止すると転写伸長複合体とリボソームの間にスペースが生じてRNAPと新生RNAが露出し、Rhoがアクセスできるようになり、Rhoは転写を終結させる。
今後の期待
Rhoの機能については約50年にわたって研究されてきましたが、Rhoがどのような結合様式でRNAPや新生RNAに結合し、転写終結を引き起こすのかについては明らかになっていませんでした。本研究は、Rhoが新生RNAを介して転写中のRNAPに結合した姿を初めて捉えたもので、転写終結という細胞の基本的なプロセスの理解に大きく貢献すると期待できます。
また、Rho依存的転写終結は翻訳や転写の制御をはじめとするさまざまな細胞内プロセスと協調して行われています。細胞はこれらのプロセスを状況に応じて調節しながら実行することでその機能を維持しており、本研究はその仕組みの理解を推し進めるものです。
補足説明
1.RNAポリメラーゼ(RNAP)
DNA配列を鋳型にしてRNAが合成されることを転写と呼び、細胞内ではDNA依存性RNAポリメラーゼ(RNAポリメラーゼ)により行われる。RNAポリメラーゼは複数のタンパク質(サブユニット)が集合してできた巨大な複合体(分子量約400kDa)で、細菌からヒトまで共通した”カニのはさみ”のような形をしている。なお、原核生物はRNAポリメラーゼを1種持つのに対し、真核生物は3種類のRNAポリメラーゼが異なる種類のRNAの合成を分担する。
2.転写終結、Rho
転写終結は転写を終えたRNAPが鋳型DNAや新生RNAから解離し、転写装置が解体されること。Rhoは大腸菌の転写終結因子として1969年に報告され、RNAの乖離(release)を促進することからギリシャ文字のρ(ラテンアルファベットRの由来。英語発音はrho、日本語ではロー)があてられた。
3.クライオ電子顕微鏡
タンパク質などの生体試料を観察するために開発された電子顕微鏡。タンパク質などの試料を含んだ溶液を薄く展開し、液体エタン(-183~-160℃)中で急速凍結して試料をごく薄い氷の層に閉じ込めた上、液体窒素温度(-196℃)で電子顕微鏡により観察する。タンパク質試料を生理的な(細胞の状態に近い)条件で観察できる、低温のため電子線による試料の損傷が軽減される、といった利点がある。近年著しい発展を見せている構造解析技術であり、2017年のノーベル化学賞の対象ともなった。
4.RNA送出トンネル、転写伸長複合体
転写の過程においてRNAPは、転写伸長に必要なさまざまなタンパク質と結合した巨大な複合体となって機能する。このタンパク質複合体にさらに鋳型DNAと新生RNAが結合している状態が、細胞内の転写反応の真の姿と考えられ、これを転写伸長複合体と呼ぶ。関根チームリーダーらの先行研究注)では、転写伸長複合体には、新生RNAの効率的な排出を促進する構造が存在することを解明し、これをRNA送出トンネルと名付けた。
注)2017年8月4日プレスリリース「転写中のRNAポリメラーゼIIの構造を解明」
5.Da
原子や分子の質量を表す単位でダルトンと読む。炭素12(12C)の質量の12分の1が1ダルトン(1Da)と定義される。
6.ATP
生物全般に存在するリン酸化合物の一つで、塩基と糖が結合した化合物(ヌクレオシド)に三つのリン酸が結合していることから、アデノシン三リン酸と呼ばれている。加水分解により一つのリン酸が解離すると、アデノシン二リン酸(ADP)となり、この反応で得られたエネルギーはさまざまなタンパク質機能に利用される。なお本研究では、Rhoと結合するがその後の反応を進ませないATP類似分子(ADPoBeF3)を実験系に加えることで、新生RNAが遊離しない状態の転写伸長複合体を調製し、クライオ電子顕微鏡観察に用いた。
7.リボソーム
リボソームRNA(rRNA)とリボソームタンパク質から構成される超巨大複合体。リボソームはメッセンジャーRNA(mRNA)にコードされているコドンを読み取り、タンパク質を合成する。真核細胞のリボソームは小胞体膜に結合したものと遊離した状態のものが存在するが、原核生物は遊離したリボソームである。
8.転写翻訳共役
真核生物では、核内で合成されたメッセンジャーRNA(mRNA)は核外に輸送され、細胞質のRNAで翻訳される。一方核を持たない原核生物では、転写がまだ進んでいるRNAにリボソームが結合し、転写と翻訳が同時(同所)に起きることが知られており、これを転写翻訳共役と呼ぶ。
研究チーム
理化学研究所 生命機能科学研究センター
転写制御構造生物学研究チーム
チームリーダー 関根 俊一(セキネ・シュンイチ)
研究員 村山 祐子(ムラヤマ・ユウコ)
研究員 江原 晴彦(エハラ・ハルヒコ)
テクニカルスタッフⅠ 青木 真理(アオキ・マリ)
テクニカルスタッフⅠ 五島 美絵(ゴトウ・ミエ)
タンパク質機能・構造研究チーム
研究員(研究当時、現 客員研究員)横山 武司(ヨコヤマ・タケシ)
(現 東北大学 生命科学研究科 助教)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業基盤研究(S)「転写と中核的な生命機能を結びつける高次複合体の構造基盤(研究代表者:関根俊一)」、同若手研究(B)「RNAポリメラーゼによる転写終結メカニズムの解明(研究代表者:村山祐子)」による助成を受けて行われました。
原論文情報
Yuko Murayama, Haruhiko Ehara, Mari Aoki, Mie Goto, Takeshi Yokoyama, and Shun-ichi Sekine, “Structural basis of the transcription termination factor Rho engagement with transcribing RNA polymerase from Thermus thermophilus”, Science Advances, 10.1126/sciadv.ade7093
発表者
理化学研究所
生命機能科学研究センター 転写制御構造生物学研究チーム
チームリーダー 関根 俊一(セキネ・シュンイチ)
研究員 村山 祐子(ムラヤマ・ユウコ)
報道担当
理化学研究所 広報室 報道担当