2021-09-08 京都大学
本研究の概要図
概要
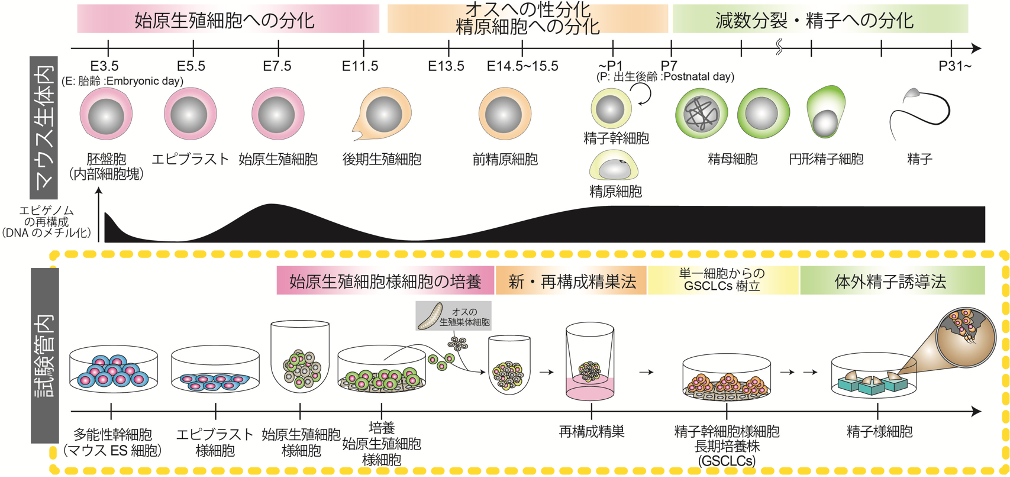
京都大学高等研究院 ヒト生物学高等研究拠点(WPI-ASHBi)の斎藤通紀 拠点長/主任研究者/教授(兼:同大学院医学研究科 教授)、同大学院医学研究科 石藏友紀子 特定研究員、および横浜市立大学大学院医学研究科臓器再生医学 小川毅彦 教授、佐藤卓也 同助教らの研究グループは、マウス多能性幹細胞(ES細胞)注1から、雄の生殖細胞の全分化過程を試験管内で再現することに成功しました。
本研究グループは、これまで、ES細胞から始原生殖細胞様細胞注2を誘導し、再構成精巣法注3を用いて、精子の元である精子幹細胞様細胞注4の長期培養株Germline stem cell-like cells (GSCLCs)を誘導することに成功してきました。次の目標として、再構成精巣法をさらに改善し、培養の途中過程を生体における雄性生殖細胞の発生過程により近づけること、GSCLCsからオスの配偶子である精子まで体外培養にて遂行させることを目指しました。
本研究では、前述の課題を解決するため、使用する細胞株の選定、培養で用いる細胞と培養条件の改善、1細胞由来のGSCLCsを樹立することによる細胞集団の不均一性の排除、を組み合わせることで、培養過程と誘導した細胞を、より詳細に解析する技術を確立しました。また、小川教授らが確立した体外精子誘導法注5と組み合わせることで、ES細胞由来のGSCLCsを、試験管内で健常な産仔に寄与する精子まで誘導することに、世界で初めて成功しました。これにより、ES細胞から精子まで、雄性生殖細胞系列の全分化過程について、試験管内で再構成することを達成しました。
本研究成果は、2021年9月8日に国際学術誌『Cell Stem Cell』のオンライン速報版で公開されます。
1.背景
生殖細胞は、哺乳類の体を構成する細胞の中で、次世代へと受け継がれ、新たな個体をつくり出すことが可能な唯一の細胞です。生殖細胞内の遺伝物質は、その細胞系列の中で減数分裂により多様性を付与されつつ、次世代の個体発生に十分な能力を持っています。生殖細胞系列の発生・分化には性分化をはじめ、エピゲノム情報の再構成注6、そして減数分裂注7など、さまざまな特徴的な過程が含まれます。いうなれば、生殖細胞は、種を維持し、進化させる原動力なのです。
この発生過程のメカニズムにアプローチするため、多能性幹細胞から生殖細胞系列の細胞を試験管内で誘導する試みが、四半世紀に渡って行われてきました。2011年、多能性幹細胞から精子や卵子の元となる始原生殖細胞注8を誘導する手法が確立され (Hayashi et al., 2011)、それに続きオス、メス各々について配偶子分化過程の再現を目指す研究がなされてきました。メスについては、多能性幹細胞から始原生殖細胞を経て卵子を試験管内で誘導する手法が報告されています (Hikabe et al., 2016)。一方オスについては、多能性幹細胞から始原生殖細胞を経て、精子の前段階の細胞である、精子幹細胞注9を誘導する再構成精巣法が報告されていました(Ishikura et al., 2016)。
精子幹細胞は、生涯にわたり精子を産出する細胞で、成体の精巣内にわずかしか存在せず、生殖細胞系列で唯一の幹細胞といわれています。また、精子幹細胞は長期培養が可能であり、精子幹細胞株Germline stem cells(GSCs)注10と呼ばれています。従来の再構成精巣法は、目的とする精子幹細胞や精子幹細胞様細胞の長期培養株Germline stem cell-like cells(GSCLCs)の誘導に成功していました。しかし、途中解析が困難なこと、培養途中の分化速度が生体と比べて1週間ほど遅いこと、樹立したGSCLCsの精子分化寄与度が低い(18.8%)こと、GSCLCsから精子までの過程を試験管内で再構成していないこと、といった4つの課題がありました。
2.研究手法・成果
本研究グループは、これまで多能性幹細胞から始原生殖細胞様細胞を試験管内で誘導する手法を確立してきました。マウス生体において、始原生殖細胞は胎齢6.75日以降に、始原生殖細胞マーカー(標識)であるBlimp1、ついでStellaを発現します。その後、胎齢12.5日までに将来精巣となる生殖巣注11に移動し、生殖巣体細胞に囲まれて、オスになるためのシグナルを受けます。すると、生殖細胞は後期生殖細胞マーカーであるMvhを発現し、同時にエピゲノム情報の一つであるDNAのメチル化注12が、全ゲノム的に低下し、初期化状態となります。
今回、本研究グループはこれらの点に着目し、Blimp1、Stella、Mvhの3つの遺伝子レポーターを持つES細胞を用いて、始原生殖細胞様細胞を試験管内で誘導しました。次に、2017年に報告された始原生殖細胞培養法 (Ohta et al., 2017)を用いて、得られた始原生殖細胞様細胞を、DNAのメチル化レベルが初期化状態となるまで培養しました。この細胞を、従来の再構成精巣法から途中の培養液を改善した新・再構成精巣法にて、気相液相培養注13を行いました。すると、途中過程の詳細な解析から、再構成精巣内の生殖細胞マーカーの変遷、転写産物注14、細胞周期、メチル化状態の変化が、雄のマウス生体と非常に似た状態であることが明らかとなりました。(図1-A,B,C)また、この方法で得られた精子幹細胞様細胞長期培養株(GSCLCs)は、90%以上(平均92.5%)の高効率で精子分化に寄与しました。(図1-D,E) さらに、小川毅彦研究室との共同研究にて、体外精子誘導法 (Sato et al., 2011)を用いて、このES細胞由来のGSCLCsから、産仔に寄与する機能的な精子の誘導にも成功しました。(図2-A,B,C)
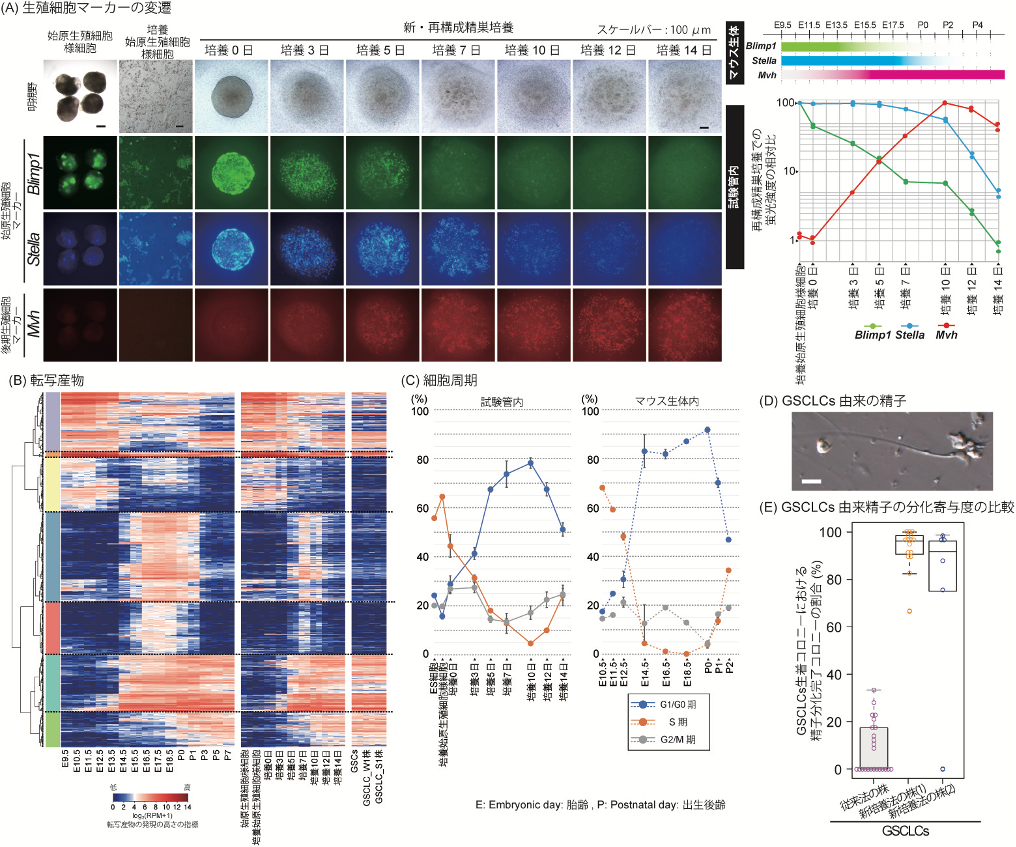
図1. (A) 始原生殖細胞様細胞、培養始原生殖細胞様細胞、および新・再構成精巣培養における再構成精巣と、内部でES細胞由来の生殖細胞様細胞が分化し、3つの分化マーカーの発現を示す蛍光が変遷していく様子。右側は、培養過程における分化マーカーの蛍光強度の相対比を示したもの。(スケールバー: 100μm) (B)生体マウスにおける生殖細胞系列とES細胞から新・再構成精巣培養、GSCLCs、各々の転写産物発現変化をヒートマップで示したもの。(C)細胞周期を比較したもの。(D)GSCLCs由来の機能的な精子。(スケールバー: 10μm) (E)従来と新・再構成精巣培養法、各々で樹立したGSCLCsの精子形成効率を比較したもの。
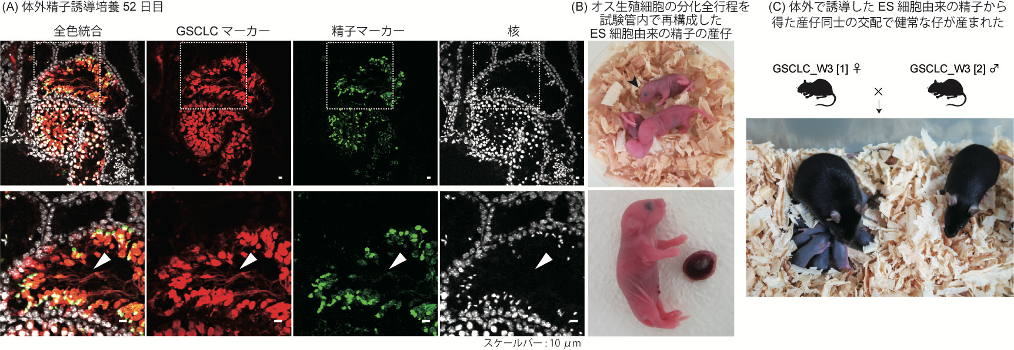
図2. (A)体外精子誘導法にて培養52日目のサンプルを、凍結切片にし、免疫染色にて精子ができていることを確認した。赤はGSCLCマーカー、緑は精子マーカー、白は核を示している。(スケールバー: 10μm) (B)オスの生殖細胞分化過程を全て試験管内で再構成することで得られた、ES細胞由来の精子を、人工的に授精させると、健常な仔が産まれた。(C)体外誘導法にて、ES細胞から得た精子由来のマウス、オス、メス同士を交配させると、健常な仔が産まれた。
3.波及効果、今後の予定
本研究は、新・再構成精巣法と体外精子誘導法を用いて、マウス多能性幹細胞から機能的な精子までを、完全な試験管内で再構成した初めての研究成果です。また、新・再構成精巣法では、細胞周期の停止と再開、脱メチル化(メチル化の初期化)と雄性メチル化状態の獲得、その過程で必要なレトロトランスポゾン制御注15など、雄の生殖細胞に特異的なイベントの解析へアプローチが可能となり、雄性生殖細胞分化メカニズム解明の可能性が広がりました。今後は、世代を超えたエピゲノム情報継承メカニズムの解明に向けて研究を進める予定です。
4.研究プロジェクトについて
本成果は、以下の事業・研究領域・研究課題によって得られました。
- JSPS 研究活動スタート支援「多能性幹細胞を起点とする雄性生殖細胞発生過程の試験管内再構成」
研究総括:石藏 友紀子
研究期間:平成29年度~平成31年度 - JSPS 特別推進研究「ヒト生殖細胞発生機構の解明とその試験管内再構成」
研究総括:斎藤 通紀(京都大学 大学院医学研究科 教授)
研究期間:平成29年度~令和3年度 - JST戦略的創造研究推進事業 総括実施型研究(ERATO)「斎藤全能性エピゲノムプロジェクト」
研究総括:斎藤 通紀(京都大学 大学院医学研究科 教授)
研究期間:平成23年度~平成28年度 - JSPS 新学術領域研究(研究領域提案型) 「高インテグリティを実現するin vitro精子産生系の開発」
研究総括:小川 毅彦 (横浜市立大学大学院 医学研究科 臓器再生医学 教授)
研究期間:平成30年度~令和4年度
用語解説
注1 多能性幹細胞:自己複製能力と、身体を構成するほぼ全ての細胞に分化する能力を持つ細胞のこと。胚性幹細胞(Embryonic stem cells: ESCs)や人工多能性幹細胞(induced Pluripotent stem cells: iPSCs)の総称。
注2 始原生殖細胞様細胞:Primordial germ cell-like cells(PGCLCs)と呼ばれる。多能性幹細胞から、完全な試験管内で誘導した、始原生殖細胞に非常によく似た性質を持つ細胞。マウスの受精後胎齢8.5~9.5日の始原生殖細胞に相同であることが、転写産物およびエピゲノム状態の解析から示されている。
注3 再構成精巣法:始原生殖細胞様細胞(PGCLCs)と、マウスの胎齢12.5日のオス生殖巣の体細胞とを凝集培養したのち、得られた細胞塊(再構成精巣)を気相液相条件にて培養する方法。
注4 精子幹細胞様細胞:本研究において、マウス多能性幹細胞(ES細胞)から完全な試験管内で誘導した、精子幹細胞によく似た性質を持つ細胞。この精子幹細胞様細胞の長期培養株はGermline stem cell-like cells(GSCLCs) と呼ばれ、マウスの生後7日齢の精子幹細胞から樹立したGS細胞に近い細胞であることが示された。
注5 体外精子誘導法:体外精子誘導法:精巣組織片を気相と液相(培養液)の境界部位に置き、酸素供給と栄養供給のバランスを図った培養方法である。マウス精子幹細胞から精子産生までの完全な精子形成を誘導維持することができる。
注6 エピゲノム情報の再構成:ゲノム(DNAの塩基配列)に付帯する、修飾情報の消去および再獲得のこと。修飾情報の代表として、DNAのメチル化やヒストンの修飾がある。
注7 減数分裂:配偶子である精子や卵子を形成する際に行われる細胞分裂。生じた細胞では、染色体の数が分裂前の半分となる。
注8 始原生殖細胞:精子や卵子の元であり、生殖細胞系列の起点となる細胞。マウスでは、受精後胎齢6.25日後頃にエピブラスト(将来、生殖細胞を含んだ、体を構成するすべての細胞に分化する能力を持つ未分化な細胞集団)から出現する。
注9 精子幹細胞:自己複製能力と精子分化能力を併せ持った、オスの生涯にわたる精子産生の元となる細胞。精子幹細胞は精原細胞、精母細胞を経て、精子細胞へと分化する。
注10 精子幹細胞株GSCs(Germline stem cells):生体由来の精子幹細胞そのものを、長期間培養しうる細胞株にしたもの。凍結保存が可能で、遺伝情報を保ったまま2年以上安定的に増殖させることができる。これまで、マウス、ラット、ハムスター、ウサギにて培養株の樹立が報告されている。
注11 生殖巣:生殖細胞とそれらを支持する体細胞からなる構造体。母胎で、胎仔の始原生殖細胞におけるオス、メスの性分化が始まる頃(マウスでは受精後胎齢12.5日)までに形成される。始原生殖細胞はオス、メス各々に特徴的な生殖巣の体細胞に包まれながら、配偶子(精子や卵子)へと分化する。
注12 DNAのメチル化:エピゲノム情報の一つ。DNAの塩基配列を構成する4つの塩基(アデニン、シトシン、グアニン、チミン)のうち、シトシンの5位の炭素がメチル化されること。一般的には、このメチル化修飾に結合するタンパク質の働きなどにより、遺伝子の発現が抑制される。
注13 気相液相培養:サンプルをPET等のポリエステルで出来た膜上にのせ、膜下に培養液を充填させて培養する方法。気相を介した酸素供給と、液相を介した培地由来の栄養分の供給が同時に可能となる。
注14 転写産物:設計図であるゲノム(DNA配列)と、実際に生体内で働くタンパク質とをつなぐ、中間産物。主にメッセンジャーRNAを指す。
注15 レトロトランスポゾン制御:真核生物のゲノム内に広く存在するレトロウイルス由来の「可動遺伝因子(レトロトランスポゾン)」が、無作為に複製を繰り返することで、宿主由来の主要な遺伝子に影響を及ぼすことを阻止・制御する仕組み。
参考文献
- Hayashi, K. et al., Cell, 146(4), 519-532 (2011)
- Hikabe, O. et al., Nature, 539(7628), 299-303 (2016)
- Ishikura, Y. et al., Cell Reports, 17(10), 2789-2804 (2016)
- Ohta, H. et al., EMBO journal, 36(13), 1888-1907 (2017)
- Sato, T. et al., Nature Communications, 2(1), 1-7 (2011)
研究者のコメント
所属研究室の皆様、共同研究者の先生方に支えていただきながら、成果を出すことができました。論文にて報告した系が、所属研究室内だけでなく、国を越えた研究室でも用いられようとしていることを聞くと、非常に嬉しく思います。関わってくださった皆様に、心より感謝申し上げます。
論文書誌情報
タイトル
In Vitro Reconstitution of the Whole Male Germ-Cell Development from Mouse Pluripotent Stem Cells(マウス多能性幹細胞から雄性生殖細胞系列全分化過程の試験管内再構成)
著者
石藏 友紀子、大田 浩、佐藤 卓也、村瀬 佑介、藪田 幸宏、小島 洋児、山城 知佳、中村 友紀、山本 拓也、小川 毅彦、斎藤 通紀
掲載誌
Cell Stem Cell