国際研究チームは、哺乳類の新しい遺伝子が、私たちの神経細胞内の同じく新しい構造を制御するために進化したことを発見しました。 An international team of researchers has discovered that a new mammalian gene evolved to control an equally new structure in our nerve cells.
2022-08-31 バース大学
「ジャンピング遺伝子」PGBD1は、脳のある部分、特に神経細胞になる細胞で非常に活発に働いており、哺乳類にのみ存在いる。
これらの「ジャンピング遺伝子」は、ゲノム内のある場所から別の場所へ移動することができ、時には突然変異を導入したり機能を変化させたりすることがある。しかし、今回の研究により、PGBD1が私たちのDNAの中を飛び回る能力を失っていることが明らかになった。
研究チームはまず、PGBD1タンパク質がDNAに結合する場所を調べ、神経の発達に関連する遺伝子の周辺に接着していることを観察した。その結果、PGBD1は、成熟した神経細胞で発現する遺伝子をブロックする一方で、神経細胞の前駆細胞に関連する遺伝子を活性化したままにして、神経細胞の発達を制御していることがわかった。神経細胞の前段階にあるPGBD1のレベルを下げると、神経細胞として発生し始めることが分かりった。
研究チームは、神経前駆細胞において、PGBD1タンパク質がNEAT1遺伝子に結合し、その働きを停止させることを見いだした。
<関連情報>
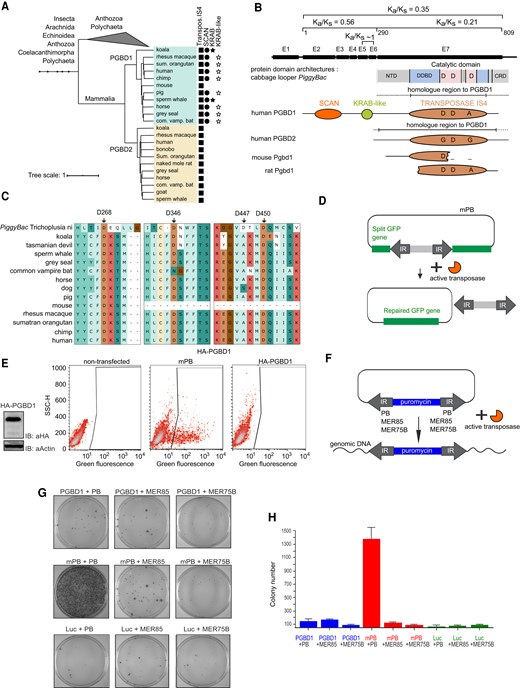
新しい遺伝子は新しい構造を制御する 哺乳類に特有なPiggyBac Transposable Element-derived 1は、哺乳類特有の神経細胞傍系を制御している。 A novel gene controls a new structure: PiggyBac Transposable Element-derived 1, unique to mammals, controls mammal-specific neuronal paraspeckles
Tamás Raskó, Amit Pande, Kathrin Radscheit, Annika Zink, Manvendra Singh, Christian Sommer, Gerda Wachtl, Orsolya Kolacsek, Gizem Inak, Attila Szvetnik,Spyros Petrakis, Mario Bunse, Vikas Bansal, Matthias Selbach, Tamás I Orbán, Alessandro Prigione, Laurence D Hurst, Zsuzsanna Izsvák
Molecular Biology and Evolution Published:23 August 2022
DOI:https://doi.org/10.1093/molbev/msac175
Abstract
While new genes can arrive from modes other than duplication, few examples are well characterised. Given high expression in some human brain sub-regions and a putative link to psychological disorders (e.g. schizophrenia), suggestive of brain functionality, here we characterize piggyBac transposable element derived 1 (PGBD1). PGBD1 is non-monotreme mammal-specific and under purifying selection, consistent with functionality. The gene body of human PGBD1 retains much of the original DNA transposon but has additionally captured SCAN and KRAB domains. Despite gene body retention, PGBD1 has lost transposition abilities, thus transposase functionality is absent. PGBD1 no longer recognises piggyBac transposon-like inverted repeats, nonetheless PGBD1 has DNA binding activity. Genome scale analysis identifies enrichment of binding sites in and around genes involved in neuronal development, with association with both histone activating and repressing marks. We focus on one of the repressed genes, the long non-coding RNA NEAT1, also dysregulated in schizophrenia, the core structural RNA of paraspeckles. DNA binding assays confirm specific binding of PGBD1 both in the NEAT1 promoter and in the gene body. Depletion of PGBD1 in neuronal progenitor cells (NPCs) results in increased NEAT1/paraspeckles and differentiation. We conclude that PGBD1 has evolved core regulatory functionality for the maintenance of NPCs. As paraspeckles are a mammal-specific structure, the results presented here show a rare example of the evolution of a novel gene coupled to the evolution of a contemporaneous new structure.


