2019-02-19 大阪大学,東京都医学総合研究所,芝浦工業大学,日本医療研究開発機構
研究成果のポイント
- 加齢に伴い、オートファジーを抑制する因子であるRubiconが増加することを発見した。
- いくつかのモデル生物でRubiconを抑制するとオートファジーが活発化し、加齢に伴う老化現象の改善と寿命の延伸が見られた。
- 加齢によりオートファジーが低下する要因のひとつがRubiconの増加であるため、Rubiconを抑制することにより、健康寿命延伸が期待される。
概要
大阪大学の吉森保教授(大学院医学系研究科 遺伝学/大学院生命機能研究科 細胞内膜動態研究室)及び中村修平准教授(大学院医学系研究科 遺伝学/高等共創研究院/大学院生命機能研究科 細胞内膜動態研究室)のグループは東京都医学総合研究所の鈴木マリ 主任研究員(運動・感覚システム研究分野 糖尿病性神経障害プロジェクト(三五一憲 プロジェクトリーダー))、大場柾樹大学院生(芝浦工業大学)らと共同で、細胞の新陳代謝を行い細胞の健康維持に必要な機能であるオートファジー※1が加齢に伴い低下してしまう現象のメカニズムを明らかにしました。研究グループはRubicon(ルビコン)※2と呼ばれるオートファジーを抑制する因子が、加齢に伴い、線虫、ショウジョウバエ、マウスの組織で増加することを見出しました。次に、Rubiconを抑制するとオートファジーの活発化がみられ、線虫やショウジョウバエでは寿命の延長が、またマウスでは加齢性の表現系が改善することを明らかにしました。これらの結果は、Rubiconの増加が加齢に伴うオートファジー低下と個体老化の要因の一つであることを示唆しています。今後Rubiconをターゲットにすることで健康寿命の延伸が期待されます(図1)。
本研究成果は、英国科学誌「Nature Communications」に公開されます(日本時間2月19日19時解禁)。
研究の背景
老化がなぜおこるのか、寿命がどうやって決まるのかは科学的にはまだよくわかっていません。しかし、最近の研究で老化や寿命も遺伝子や環境によって「制御」されていることが少しずつ分かってきました。例えばカロリー制限や、インシュリンシグナルの抑制、生殖細胞の除去などで動物の寿命が延びることが動物を使った実験で示されています。これらの処置は相互には関連性がありませんが、どの場合もオートファジーが活発化しています。そしてオートファジーを働かないようにした動物ではそのような処置をしても寿命が伸びません。つまり、オートファジーが寿命を決める鍵を握っていることが示唆されます。
オートファジーとは、自らの細胞内の構成成分を分解するしくみを指し、2016年に大隅良典博士がノーベル医学生理学賞を受賞されて以来大きく注目されています。近年の研究より、オートファジーの多彩な生理機能が明らかになってきており、最近では個体の老化や寿命の制御にも重要な役割を果たすことが示唆されていますが、その制御や機能は不明な点が多く残っています。
近年の研究結果から、加齢に伴い多くの動物でオートファジーが低下することが分かっています。その原因を突き止めてオートファジーの低下を防ぐことによって、寿命の延長が期待できます。この加齢に伴うオートファジー低下のメカニズムを明らかにするために、以前本研究グループの吉森教授らが同定したRubiconというオートファジーの負の制御因子に着目し解析を行いました。
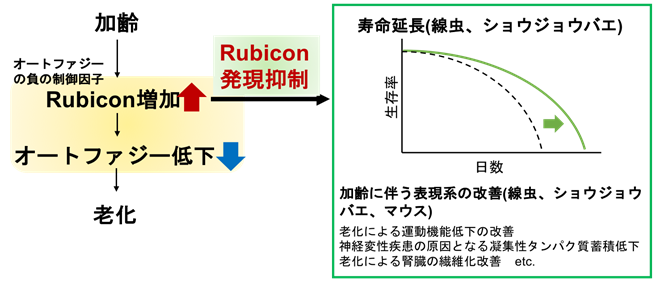
図1. 加齢に伴うオートファジーが低下するしくみ
加齢に伴い、Rubiconが増加する。これによりオートファジーが低下し、老化現象が起こる。Rubiconの発現を抑制すると、寿命延長や老化による運動機能低下の改善など、加齢に伴う表現型の改善が観察された。
本研究の成果
本研究グループは、まず加齢に伴うRubiconの発現変化を調べました。すると、線虫、ショウジョウバエ、マウスの腎臓や肝臓で、加齢に伴いRubiconが増加することがわかりました(図2)。次に、加齢に伴い増加するRubiconを実験的手法を用いて抑制することによって、加齢に伴いどのような現象が観察されるかを線虫、ショウジョウバエ、マウスを用いて調べました。RNAi法※3を用いて線虫、ショウジョウバエでRubiconの抑制を行うと、オートファジーの活性化が認められるとともに、寿命の延長が観察されました(図3:左)。また、加齢に伴い低下する運動機能を改善し、また神経変性疾患の原因となる易凝集性タンパク質※4の蓄積を軽減させることもわかりました。ゲノム編集にてRubiconの機能を欠損させたノックアウトマウスでは、加齢に伴い増加する腎臓の繊維化が軽減していました(図3:右)。また加齢性の神経変性疾患のひとつ、パーキンソン病の原因となるαシヌクレインの蓄積もノックアウトマウスで低下していました。さらに線虫、マウスなどで寿命を伸ばすことが知られているカロリー制限などの処置を行うと、Rubiconは低下することがわかりました。
これらのことから、加齢に伴うRubiconの増加が、加齢によるオートファジー低下と個体老化の要因の一つとなっていることが示唆されました。
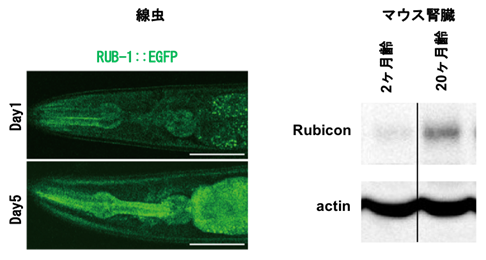
図2. 線虫やマウスの腎臓においてRubiconタンパク質は加齢に伴い増加する
(左:線虫の頭部)緑色はRubiconタンパク質を可視化したものであり、Day1と比べてDay5にてRubiconタンパク質の量が増加している。
(右:マウスの腎臓)マウスの腎臓においても、2ヶ月齢と比較して20ヶ月齢にてRubiconタンパク質の量が増加している。Actinはコントロールを示す。
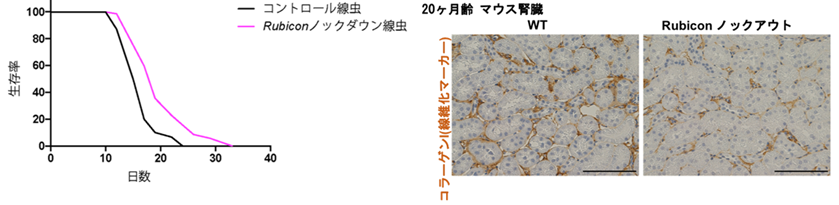
図3. Rubicon抑制により線虫で寿命延長、マウス腎臓の線維化の軽減が見られる
(左:線虫)線虫でRubiconをノックダウン(紫線)するとコントロール(黒線)と比べて寿命の延長が見られる。
(右:マウス腎臓)Rubiconノックアウトマウスでは、老化したマウス腎臓でコラーゲン(線維化マーカー、茶色)の蓄積が減少する。
本研究成果が社会に与える影響(本研究成果の意義)
日本を含めた先進国では医療の進歩により過去半世紀の間にヒトの平均寿命が約30年延伸しましたが、依然として高齢者の有病率は高く、いかにして健康寿命を延長するかが社会的な課題となっています。本研究により、モデル生物でRubiconを抑制することでオートファジーを活発化し、寿命延長や加齢に伴う老化現象の改善に繋がることがわかりました。今後の詳細なRubiconの制御機構とこれをターゲットにした創薬により、将来ヒトでの健康寿命の延伸に繋がると期待されます。
特記事項
本研究成果は、英国科学誌「Nature Communications」に掲載されます(日本時間2月19日19時解禁)。
- タイトル
- Suppression of autophagic activity by Rubicon is a signature of aging
- 著者
- Shuhei Nakamura1,2,3 #, Masaki Oba4,5 #, Mari Suzuki4, Atsushi Takahashi6, Tadashi Yamamuro1, Mari Fujiwara1, Kensuke Ikenaka7, Satoshi Minami6, Namine Tabata8,9,10, Kenichi Yamamoto11, Sayaka Kubo1,2, Ayaka Tokumura1, Kanako Akamatsu1, Yumi Miyazaki1,2, Tsuyoshi Kawabata1,12, Maho Hamasaki1,2, Koji Fukui5, Kazunori Sango4, Yoshihisa Watanabe13, Yoshitsugu Takabatake3, Tomoya S. Kitajima8,9,10, Yukinori Okada11, Hideki Mochizuki7, Yoshitaka Isaka6, Adam Antebi14, 15 and Tamotsu Yoshimori1,2*
(*責任著者、#共同筆頭著者)
- 大阪大学 大学院生命機能研究科 細胞内膜動態学
- 大阪大学 大学院医学系研究科 遺伝学
- 大阪大学 高等共創研究院
- 東京都医学総合研究所 運動・感覚システム研究分野 糖尿病性神経障害プロジェクト
- 芝浦工業大学 システム理工学部 生命科学科
- 大阪大学 大学院医学系研究科 腎臓内科学
- 大阪大学 大学院医学系研究科 神経内科学
- 理化学研究所 生命機能科学研究センター 染色体分配チーム
- 京都大学 大学院生命科学研究科
- 大阪大学 大学院理学研究科 生物分子情報研究室
- 大阪大学 大学院医学系研究科 遺伝統計学
- 長崎大学 原爆後障害医療研究所
- 京都府立医科大学 大学院医学研究科 基礎老化学
- Department of Molecular Genetics of Ageing, Max Planck Institute for Biology of Ageing
- Cologne Excellence Cluster on Cellular Stress Responses in Aging Associated Diseases (CECAD), University of Cologne
本研究は国立研究開発法人 日本医療研究開発機構(AMED)老化メカニズムの解明・制御プロジェクト、文部科学省科学研究費補助金によりサポートされる研究の一環として行われ、大阪大学 大学院医学系研究科 腎臓内科学・神経内科学・遺伝統計学、京都府立医科大学 大学院医学研究科 基礎老化学、理化学研究所 生命機能科学研究センター 染色体分配チーム、Max Planck Institute for Biology of Ageingとの共同研究で行われました。
用語説明
- ※1 オートファジー
- 細胞内に存在するタンパク質や構造体を二重膜で包み込み、ライソゾーム(多種の消化酵素をもつ細胞小器官)と融合することで包み込んだ内容物を分解する機構。オートファジーが開始すると、細胞質内に隔離膜が出現する。隔離膜は伸長して分解対象物を取り囲み、オートファゴソームを形成する。オートファゴソームはライソゾームと融合してオートライソゾームとなり、ライソゾーム内の消化酵素により分解対象物は分解される。オートファジーは、細胞内の不要物を分解することにより浄化作用を持つ。近年、様々な疾患においてオートファジーの機能が低下していることが確認されており、細胞内浄化作用が抑制され細胞内に不要物が溜まることが疾患の発症につながる可能性が考えられている。2016年に大隅良典博士がノーベル医学生理学賞を受賞されて以来大きく注目されている。
- ※2 Rubicon (ルビコン; Run domain Beclin-1 interacting And cysteine-rich containing protein)
- 本研究グループの吉森教授らにより2009年に発見された、オートファジーを抑制する働きを持つタンパク質。オートファジーの最終ステップであるオートファゴソームとライソゾームの融合を抑制し、細胞内のRubiconが増加するとオートファジー機能が低下することが知られている。
- ※3 RNAi(RNA interference)法
- 人工的にRNAを導入することにより、目的とする遺伝子の発現を抑制する方法。
- ※4 易凝集性タンパク質
- 異常凝集を作りやすいタンパク質のことで、神経変性疾患ではこれらの蓄積が発症原因と密接に関わっている。例えば神経変性を来すハンチントン舞踏病等のいわゆるポリグルタミン病は、通常より長いポリグルタミン鎖を含むために細胞内で凝集するようになった異常タンパク質(PolyQ)の発現により発症する。
本件に関する問い合わせ先
研究に関すること
吉森 保(よしもり たもつ)
大阪大学 大学院医学系研究科 遺伝学/生命機能研究科 細胞内膜動態学 教授
報道に関すること
大阪大学 大学院医学系研究科 広報室
東京都医学総合研究所 事務局 研究推進課 峯村・大井
芝浦工業大学 経営企画部企画広報課 土屋 公平
AMED事業に関する問い合わせ先
国立研究開発法人 日本医療研究開発機構
基盤研究事業部 研究企画課