2023-01-16 京都大学iPS細胞研究所
ポイント
- 環状RNAからの遺伝子発現を制御できる「環状RNA スイッチ」を開発した。
- 2種類の環状RNAスイッチを組み合わせ、持続性の高い人工遺伝子回路の構築に成功した。
- 環状RNAスイッチは、細胞に導入したときの安全性と持続性が高く、細胞種に応じて遺伝子発現を精密に制御できるため、メッセンジャーRNA(mRNA)注1)医薬等への応用が期待される。
1. 要旨
亀田重賢大学院生(CiRA未来生命科学開拓部門、医学研究科)と齊藤博英教授(CiRA同部門)らの研究グループは、マイクロRNA(miRNA)注2)およびRNA結合タンパク質を検知することで、細胞の種類に応じて遺伝子発現の制御が可能な2種類の「環状RNAスイッチ」を開発しました。
さらに、環状RNAスイッチを組み合わせた人工遺伝子回路を考案し、実際に細胞に導入した結果、特定のmiRNAによって環状RNAからの遺伝子発現を誘導可能であることを示しました。またその遺伝子発現は、通常型の線状mRNAから構成される人工遺伝子回路と比較して、長期にわたり持続することを確認しました。
今回、開発した環状RNAスイッチおよび人工遺伝子回路の技術が、mRNA医薬の応用範囲を広げ、実用化のための課題解決に貢献することが期待されます。
この研究成果は、2023年1月16日(月)午前9時5分(日本時間)に「Nucleic Acids Research」で公開されました。
2. 研究の背景
人工mRNAを用いた遺伝子導入技術は、ゲノムの損傷リスクが低く、導入効率が高いという利点を持ち、ワクチンや遺伝子治療、ゲノム編集医療など幅広い応用が現在考えられています。しかし、mRNAの細胞内における不安定さに起因する、遺伝子発現の持続性の低さが課題となっています。
環状RNAは、線状である通常のmRNAと比較し、細胞内において分解されにくいため、安定性が向上するという特徴を持っています。そのため環状RNAは、前述した課題を解決できる新しい種類の人工mRNAとして注目されていますが、標的細胞へのmRNAの特異的な導入は難しく、投与時に標的以外の細胞でもタンパク質の発現を誘導してしまう場合があります。このような意図しないタンパク質の発現による治療効果の低下や副作用を避けるため、環状RNAからのタンパク質の発現 (遺伝子発現) を制御する技術の開発が期待されていましたが、これまで実現できていませんでした。
本研究グループは、mRNA医薬の応用範囲の拡大と性能向上に寄与することを目標として、環状RNAの遺伝子発現を細胞種に応じて制御することのできるRNAスイッチ技術の開発と、環状RNAスイッチを用いた人工遺伝子回路の構築に取り組みました。
3. 研究結果
1)環状RNAの合成と遺伝子発現の性能評価
まず、基本となる環状RNAの合成を行いました。環状RNAは、線状mRNAのように翻訳に必要とされる5’末端のCap構造注3)を持ちません。そのため本研究では、遺伝子をコードする領域の上流に、Cap構造がなくても翻訳を誘導することのできる「内部リボソーム侵入部位(internal ribosome entry site、IRES)」を持つRNAを合成しました。さらに、RNAを環状化させるための配列を用いることで、線状のRNAから、環状RNAを合成することに成功しました。
続いて、合成した環状RNAを細胞に導入したときの遺伝子発現の強度について、同じ配列をもつ通常の線状mRNAとの比較を行いました。その結果、3種類の培養細胞(HEK293FT、HeLa、A549)のいずれの場合も、環状RNAがより高い発現を誘導することが示されました。また、細胞内の導入RNA量を経時的に調べた結果、環状化によって細胞内でのRNA安定性が向上していることがわかりました。
その他に、線状RNAの細胞への導入の際に課題となる、免疫応答反応の誘導および細胞毒性について評価しました。その結果、免疫応答の誘導については線状RNAと比較し、環状RNAでは有意な低下を確認しました。また、環状RNAを細胞に導入した場合にはいずれの細胞株においても有意な細胞毒性は認められませんでした。
2)環状RNAによるmiRNA応答性スイッチの合成
次に、細胞内のmiRNAに応答して遺伝子発現の制御を行う環状RNAの合成を行いました。miRNAは、細胞内において完全に相補的なRNA配列をもつmRNAと結合することで、mRNAの分解を誘導し、mRNAからのタンパク質合成を抑制することが知られています。
培養細胞(HEK293FT、HeLa、A54)において、合成したmiRNA応答性環状RNAを導入したときの遺伝子発現について評価を行いました。このとき、導入した環状RNAと標的とするmiRNAの阻害剤を同時に導入し、細胞内のmiRNAによる影響を受けない状況での環状RNAからの遺伝子発現との比較を行いました。
その結果、miRNA阻害剤を導入しない場合は、環状RNAからの遺伝子発現が抑制されました。一方、miRNA阻害剤と同時にmiRNA応答性環状RNAを導入した場合は、環状RNAからの遺伝子発現が誘導されました。この結果は、細胞内に存在する標的miRNAが環状RNAに結合し、遺伝子発現を抑制できることを示唆しています。今回合成したmiRNA結合配列を持つ人工環状RNAが、細胞に内在するmiRNAに応答して遺伝子発現を制御する環状RNAスイッチとして機能することがわかりました。
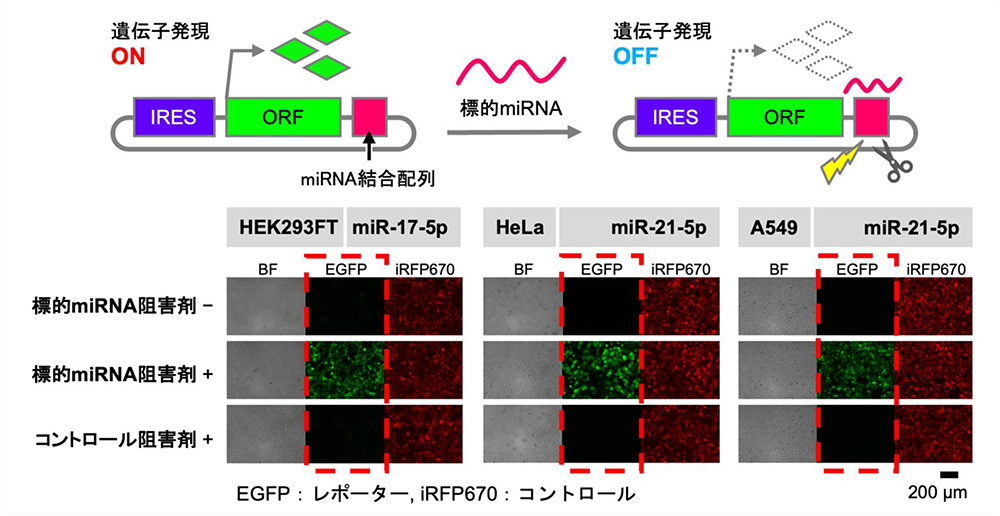
図1 miRNA応答性スイッチの構造と培養細胞における遺伝子発現
3)環状RNAによるRNA結合タンパク質応答性スイッチの合成
続けて、環状RNAの遺伝子発現に必要なIRES配列に、RNA結合タンパク質(MS2CPまたはU1A)が認識するタンパク質結合モチーフ配列を挿入することで、RNA結合タンパク質によって遺伝子発現の制御を行う環状RNAの合成を試みました。その結果、それぞれのRNA結合タンパク質について、環状RNAの機能を損なうことなく、遺伝子発現の制御が可能なIRES内のタンパク質結合モチーフ挿入部位を見出すことに成功しました。
これにより、タンパク質結合モチーフを持つ人工環状RNAについても、RNA結合タンパク質に応答して遺伝子発現を制御する環状RNAスイッチとして構築が可能なことを示しました。
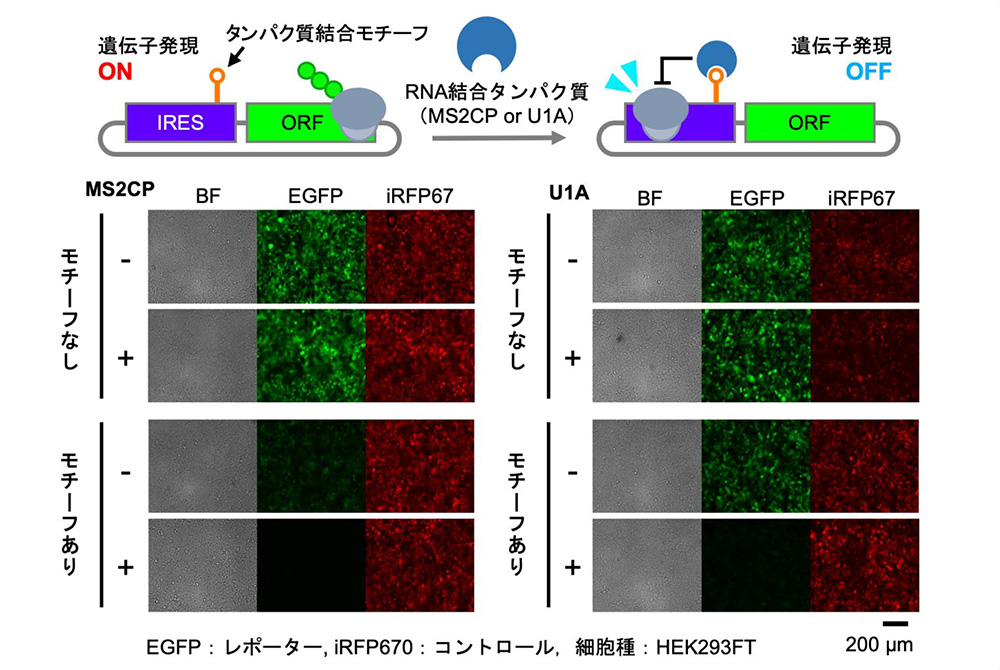
図2 RNA結合タンパク質応答性スイッチの構造と培養細胞における遺伝子発現
4)環状RNAスイッチから構成される人工遺伝子回路の構築
最後に、今回作成した環状RNAスイッチを2種類組み合わせることによって、人工遺伝子回路を構築し、細胞内で機能するかどうかを検証しました。
1つ目は、miRNA応答性環状RNAスイッチを用い、RNA結合タンパク質(MS2CPまたはU1A)を発現するように構築しました。2つ目には、RNA結合タンパク質(MS2CPまたはU1A)と結合する配列を持つRNA結合タンパク質応答性環状RNAスイッチを用いました。
この2種の人工環状RNAスイッチを組み合わせることによって、細胞に導入したときに特定のmiRNAの存在下で、2つ目の環状RNAから遺伝子発現を誘導することのできる人工遺伝子回路の構築が可能となります。実際に細胞に2種の環状RNAを同時に導入したところ、miRNAの量に応じて、2つ目の環状RNAから遺伝子発現が誘導されることを確認しました。
さらに、今回構築した人工環状RNAスイッチによる遺伝子回路と線状RNAによる同様の組み合わせの遺伝子回路を用意し、遺伝子発現の持続性を確認しました。その結果、環状RNAによる遺伝子回路において、より長期にわたって遺伝子発現が持続することが確認されました。
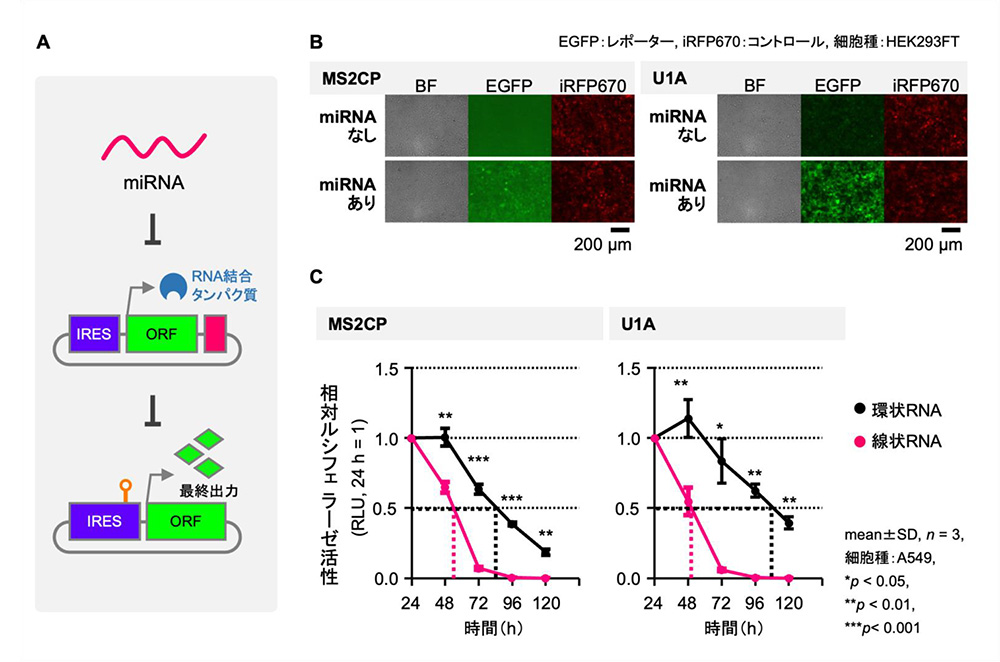
図3 人工遺伝子回路の概要と培養細胞における遺伝子発現
A. 人工遺伝子回路の模式図。
B. 標的miRNAによる遺伝子発現の活性化。
C. 人工遺伝子回路における遺伝子発現の持続性の比較。
4. まとめと展望
本研究では、遺伝子導入の安全性と持続性が期待できる環状RNAを骨格として、miRNAおよびRNA結合タンパク質によって細胞種選択的に遺伝子発現の制御が期待できるRNAスイッチの構築に成功しました。さらに、2種類の環状RNAスイッチを組み合わせることで、特定のmiRNAに応じて遺伝子発現を誘導できる人工遺伝子回路を考案し、細胞内で実際に機能することを示しました。本研究で構築した技術が、今後のmRNA医薬の開発と応用範囲の拡大に寄与することが期待されます。
5. 論文名と著者
- 論文名
Synthetic circular RNA switches and circuits that control protein expression in mammalian cells - ジャーナル名
Nucleic Acids Research - 著者
Shigetoshi Kameda1,2, Hirohisa Ohno1, Hirohide Saito1*
* : 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会 科研費 (特別推進研究 20H05626)
- 日本学術振興会 特別研究員
- iPS細胞研究基金
7. 用語説明
注1)メッセンジャーRNA(mRNA)
遺伝子の一時的なコピーとして、リボソームで合成されるタンパク質のアミノ酸配列を指定する役割を持つRNA。
注2)マイクロRNA(miRNA)
20〜30塩基程度の長さの短いノンコーディング(タンパク質をコードしていない)RNA。相補的な配列を持つmRNA(メッセンジャーRNA)と結合して翻訳を抑制したり、mRNAを分解したりすることで、そのmRNAからのタンパク質の合成を抑制する働きをもつと考えられている。
注3)Cap構造
細胞質で翻訳されるmRNAの先頭側(5’末端側)に一般的に存在する構造。mRNAの安定性や翻訳開始などに関与していることがわかっている。