2018-08-06 理化学研究所
理化学研究所(理研)開拓研究本部袖岡有機合成化学研究室の五月女宜裕専任研究員、袖岡幹子主任研究員、眞貝細胞記憶研究室の島津忠広専任研究員、眞貝洋一主任研究員らの共同研究グループ※は、タンパク質メチル化反応[1]の網羅的検出法を阻害剤探索に応用することで、新しいメチル化阻害剤を開発し、その標的基質の同定に成功しました。
本研究成果は、優れたタンパク質メチル化阻害剤の開発に貢献すると期待できます。
細胞の多様性を支えるのは、ヒストンタンパク質[2]の修飾(メチル化、アセチル化など)を介した「エピジェネティクス[3]」です。ヒストンのリジンあるいはアルギニン残基のメチル化反応は、転写をつかさどるクロマチン構造[4]の変化に重要な役割を果たします。しかし、現在同定されているタンパク質メチル化の例はほんの一部であり、メチル化されるタンパク質の全体像を理解し、メチル化反応を制御するための基礎的な方法が求められていました。今回、共同研究グループは、以前開発した「ProSeAMプローブ」を用いる検出系を基盤として、タンパク質メチル化反応を抑制する薬剤(阻害剤)を評価する手法を開発しました。これにより、無数のタンパク質が存在する細胞抽出液において、阻害剤のメチル化阻害能を評価できるようになりました。さらに、本手法を用いることで、ケトシンの全合成を基盤として新たに合成したメチル化阻害剤「syn-HyPA ETP-2」を開発し、非ヒストン選択的にメチル化を阻害することを見いだしました。
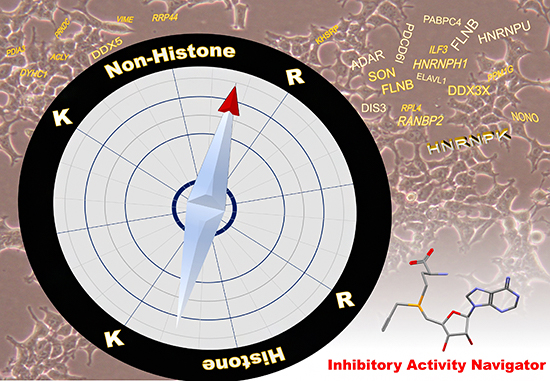
図 検出プローブを羅針盤とするタンパク質メチル化阻害剤の探索・評価
本研究成果は、国際科学雑誌『Chemical Communications』(7月31日付け)に掲載されました。
※共同研究グループ
理化学研究所
開拓研究本部
袖岡有機合成化学研究室
専任研究員 五月女 宜裕(そうとめ よしひろ)
(環境資源科学研究センター 触媒・融合研究グループ 専任研究員)
国際特別研究員(研究当時) バルハウ・ホアキン(BarjauJoaquin)
研修生(研究当時) 藤城 信哉(ふじしろ しんや)
テクニカルスタッフⅠ 赤壁 麻依(あかかべ まい)
テクニカルスタッフⅠ 寺山 直樹(てらやま なおき)
(環境資源科学研究センター 触媒・融合研究グループ テクニカルスタッフⅠ)
専任研究員 どど 孝介(どど こうすけ)
(環境資源科学研究センター 触媒・融合研究グループ 専任研究員)
主任研究員 袖岡 幹子(そでおか みきこ)
(環境資源科学研究センター 触媒・融合研究グループ グループディレクター)
眞貝細胞記憶研究室
専任研究員 島津 忠広(しまず ただひろ)
主任研究員 眞貝 洋一(しんかい よういち)
環境資源科学研究センター ケミカルゲノミクス研究グループ
グループディレクター 吉田 稔(よしだ みのる)
専任研究員(研究当時) 伊藤 昭博(いとう あきひろ)
(現 東京薬科大学 生命科学部 教授)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究B「有機合成化学が切り拓くケミカルメチロームの新展開(研究代表者:五月女宜裕)」などによる支援を受けて行われました。
背景
生命現象の設計図である遺伝情報は、DNAに書き込まれています。生体では遺伝情報を取り出し、それを適材適所で運用することにより、さまざまな生命現象が制御されています。細胞には、DNAの塩基配列を変えることなく、DNAのメチル化やヒストンタンパク質の修飾(メチル化、アセチル化、ユビキチン化など)を介して、遺伝子の発現を制御する「エピジェネティクス」というメカニズムが備わっています。
ヒストンのリジン(K、リシンとも表記される)あるいはアルギニン(R)残基のメチル化反応は、転写をつかさどるクロマチン構造の変化に重要な役割を果たし、これにより多彩な生命現象が制御されることが明らかにされています。近年では、ヒストン以外のタンパク質(非ヒストン)のメチル化反応も生命現象の制御に重要な役割を果たすことが分かってきました。しかし、現在同定されている例は、実際に生体で起こるメチル化反応のほんの一部であり、その複雑なタンパク質メチル化反応の全容は分かっていません。特に、「どの酵素が、どのタンパク質をメチル化するのか」を紐付けるための方法の開発が大きな課題として残されていました。
一方、五月女宜裕専任研究員、袖岡幹子主任研究員、島津忠広専任研究員、眞貝洋一主任研究員らはこれまでに、メチル化基質の検出を可能とする検出プローブを用いて、この課題を解決するタンパク質メチル化反応の網羅的検出法を開発しました注1)。今回、共同研究グループは、この検出系を基盤として、タンパク質メチル化を抑制する薬剤 (阻害剤)が「どのタンパク質のメチル化を、どの程度阻害するのか」を評価する手法の開発を目指しました。
注1)T. Shimazu, B. Joaquin, Y. Sohtome, M. Sodeoka, Y. Shinkai,”Selenium-Based S-Adenosylmethionine Analog Reveals the Mammalian Seven-Beta-Strand Methyltransferase METTL10 to Be an EF1A1 Lysine Methyltransferase”Plos One, 2014, 9, e105394.
研究手法と成果
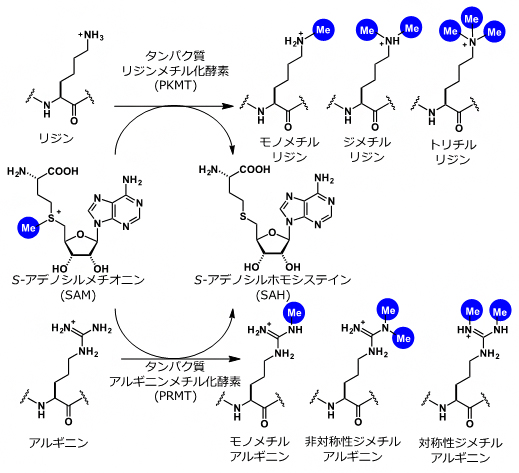
共同研究グループは、タンパク質メチル化反応のメチル源である低分子化合物 S-アデノシルメチオンニン(SAM)[1]に着目し、この構造を合成化学的に改変した低分子化合物を検出プローブとして用いることで、人工的目印をタンパク質メチル化反応の基質タンパク質に導入する戦略で研究を進めてきました。これまでに、SAMのメチル基をプロパルギル基に改変した「ProSeAM(propargylic Se-adenosyl-L-selenomethionine)」と呼ばれる化合物をプローブとして用いた場合、最も効率的にプロパルギル基(人工的目印)を基質タンパク質に導入できることが分かっています注1)。
このProSeAMを用いた基質タンパク質の網羅的検出は、図1のように行います。まず、ProSeAMがタンパク質メチル化酵素(PMT)により認識されることで、さまざまな基質タンパク質にプロパルギル基が導入されます(ステップi)。続いて、クリック反応[5]によりプロパルギル基にビオチンが導入されます(ステップii)。すると、ビオチン-ストレプトアビシンの強い相互作用を利用したアフィニティー精製[6]により、ProSeAMで修飾を受けたタンパク質が効率的に濃縮されます(ステップiii)。さらに、消化酵素により修飾タンパク質が小さなペプチドへと断片化されます(ステップiV)。その後、断片化されたペプチドを液体クロマトグラフィータンデム質量分析(LC-MS/MS)[7]にかけることで、効率的に修飾タンパク質を同定することができます(ステップV)。
ProSeAMを細胞抽出液に添加すると、内在性PMT(細胞内に存在するPMT)により多様なタンパク質が修飾されます(図2-Ⅰ)。一方、ProSeAMとある特定の精製PMTを細胞抽出液に添加して反応させると、そのPMTの基質に由来する質量電荷比(m/z)[8]のピーク強度が増幅することを利用して(図2-Ⅱ)、まず「どの酵素が、どのタンパク質基質をメチル化するのか」を解明する方法を開発しました。内在性PMTのみによる修飾反応(図2-Ⅰ)と、解析対象の精製PMTを添加した系(図2-Ⅱ)について質量分析[8]により定量解析を行い、その強度を比較することで、基質タンパク質の候補を効率的に絞り込むことができます。
今回、共同研究グループは、ProSeAMとともに解析対象の阻害剤を添加し細胞抽出液中で反応させると、標的基質タンパク質のm/zのピーク強度が減弱することを利用して、メチル化阻害剤が影響を与えるメチル化反応を網羅的に評価できるのではないかと考えました(図2-Ⅲ)。
そこで、新しいタンパク質メチル化阻害剤の開発に向けて、リジン選択的メチル化阻害剤として広く使われているケトシンという化合物に着目しました。ケトシンは、精製酵素/基質を用いるタンパク質メチル化反応の評価系において、リジン選択的メチル化阻害剤として報告されましたが、生きた細胞に用いた場合、細胞毒性を示すことが問題となっていました。
一方、袖岡研究室でのケトシンの全合成注2)および構造展開研究で得られた知見を基盤として、ケトシンの構造と一部類似する4種の新しいETP型阻害剤[9]「HyPA-ETP」を設計・合成し、ProSeAMを用いた検出系でこれらの阻害活性について評価しました。SDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)[10]を用いた解析の結果、ケトシンは非選択的に作用し、多くのProSeAMによる修飾反応を阻害することが分かりました(図3)。一方、HyPA-ETPは独特な阻害特性を示し、特に「syn-HyPA-ETP 2」は、これまで開発がほとんど報告されていない非ヒストン基質に対し、より選択的に修飾反応を阻害することが明らかになりました(図3)。
次に、syn-HyPA-ETP 2の非ヒストン選択的阻害活性に着目し、質量分析を用いた定量解析を行い、syn-HyPA-ETP 2の標的基質についての検討を行いました。その結果、syn-HyPA-ETP 2はリジンよりもアルギニン残基に対して、より選択的にProSeAMによる修飾反応を阻害することが分かりました(図4)。これまでETP化合物はリジン残基(K)をメチル化する酵素(Protein Lysine (K) Methyl Transferase:PKMT)を選択的に阻害すると考えられてきましたが、構造を適切に改変することでアルギニン残基質(R)をメチル化する酵素(Protein Arginine (R) Methyl Transferase:PRMT)に選択的な阻害剤として機能できることが示されました。
さらに、同定した非ヒストン基質候補の中から、タンパク質HNRNPK(heterogeneous nuclear ribonucleic protein K)に着目し、精製したアルギニン残基のメチル化酵素(PRMT-1)/基質(HNRNPK)/天然型メチル源(SAM)を用いて検証実験を行った結果、syn-HyPA-ETP 2は、HNRNPKのメチル化反応を濃度依存的に阻害することが確認されました(図4)。
以上の結果は、ProSeAMがタンパク質メチル化阻害剤を探索するために有用なツールであることを示しています。また、新たに合成した4種のHyPA-ETPは、ケトシンと比較して細胞毒性が著しく低減されていることも示されており、合成化学的にETP構造を改変することで、より優れたタンパク質メチル化阻害剤を開発できる可能性も示されました。
注2) E. Iwasa, Y. Hamashima, S. Fujishiro, E. Higuchi, A. Ito, M. Yoshida, M. Sodeoka, “Total Synthesis of (+)-Chaetocin and its Analogues: Their Histone Methyltransferase G9a Inhibitory Activity” J. Am. Chem. Soc. 2010,132,4078.
今後の期待
従来のタンパク質メチル化阻害剤の開発研究では、「1酵素-1基質-1サイト」のメチル化反応を指標に、阻害剤の構造最適化が進められてきました。一方、今回開発した手法により、無数のタンパク質が存在する細胞抽出液において阻害剤のメチル化阻害能を評価できるようになりました。
本手法は、阻害剤が作用するタンパク質基質の選択性の効率的な評価に加えて、その標的基質の同定も可能とすることから、優れたタンパク質メチル化阻害剤の開発に貢献すると期待できます。
原論文情報
Yoshihiro Sohtome, Tadahiro Shimazu, Joaquin Barjau, Shinya Fujishiro, Mai Akakabe, Naoki Terayama, Kosuke Dodo, Akihiro Ito, Minoru Yoshida, Yoichi Shinkai and Mikiko Sodeoka, “Unveiling Epidithiodiketopiperazine as a Non-Histone Arginine Methyltransferase inhibitor by Chemical Protein Methylome Analyses”, Chemical Communications, 10.1039/C8CC03907K
発表者
理化学研究所
主任研究員研究室 袖岡有機合成化学研究室
専任研究員 五月女 宜裕(そうとめ よしひろ)
主任研究員 袖岡 幹子(そでおか みきこ)
主任研究員研究室 眞貝細胞記憶研究室
専任研究員 島津 忠広(しまず ただひろ)
主任研究員 眞貝 洋一(しんかい よういち)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- タンパク質メチル化反応、S-アデノシルメチオンニン(SAM)
- S-アデノシルメチオンニンは、タンパク質メチル化反応におけるメチル化源として機能する低分子化合物。タンパク質メチル化反応は、タンパク質メチル化転移酵素(PMT)によって、S-アデノシルメチオニンからタンパク質にメチル基を転移させる反応の総称。主に、タンパク質リジンメチル化転移酵素(PKMT)によるリジンメチル化と、タンパク質アルギニンメチル化転移酵素(PRMT)によるアルギニンメチル化反応が知られる。SAMはS-Adenosylmethionineの略。
-
- ヒストンタンパク質
- ゲノムDNAを巻き付かせ、構造体を形成するタンパク質群。ヒストンH1、H2A、H2B、H3、H4の5種類からなる。メチル化などの化学修飾を受け、遺伝子の発現を調節すると考えられている。
-
- エピジェネティクス
- DNA配列の変化によらず、遺伝子の発現を制御するメカニズムの総称。狭義ではDNAのメチル化やヒストン修飾による制御を指すことが多い。
-
- クロマチン構造
- DNAがヒストンに巻かれた構造であるヌクレオソームがつながった構造のこと。
-
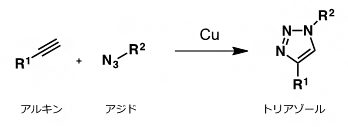
- クリック反応
- シートベルトをカチッとつなげるように、狙い通りに、2分子を連結させるための合成反応の総称。生体のようにさまざまな分子が存在する水中において、室温でも進行する反応が有用であり注目を集めている。その代表的な反応が、銅触媒存在下、アジドとアルキンとを用いるトリアゾール形成反応である。本研究では、ProSeAMにより修飾を受けたタンパク質に対して、ビオチンを導入するために用いている。
-
- アフィニティー精製
- 特異的な相互作用を利用して、タンパク質などを分離・精製する方法の総称。本研究では、ビオチン・ストレプトアビジンの極めて強い相互作用を利用している。ストレプトアビジンは細菌により作られるタンパク質で、4個のサブユニットから構成される。各サブユニットは1分子のビオチンと強く結合する。生化学の研究用試薬あるいはがんの検査用試薬などに用いられる。
-
- 液体クロマトグラフィータンデム質量分析(LC-MS/MS)
- 液体クロマトグラフィーにより分離された化合物をイオンに変換し、質量分析装置を用いて化合物の検出および定量を行う。質量分析装置内でイオンを壊し(フラグメント化)、その生成イオン群(プロダクトイオン)を測定することを「MS/MSスペクトルを取得する」と言う。MS/MSスペクトルの情報から、化合物構造を同定・推定することが可能である。
-
- 質量電荷比(m/z)、質量分析
- 質量分析は分子の質量を測定する分析法で、分子をイオン化させイオンの質量電荷比(m/z)を測定する。
-
- ETP型阻害剤
- ここでは、ETP構造を持ちタンパク質メチル化を阻害する低分子化合物と定義する。ETPはepidithiodiketopiperazineの略。
-
- SDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)
- SDSとアクリルアミドの重合体であるポリアクリルアミドのゲルを使用した電気泳動。陰イオン系界面活性化剤であるSDS存在下では、タンパク質は負の電荷をもつことから、全てのタンパク質を陽極側に泳動させることができる。この際、網目構造を持つポリアクリルアミドゲルは分子ふるいとして働くため、タンパク質の分子量を反映した泳動結果を得ることができる。SDSはsodium dodecyl sulfateの略。PAGEはpoly-acrylamide gel electrophoresisの略。
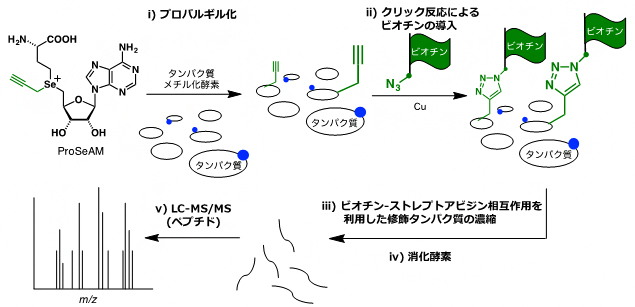
図1 ProSeAMを用いるメチル化タンパク質の網羅的検出法
(ステップi) ProSeAMがタンパク質メチル化酵素(PMT)により認識されることで、プロパルギル基(緑の官能基)がタンパク質基質に転移する。青丸は、細胞内に存在する内在性PMTにより既にメチル化された箇所を示している。
(ステップii) クリック反応により、プロパルギル基にビオチン(緑の旗)を導入する。
(ステップiii)ビオチン-ストレプトアビジンの強い相互作用を利用して、修飾されたタンパク質のみを濃縮する。
(ステップiV)濃縮された修飾タンパク質を消化酵素により断片化する。
(ステップV)液体クロマトグラフィータンデム質量分析(LC-MS/MS)により、濃縮されたタンパク質を同定する。
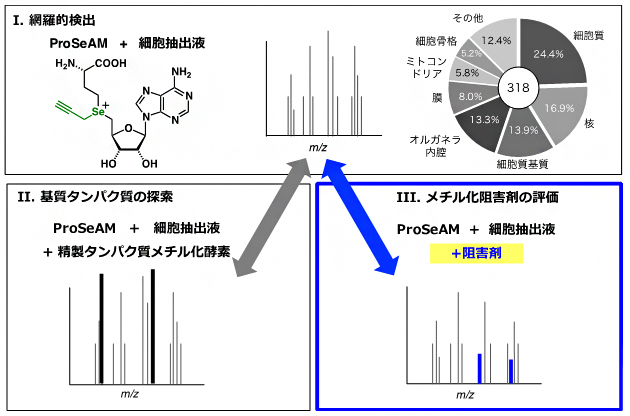
図2 ProSeAMを用いたメチル化基質探索およびメチル化阻害剤探索
ProSeAMと細胞抽出液を用いた場合、内在性タンパク質メチル化酵素(PMT)により318個のタンパク質が修飾されることが分かった(Ⅰ)。ProSeAMとともに解析対象の精製PMTを添加し細胞抽出液中で反応させると、対応する基質の質量電荷比(m/z)のピーク強度が増幅する(Ⅱ)。内在性PMTのみによる修飾反応(Ⅰ)と、解析対象の精製PMTを添加した系(Ⅱ)を質量分析により定量解析を行うことで、基質タンパク質の候補を効率的に絞り込むことができる。一方、ProSeAMとともに解析対象の阻害剤を添加し細胞抽出液中で反応させると、阻害剤の標的基質タンパク質のm/zのピーク強度が減弱する(Ⅲ)。
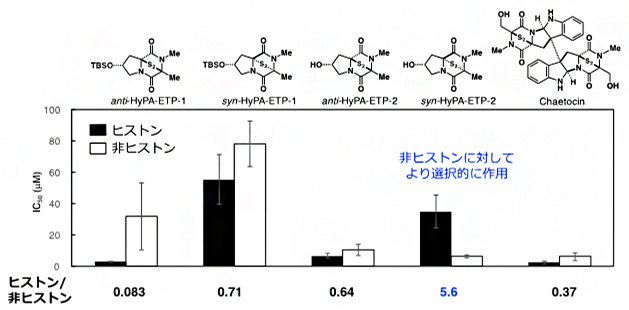
図3 ProSeAMを用いる検出系における4種のETP型阻害剤とケトシンのIC50値
解析対象のETP型阻害剤存在下、図1のステップi~iiの手順でProSeAMにより修飾されたタンパク質を電気泳動した後、HRP標識ストレプトアビジンで定量し、ヒストンバンド(17 kDa)と非ヒストンバンド(20-250 kDa)におけるIC50値(50%阻害濃度)を求めた。棒グラフが低いほど、修飾反応が阻害されていることを示す。ETP型阻害剤の中で「syn-HyPA-ETP 2」のIC50値は、ヒストン(黒)よりも非ヒストン(白)がかなり低いことから、syn-HyPA-ETP 2は非ヒストンに対して選択的に阻害作用を示すことが分かった。
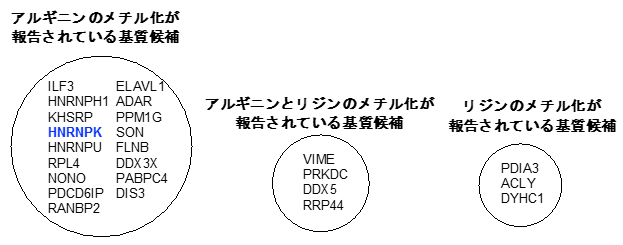
図4 質量分析により同定されたsyn-HyPA-ETP 2の基質候補
内在性PMTのみによる修飾反応(図2-Ⅰ)と、解析対象のETP型阻害剤を添加した系(図2-Ⅲ)を質量分析により定量解析を行った。その結果、syn-HyPA-ETP 2は、ProSeAMにより修飾を受けるタンパク質基質の中で90種のタンパク質がヒットした。そのうち、メチル化されることが既に報告されている17種のタンパク質のみを示している。また、検証実験により、その中の「非ヒストンHNRNPK」のメチル化反応を、syn-HyPA-ETP 2が濃度依存的に阻害することが確認された。