2023-02-03 京都大学iPS細胞研究所
ポイント
- ワクシニアウイルスキャッピンッグ酵素注1)を用いてmRNAの5’キャップ注2)修飾を試みた
- 市販されているGTP注3)アナログを使ってさまざまな5’キャップ修飾を行うことができた
- 5’キャップにビオチン注4)や蛍光タンパク質を搭載することでmRNAの機能性を拡張できる
1. 要旨
大野博久助教(CiRA未来生命科学開拓部門)と齊藤博英教授(CiRA同部門)らの研究グループは、東京大学の鈴木勉教授らのグループと共同で簡単にさまざまなキャップ構造を持った機能的なmRNAを作成する方法を開発しました。
合成mRNAは、遺伝子の運び屋としての可能性を持っているため、応用に向けた研究が活発に行われています。天然のmRNAは、先頭側(5’側)に「5’キャップ」と呼ばれる構造をもっています。5’キャップはmRNAの安定性や翻訳活性を調節しており、化学的に修飾することでmRNAの性質を変化させられることが知られています。そのため、機能的な5’キャップ構造の探索と合成が行われています。
今回研究グループは、ワクシニアウイルスがもつ酵素を用いて5’キャップを修飾することにより、機能性mRNAを簡便かつ効率的に合成する方法を報告しました。この酵素は、RNAの5’末端に様々なGTPアナログを導入することができ、異なる翻訳レベルを示す5’キャップ修飾mRNAを生成することができることを示しました。特に、これらの修飾mRNAの中には、翻訳効率が向上したものや、他の物質と結合する部位を持ち、さらに機能性を高めることができるものもあります。今回開発した5’キャップ修飾mRNAの作製法は、RNA治療や生命科学研究に有用なツールを提供できると考えています。
この研究成果は2023年2月3日(日本時間)に「Nucleic Acids Research」で公開されました。
2. 研究の背景
合成mRNAを用いた遺伝子導入は、様々な生命医学分野への応用が期待され、着実に注目を集めています。DNAやウイルスベクターと異なり、合成mRNAはゲノムに挿入される可能性が低いため、遺伝子治療や細胞治療において安全性が高いとされています。また、合成mRNAは細胞の核に入る必要がないため、細胞質で効率的にタンパク質を生産することができます。
しかし、RNAは化学的・生物学的に不安定であるため、生体内での応用には限界があります。天然のmRNAは、5’末端に7-メチルグアニル酸(m7G)という化学構造が結合しており、これを5’キャップと言います。これまでの研究で、5’キャップを化学修飾により変化させると、mRNAを安定化させたり、翻訳効率を向上させたり、機能を変化させることができることがわかっています。また、5’キャップに特定の分子を組み込むことで、mRNAの生物学的特性の解明や機能拡張が可能となります。
これまで、修飾された5’キャップをもつ合成mRNAを調製する方法では、RNAの合成に使われるGTP(Guanosine triphosphate:グアノシン三リン酸)と似た構造を持つ分子(キャップアナログ)の存在下でRNAの合成(転写)を行います。しかし、この方法で合成されたmRNAにはキャップを持たないRNAも一定量生じてしまううえ、キャップアナログを化学合成することは容易ではなく、広く利用することができていませんでした。
そこで、研究グループでは、酵素を利用して修飾キャップを付加したmRNAを合成することを考え、ワクシニアウイルスキャッピング酵素(VCE)に注目して検討を行いました。
3. 研究結果
1)VCEによる5’キャップ構造の付加
VCEを使った酵素反応による5’キャップ構造の付加は以下のような反応によって行われます(図1)。転写されたRNAの5’末端にある三リン酸部分とGTPを結合したのち、GTPのグアニン部分にある窒素原子(7位)をメチル化することでキャップ構造が形成されます。
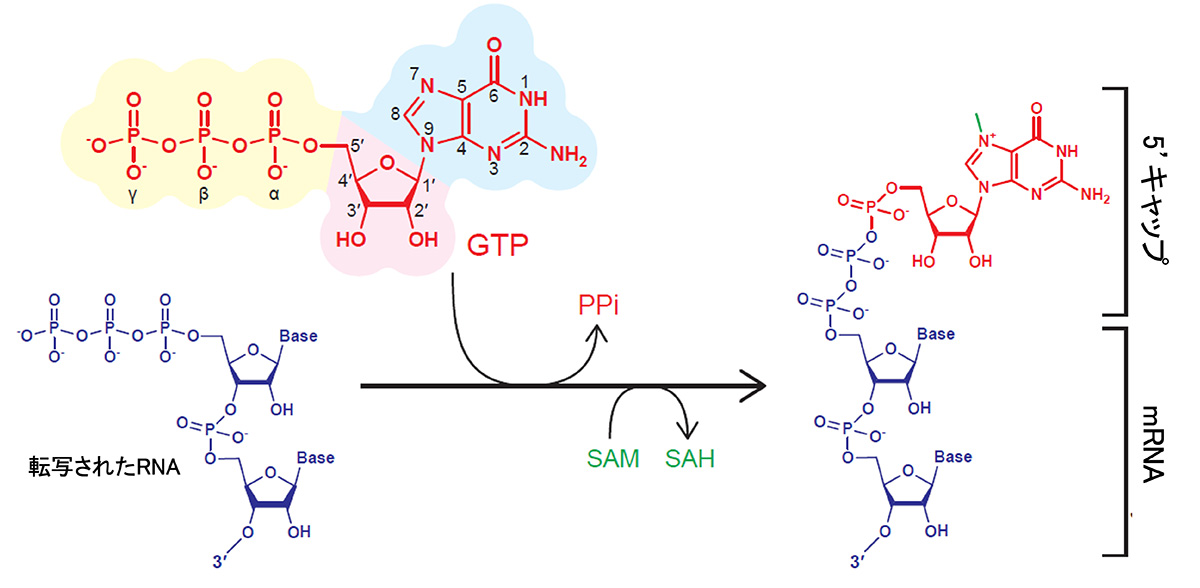
図1 VCEによる5’キャップ付加反応
この反応の中で、GTPの代わりに、さまざまな化学修飾が行われた物質(GTPアナログ)を用いることで、多様な5’キャップへの修飾を試みました。今回使用したGTPアナログは以下に示す26種類の物質です(図2)。
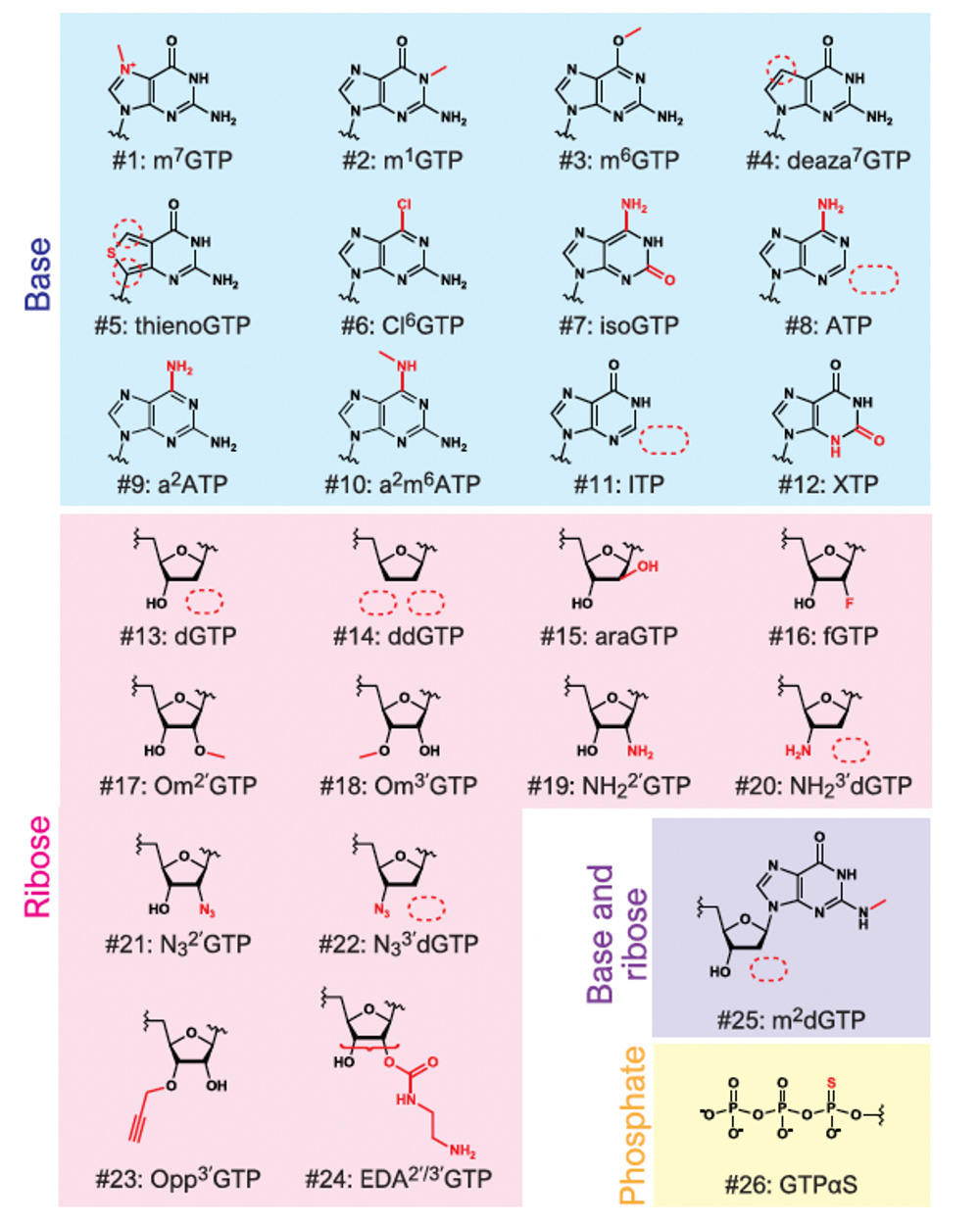
図2 今回使用したGTPアナログ
2)GTPアナログによるキャップ構造を作る効率
短いRNA(11塩基)をin vitroで合成し、図2で示したGTPアナログとVCEを使って1時間(1h)あるいは24時間(24h)反応させました。修飾された5’キャップ構造を持つmRNAを合成できているかどうか、電気泳動で確認しその効率を計算しました。その結果、VCEにより、さまざまなGTPアナログを使って、キャップ構造を作ることができることがわかりました(図3)。
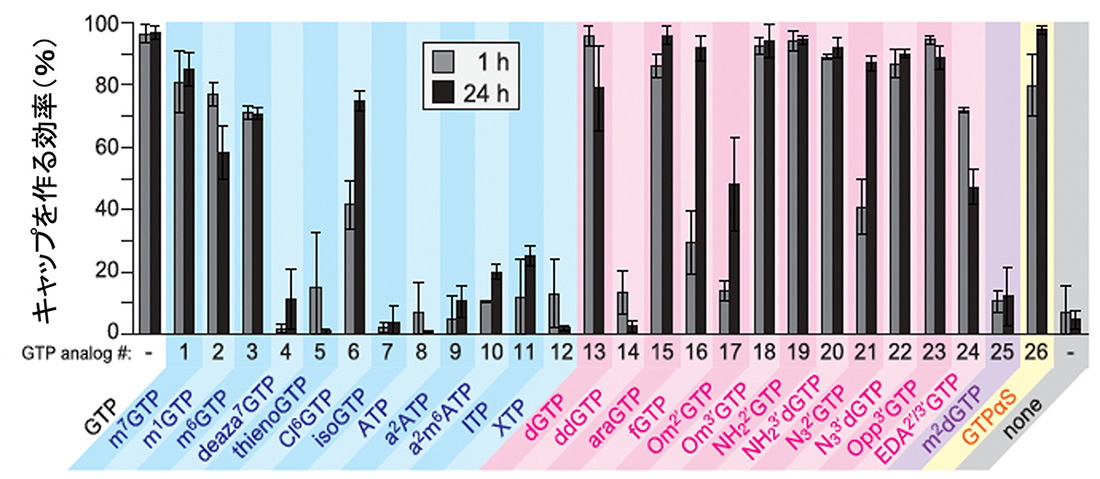
図3 VCEによるキャップを作る効率
3)合成したmRNAの翻訳活性
蛍光タンパク質であるAzami-Greenを発現するmRNAを合成し、HeLa細胞に導入しました。蛍光強度を指標に、VCEにより修飾したキャップ構造をもつmRNAがどの程度翻訳されるのか、その活性を測定しました(図4)。ほとんどの修飾キャップ構造で、蛍光が観察され、その中には天然のキャップ構造よりも翻訳効率に優れた修飾キャップも確認できました。
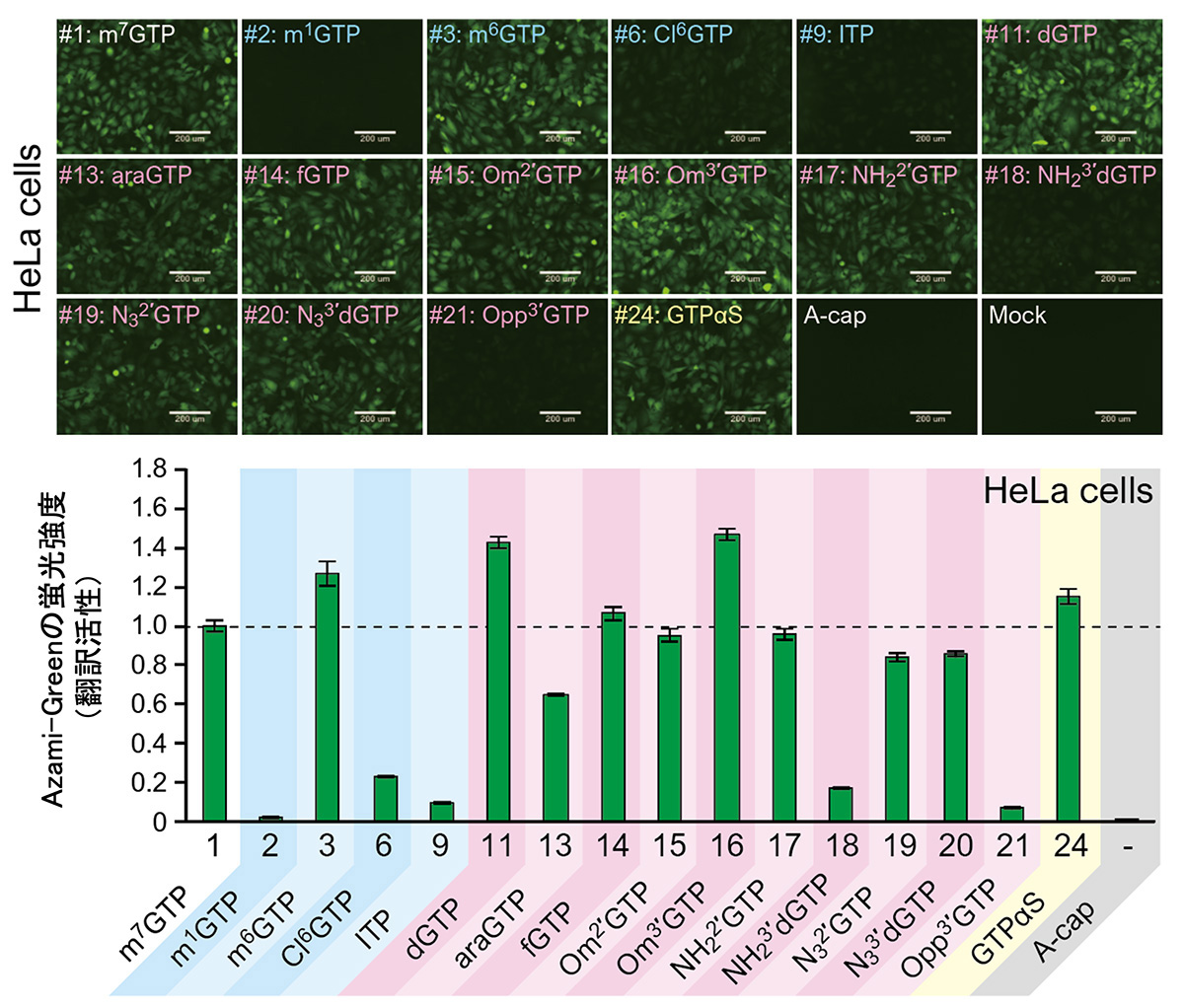
図4 HeLa細胞での翻訳活性
翻訳活性は天然のmRNAのキャップ構造であるm7GTPを基準とした相対的な値。
A-cap、Mockはネガティブコントロール。
4)アジド基を用いた複合体の形成
修飾5’キャップ構造の中には反応性の高いアジド基(-N3)をもつもの(#21、#22)もあります。このアジド基は、クリックケミストリーと呼ばれる化学反応を利用して簡単に、ビオチンや蛍光タンパク質などの機能性分子を結合させることもできます。Azami-Green(hmAG1)をコードするRNAを合成し、VCEにより5’キャップにN32‘GTPを付加しました(m7N32′G-capped(#21))。このRNAに、蛍光色素であるAF647をキャップ部に結合させました(m7N32′G-capped(#21)+AF647)。その結果、mRNAが存在している細胞質でAF647の蛍光が観察され、核ではみられませんでした。つまり、キャップを持つmRNAを特異的に標識できていると考えられます。
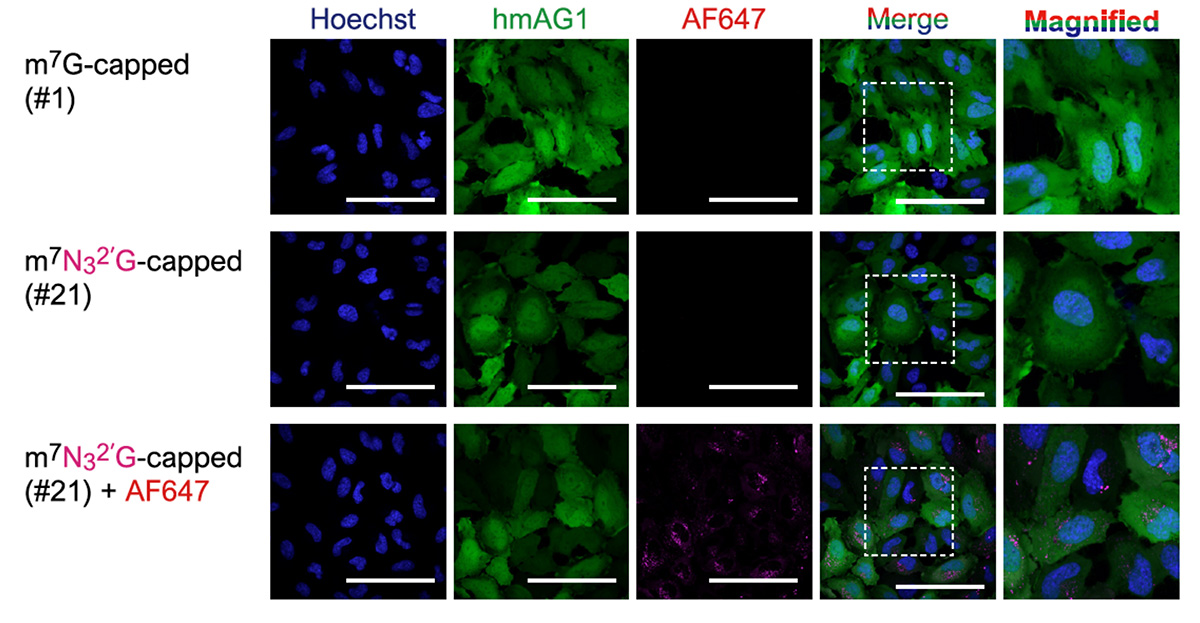
図5 蛍光顕微鏡画像
Hoechst: 核、Merge:左3つの画像の重ね合わせ、Magnified: Mergeの一部拡大画像
4. まとめ
本研究ではVCEとGTPアナログを用いることで、さまざまなキャップ修飾されたmRNAを簡便かつ効率的に調製できることを明らかにしました。また、アジド基をはじめとして、反応性の高い部位を含むキャップ修飾されたmRNAを作ることができるため、RNAの5’末端側を特異的に修飾することもできます。ビオチンや蛍光色素などと組み合わせて利用することで、さまざまな機能性mRNAの作成が可能となり、RNA治療薬や生命科学の研究分野に有用なツールを提供することが可能となります。
5. 論文名と著者
- 論文名
Versatile strategy using vaccinia virus-capping enzyme to synthesize functional 5′ cap-modified mRNAs - ジャーナル名
Nucleic Acids Research - 著者
Hirohisa Ohno1,*,†, Sae Akamine1,2,†, Megumi Mochizuki1, Karin Hayashi1, Shinichiro Akichika3, Tsutomu Suzuki3 and Hirohide Saito1,*
† 筆頭著者 * 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科
- 東京大学大学院工学系研究科
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会 科研費(15H05722, 16K21117, 20K12644, 20H05626)
- 武田科学振興財団
- 笹川科学研究助成
- 持田記念医学薬学振興財団
- 日本医療研究開発機構 (AMED) 再生医療等実現拠点ネットワークプログラム「iPS細胞研究中核拠点」(JP22bm0104001)
- iPS細胞研究基金
7. 用語説明
注1) ワクシニアウイルスキャッピング酵素(VCE)
DNAウイルスの一種であるワクシニアウイルスがもつ、mRNAの5’末端にキャップ構造を付加する反応を促進する酵素。ワクシニアウイルスは天然痘に対する生ワクチンとして用いられた。
注2) 5’キャップ
細胞質に存在するmRNAの5’末端側に見られる修飾構造。mRNAの安定性やmRNAからタンパク質への翻訳開始に関与している。
注3) GTP(Guanosine triphosphate:グアノシン三リン酸)
糖とリン酸からなるヌクレオチドの一種。細胞内のシグナル伝達やタンパク質の機能調節に広く使われている。
注4)ビオチン
水溶性ビタミンの一種。ビタミンB7、ビタミンHなどとも呼ばれる。アビジンという物質と強力な結合をすることから、特定の分子を標識する際に利用されている。