2023-03-17 東京大学
発表のポイント
◆細胞中のごく微量なミトコンドリアtRNA中の化学修飾塩基を高感度に検出・定量する方法を開発しました。
◆ミトコンドリア病患者の細胞に、tRNA修飾酵素を過剰に発現させることで、変異を持つtRNAを活性化し、ミトコンドリアの機能を回復させることに成功しました。
◆RNAの機能回復に成功した本研究は、DNA編集による治療が難しいミトコンドリア病の治療法の開発に貢献することが期待できます。
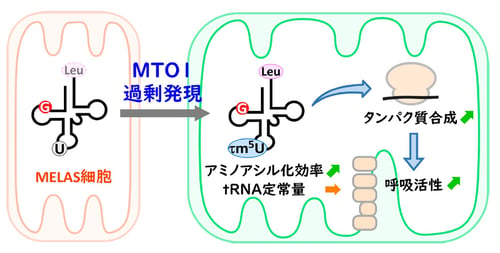
タウリン修飾(τm5U)を導入することでMELAS変異tRNAを活性化しミトコンドリア機能を回復させる
発表概要
東京大学大学院工学系研究科の友田愛奈大学院生、長尾翌手可助教、鈴木勉教授の研究グループは、ミトコンドリア病(注1)患者の細胞内でtRNA(注2)修飾酵素であるMTO1を過剰に発現させ、MELAS(mitochondrial myopathy, encephalopathy, lactic acidosis and stroke-like episodes)変異のために失われていたtRNA上のタウリン修飾(5-タウリノメチルウリジン、τm5U)(注3)を導入することに成功し、低下していたミトコンドリアの機能を回復できることを明らかにしました。
ミトコンドリアは細胞内に存在する小器官であり、呼吸することでATP(注4)を合成し、生体エネルギーの大半を供給する重要な役割を担っています。ミトコンドリア病は、ミトコンドリアDNAの変異が原因でミトコンドリアの機能が低下して生じる重篤なヒトの疾患です。ミトコンドリア病の代表病型であるMELASは、ミトコンドリアtRNAに変異があり、tRNAの機能に不可欠なタウリン修飾が形成されず、タンパク質合成が低下し、ミトコンドリアの機能が著しく損なわれ、エネルギー需要の高い脳や筋肉に重篤な障害が生じます。タウリンを過剰に摂取することで脳卒中の発生を抑える治療法が開発されましたが、脳の萎縮を止めることができず、効果的な治療法の開発が求められています。
ミトコンドリアtRNAのタウリン修飾を復活させることが、治療の鍵を握っていますが、ミトコンドリアtRNAはごく微量であり、タウリン修飾の解析は困難でした。本研究グループは、まず、少ない試料を用いてミトコンドリアtRNAのタウリン修飾を高感度で検出し定量するタウリン修飾の新しい解析法(CMC-PE法)を開発しました。実際にこの手法を用い、MELAS患者の細胞で、変異を持つtRNAのタウリン修飾率を定量することに成功しました。さらに、tRNA修飾酵素であるMTO1を過剰に発現させることで、MELAS変異tRNAのタウリン修飾率をほぼ完全に回復させることに成功しました。MTO1を過剰に発現させた細胞では、ミトコンドリアタンパク質合成能が向上すること、さらに呼吸活性が上昇することを見出しました。本研究は、ゲノム編集による治療が困難なミトコンドリア病において、tRNA修飾を導入することで、ミトコンドリア機能を改善した初めての例であり、将来的にMELASの治療法の開発に大きく貢献することが期待されます。
発表内容
〈研究の背景〉
ミトコンドリアは呼吸によって生体で消費するATPの大半を供給する細胞内小器官(オルガネラ)です。呼吸以外にも、ヘムやステロイドの生合成、細胞内のカルシウムイオンの調節、アポトーシスの因子を貯蔵し細胞死に関与するなど、細胞のさまざまな営みに関わっています。また、ミトコンドリアがATPを合成する際に生じる活性酸素が細胞の損傷や老化に関わり、細胞の病理学的な状態とも関係があることが知られています。
ミトコンドリアは核とは独立した独自のゲノム(ミトコンドリアDNA)とタンパク質合成系を持ち、呼吸鎖複合体を構成する13種類のタンパク質を合成します。したがって、ミトコンドリアのタンパク質合成系に異常が生じると呼吸鎖複合体の活性が低下し、エネルギー需要の高い脳や心臓を中心に全身多臓器に重篤な障害が引き起こされてしまいます。ミトコンドリアの機能異常を伴う疾患はミトコンドリア病と総称され、その多くの症例が母系遺伝(注5)することから、ミトコンドリアDNA上の変異が原因であることがわかっています。脳卒中を特徴とするミトコンドリア病の代表病型であるMELASは、患者の約80%がミトコンドリアDNAの3243位にAからGの点変異(図1A)を持つことが知られています。この位置は、ミトコンドリア tRNALeu(UUR)遺伝子中に存在し、この変異によってミトコンドリアtRNAが不安定化し、細胞内の存在量およびアミノアシル化(注6)効率が低下することがわかっています。さらに本研究グループの先行研究により、MELAS変異 tRNALeu(UUR)は遺伝暗号の解読に重要な役割を持つアンチコドン1字目のタウリン修飾(τm5U)が著しく減少し、未修飾ウリジンのままになっていることを見出しました(図1A)。タウリン修飾の欠損によりMELAS変異 tRNALeu(UUR)は、対応するUUAとUUGの2つのコドンのうち、UUGコドンを翻訳できず(図1A)、UUGの使用頻度が高いND6の翻訳量が低下することが明らかとなりました。ND6は呼吸鎖複合体Iの必須のサブユニットタンパク質であり、この結果は、呼吸鎖複合体Iの活性低下というMELASの生化学症状をうまく説明することができます。また、てんかんを特徴とする他のミトコンドリア病であるMERRF(myoclonus epilepsy associated with ragged red fibers)では、ミトコンドリア tRNALys遺伝子に変異(8344位がAからG)があり、MERRF変異tRNALysもアンチコドン1字目のタウリン修飾(τm5s2U)が欠損し、AAAとAAGコドンを効率よく翻訳できず、ミトコンドリアのタンパク質合成が全体的に低下することが判明しています。これらの点変異はタウリン修飾部位とは離れた位置に生じていることから、変異によりタウリン修飾酵素であるMTO1/GTPBP3複合体が基質であるtRNAをうまく認識できないために生じる現象であると考えられています。
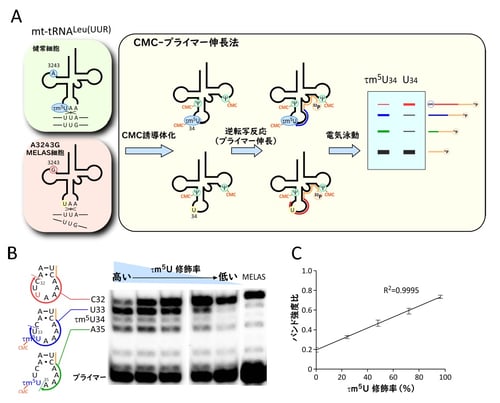
図1:CMC-PE法によるタウリン修飾(τm5U)の検出
(A)野生型とMELAS変異型のミトコンドリア(mt-)tRNALeu(UUR)(左)とCMC-PE法の概略(右)。
(B)異なるタウリン修飾率のRNA試料の混合物、およびMELAS患者細胞(右端)のタウリン修飾をCMC-PE法で解析。
(C)(B)で算出したバンド強度比とタウリン修飾率の検量線。
このようにミトコンドリアtRNAのタウリン修飾の低下がMELASやMERRFに代表されるミトコンドリア病の原因になることがわかっていましたが、これらの根本的な治療法はいまだに確立されていません。また、これらの疾患の治療法を研究開発するうえでは、ごく微量なミトコンドリアtRNAにおけるタウリン修飾率を正確に計測する技術が不可欠です。しかし、これまでの解析手法では、大量な試料が必要であることが大きな障壁になってきました。
〈研究の内容〉
これまでに、タウリン修飾の検出法としては、質量分析を用いた手法、あるいは逆転写反応を利用したプライマー伸長法(注7)がありました。質量分析法は大量の試料を要求するため、少ない細胞や組織では解析が困難であり、また多検体を調べる上で現実的ではありません。一方、従来のプライマー伸長法によるタウリン修飾の検出は、高感度であり微量サンプルでの測定は可能ですが、特定の逆転写酵素を用いる点と、繊細な条件検討を必要とする非常に難易度の高い手法であり、汎用性のある検出法として定着しないことが課題でした。そこで、本研究では、ミトコンドリアtRNALeu(UUR)のタウリン修飾を水溶性カルボジイミドであるCMC(注8)で誘導体化し、逆転写反応の阻害効果を高めることによって、非常に安定かつ高感度でタウリン修飾を定量することが可能となりました(CMC-PE法)(図1A、B、C)。
次に、MELAS患者由来の筋芽細胞のミトコンドリア機能を改善させるため、タウリン修飾酵素MTO1およびGTPBP3を過剰発現させることによってMELAS変異tRNALeu(UUR)のタウリン修飾率の回復を試みました。その結果、MELAS細胞でMTO1を過剰発現させることにより、MELAS変異tRNALeu(UUR)のタウリン修飾率(16.3%)を野生型と同程度(94.8~97.3%)まで回復させることに成功しました(図2A)。一方、MTO1のパートナーであるGTPBP3を過剰発現させてもタウリン修飾の回復は限定的であった(図2A)ことから、MELAS変異がMTO1によるtRNAの認識能を低下させているということが示唆されます。また、MTO1の過剰発現によりMELAS変異tRNALeu(UUR)の定常状態量を改善することはできませんでしたが、細胞内のアミノアシル化効率を部分的に改善できることがわかりました。さらに、MTO1の過剰発現によりMELAS細胞のミトコンドリアタンパク質合成能が向上しており、酸素消費量を解析したところ、基礎呼吸、最大呼吸、ATP産生関連呼吸、予備呼吸能が有意に改善することが判明しました(図2B)。これらの結果は、MTO1を過剰発現することにより、MELAS細胞の低下していたミトコンドリアの機能を改善できることを示しています。以上の結果は、1)タウリン修飾の著しい減少がMELASの主要な分子病因であること、2)MTO1の過剰発現によりタウリン修飾を回復することでMELAS変異tRNAが賦活化し、ミトコンドリアのタンパク質合成と呼吸活性が改善することを明確に示唆していると考えています(図3)。また、MELASと同様にMERRFの患者細胞においても、MTO1の過剰発現によりMERRF変異 tRNALysのタウリン修飾(τm5s2U)が回復することも確認できました。
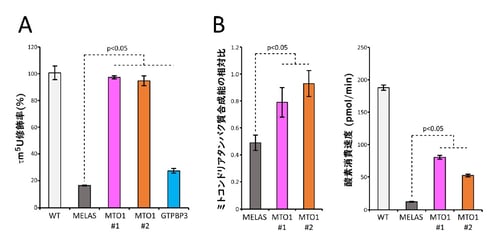
図2:MTO1過剰発現によるタウリン修飾とミトコンドリア機能の回復
(A)各細胞のミトコンドリアtRNALeu(UUR)におけるタウリン修飾率。
(B)各細胞のミトコンドリアタンパク質合成能の相対比(左)と基礎呼吸能(右)。

図3:タウリン修飾(τm5U)の回復によるMELAS変異tRNAの活性化がミトコンドリア機能を回復させる
〈今後の展望〉
本研究の成果は、ヒトミトコンドリアにおけるtRNA修飾の機能やミトコンドリア病の発症メカニズムの理解を深めるものです。また、将来的にMELASやその他のミトコンドリア病の治療法の開発にも大きく貢献することが期待されます。
発表者
東京大学大学院工学系研究科化学生命工学専攻
友田 愛奈(博士課程)
長尾 翌手可(助教)
鈴木 勉(教授)
論文情報
〈雑誌〉Nucleic Acids Research
〈題名〉Restoration of mitochondrial function through activation of hypomodified tRNAs with pathogenic mutations associated with mitochondrial diseases
〈著者〉Ena Tomoda, Asuteka Nagao, Yuki Shirai, Kana Asano, Takeo Suzuki, Brendan J. Battersby, Tsutomu Suzuki
〈DOI〉 10.1093/nar/gkad139
研究助成
本研究は、日本学術振興会JSPSの基盤研究(S)「RNAエピジェネティックスと高次生命現象」(代表:鈴木勉、26220205)、基盤研究(S)「RNA修飾の変動と生命現象」(代表:鈴木勉、18H05272)、新学術領域研究 研究領域提案型「ncRNAのケミカルタクソノミ」(代表:鈴木勉、26113003)、および科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「鈴木RNA修飾生命機能プロジェクト」(研究総括:鈴木勉、JPMJER2002)などの支援を受けて実施されました。
用語解説
(注1)ミトコンドリア病
ミトコンドリアは真核細胞に存在する細胞小器官であり、呼吸鎖複合体を用いてエネルギー分子であるATPを産生する。ミトコンドリア病とはミトコンドリアの機能が低下して生じる疾患の総称。症例の約70%がミトコンドリアDNAの変異に由来する。
(注2)tRNA
Transfer RNA(転移RNA)。タンパク質合成の際に、mRNA上の遺伝暗号(コドン)に対応するアミノ酸を運ぶアダプター分子として働く。70~90塩基長の一本鎖RNAで、二次構造としてはクローバーリーフ様構造をとり、それが折りたたまれてL字型の立体構造をとる。
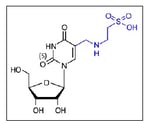
(注3)タウリン修飾
5-タウリノメチルウリジン(τm5U)のこと。ウリジン塩基のピリミジンC5位にタウリノメチル基が導入された転写後修飾。ヒトミトコンドリアにおいて、Leu(UUR)、Trp のtRNAにはτm5Uが、Gln、Glu、LysのtRNAにはチオウリジン誘導体であるτm5s2Uがアンチコドン1字目に存在する。
(注4)ATP
アデノシン三リン酸。生体エネルギーの主要分子であり、あらゆる酵素反応や細胞の運動などに使用される。主に呼吸によってミトコンドリア内での酸化的リン酸化反応で作られる。
(注5)母系遺伝
受精卵の中のミトコンドリアDNAはすべて母親由来であり、もし卵細胞の中に変異したミトコンドリアDNAがあればそれが子に遺伝する。すなわち、母方の系統のみで病気が遺伝することがわかれば、ミトコンドリアDNAの変異を疑う。
(注6)アミノアシル化
tRNA分子の3’末端にアミノ酸を共有結合すること。tRNAはアミノアシル化されることで、リボソーム上でタンパク質合成に参加できるようになる。
(注7)プライマー伸長法
放射性標識したDNAプローブを用いて逆転写反応を行い、修飾塩基が逆転写反応を阻害することを利用して標的となるRNA配列上の修飾部位を特定する手法。
(注8)CMC
N-cyclohexyl-N’–b-(4-methylmorpholinium)ethylcarbodiimide、水溶性カルボジイミドの一種。タウリン修飾側鎖の窒素原子に特異的な付加体を形成することを発見した。
Nucleic Acids Research:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkad139/7076465