2023-06-09 理化学研究所
理化学研究所(理研)脳神経科学研究センター 多階層精神疾患研究チームの小尾(永田)紀翔 客員研究員、林(高木)朗子 チームリーダーらの国際共同研究グループは、ごく少数の非常に強いシナプス[1](巨大スパイン[2])が統合失調症[3]の責任病態生理である可能性を発見しました。
本研究成果は、統合失調症をはじめとする精神疾患の病態生理解明や、新たな治療戦略の開発に寄与すると期待できます。
これまで、統合失調症の病態生理には大脳皮質の興奮性シナプス[1]が関与するとされていましたが、具体的な関係は明らかになっていませんでした。
今回、国際共同研究グループは統合失調症モデルマウスを作製し、グルタミン酸シナプス伝達を調べました。その結果、モデルマウスには巨大スパインが多く生成され、この巨大スパインを介したシナプス入力[1]が神経発火[4]を亢進すること、巨大スパインの生成を抑制すると作業記憶の低下が予防できること見いだしました。さらに、ヒトの統合失調症患者由来の死後脳においても、巨大スパインが健常人よりも有意に多いことが見いだされました。一つの神経細胞には約1万個ものシナプスがあり、神経発火には多くのシナプスが同時期に協調的に入力することが重要とされ、この仕組みを”シナプス民主主義”と呼ぶ研究者もいます。しかし統合失調症の一部では、少数の巨大スパインを介した非常に強いシナプス入力だけで神経発火が決定付けられている可能性があります。
本研究は、科学雑誌『Science Advances』オンライン版(6月9日付:日本時間6月10日)に掲載されました。
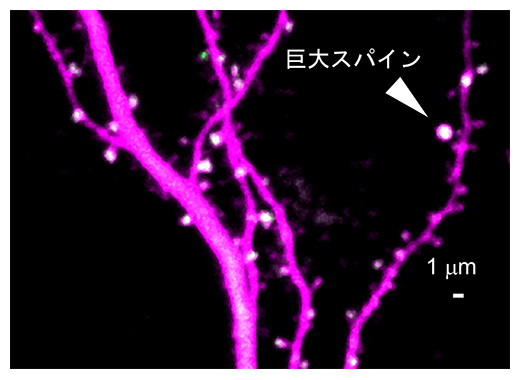
神経細胞の樹状突起に形成された巨大スパイン(矢頭)
背景
統合失調症や自閉症スペクトラム障害[5]の原因となる病態生理はまだ解明されていません。この二つはいくつかの臨床症状が共通しており、どちらにも何らかのシナプス機能の変調が関係していると考えられてきました。実際に、最先端のゲノム研究により、これら二つの症状の責任因子として共通の遺伝子多型[6]が数多く報告されており、これらの遺伝子から作られるタンパク質は大脳皮質の興奮性シナプスに多いことが知られています。
シナプスは、神経細胞と神経細胞の間の連結部のことを指します。情報を発信するシナプス前部から分泌された神経伝達物質[7]が、受け手の細胞にあるシナプス後部の受容体に結合すると、小さな電流がシナプス後部に伝わります(図1左)。
グルタミン酸は興奮性の情報を伝える主要な神経伝達物質であり、その受容体であるグルタミン酸受容体は記憶や学習など脳の高次機能に関わる重要なタンパク質です。その代表例として、AMPA受容体[8]やNMDA受容体[9]が知られており、どちらも統合失調症の病態生理に関与すると考えられています。
グルタミン酸がAMPA受容体に結合すると、シナプス後部に電流が流れ、神経細胞内の電位がプラスに押し上げられます。選挙に例えれば、賛成票が1票入ったことになりますが、その1票の効果はすぐに消えてしまいます。ところが、一定数の賛成票が0.1秒程度の短い間に投じられると神経発火が起こります(図1右)。つまり、同じ時期に同じ声をあげることが神経細胞を発火させるのに必要だというわけです。シナプスは”民主的な投票の仕組み”ともいえるので、この仕組みを”シナプス民主主義”と呼ぶ研究者もいます。
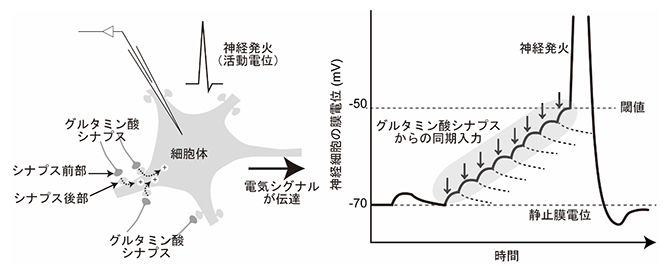
図1 脳神経回路の主要なドライバーであるグルタミン酸シナプス伝達
(左)グルタミン酸シナプス伝達の模式図。シナプス前部からグルタミン酸シナプス入力が起こると、シナプス後部に陽イオンが流入し、膜電位が上昇する。
(右)単発のシナプス入力による膜電位の上昇はすぐに減衰する。しかし、複数のグルタミン酸シナプスが同期して入力すると、膜電位は閾値(しきいち)に到達し、神経発火(電気シグナルの発生)が起こる。これは、さまざまな情報を統合する神経細胞の要となる機能である。
脳の神経回路がシナプスを介してどのように連結しているかを可視化することは、シナプスが形成されるスパイン(樹状突起スパイン)という構造物に着目することで可能になります。というのは、スパインの大きさと、そのシナプスに流れるAMPA受容体の電流には正の相関があるため、スパインの大きさを検証することで、神経回路ネットワークがどのくらいの強さのシナプスで構成されているか分かるからです。
しかし、多くのスパインは直径0.5マイクロメートル(μm、1μmは1,000分の1mm)未満の非常に小さな構造物であり、生きているヒトの脳の中で、スパインをイメージングしたり、その機能を検証したりすることは不可能です。従って、統合失調症にグルタミン酸シナプスの機能変化が関係している可能性が濃厚であるにもかかわらず、一体どのような変化が原因なのか(例えば、シナプスの数の変化なのか、大きさの変化なのか、神経演算[10]の変化なのか)は全く分かっていませんでした。
研究手法と成果
国際共同研究グループは、SETD1AとDISC1という遺伝子の機能喪失型遺伝子多型[6]に注目しました。どちらの遺伝子多型も、統合失調症の発症に大きく寄与することが報告されています。これらの機能喪失型遺伝子多型を模したSETD1Aヘテロノックアウトマウス[11]とDISC1コンディショナルノックダウンマウス[12]を統合失調症モデルマウスとして作製しました。これらのモデルマウスのスパインの大きさを、蛍光色素を注入して形態を可視化した後定量したところ、どちらのモデルマウスも非常に大きなスパイン(巨大スパイン)が野生マウスよりも有意に多いことが分かりました。典型的なスパインの直径は0.4μm程度であるのに対して、巨大スパインの直径は0.8~1.0μmもあります。
次に、巨大スパインにシナプス入力があると、そのシナプスからどれくらいの電流が流れ、細胞の膜電位がどの程度上昇するかを、電気生理学[13]的に検証しました。その結果、巨大スパインからの電流(膜電位変化)は普通のサイズのスパインからの電流よりも大きいことが示されました(図2a)。また、少数の巨大スパインへのシナプス入力による膜電位は超線形に加算されることを発見しました(図2b、c)。超線形とは、ある入力に対する出力が入力の増加に比例する以上に多く増加する現象を指します。つまり1+1が2ではなく、3や4になるような増加です。
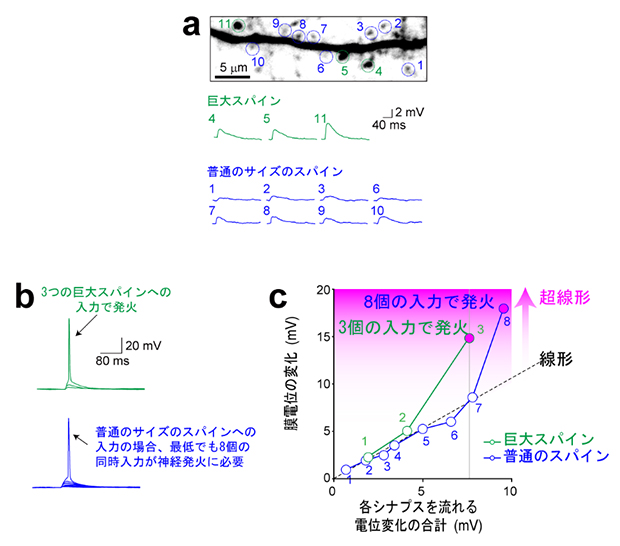
図2 シナプス入力と神経発火の関係
(a)一つ一つのシナプス入力に伴う膜電位変化。巨大スパイン(緑)へのシナプス入力は大きな膜電位変化を起こす。
(b)巨大スパインの場合、3個のシナプス入力で発火するが(上)、普通のサイズのスパインの場合、最低でも8個の同時入力が必要である(下)。
(c)各シナプスを流れる膜電位変化を単純加算すると、膜電位は黒破線上にプロットされる(線形)。巨大スパインへの入力の場合、3個の入力で発火し、その際には超線形の演算が生じている。
このような膜電位の超線形な加算は、巨大スパイン内で起こる自己再生的な電位増幅[14]によりもたらされることが薬理学的に明らかになりました。自己再生的というのは、一度イベントが始まると、それが終わるまで自己維持的に続くという意味です。この現象により、モデルマウスの神経細胞の発火頻度は増加し、神経回路は不安定になりました。
また、巨大スパインの数は作業記憶の低下と相関し(図3a)、統合失調症モデルマウスの巨大スパインの生成を光遺伝学[15]で抑制すると、作業記憶の低下を予防できました。さらに、ヒトの統合失調症患者由来の死後脳においても、巨大スパインが有意に多いことが確認されました(図3b)。前述のように、一つの神経細胞には約1万個のシナプスが存在し、多くのシナプスが同時期に協調的に入力することが神経細胞の発火に重要とされています。しかし今回、少なくともある一群の統合失調症患者では、ごく少数の巨大スパインを介した非常に強いシナプス入力だけで、神経細胞の発火が決定付けられている可能性が示されました。
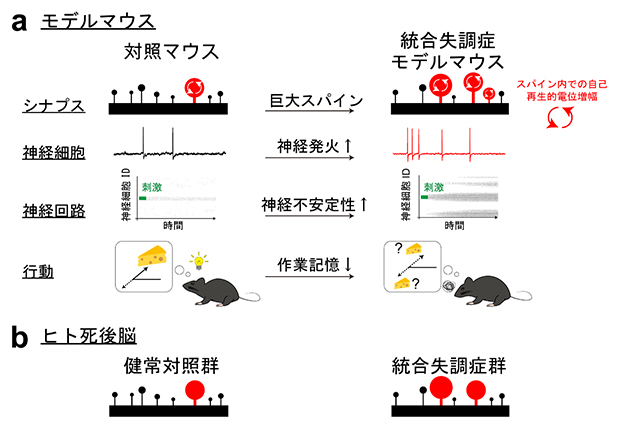
図3 本研究のまとめ
(a)統合失調症モデルマウスでは、対照マウスよりも巨大スパインの数が多く、その影響により神経発火が起こりやすい。また、神経回路が不安定となり、作業記憶も低下する。
(b)ヒト死後脳では、統合失調症患者群は健常対照群よりも巨大スパインの数が多い。
今後の期待
従来の知見から、統合失調症の病態生理には何らかのシナプス機能の変調が関係する可能性が濃厚と考えられていましたが、その具体的なメカニズムは未解明でした。本研究では、統合失調症モデルマウスのグルタミン酸シナプス機能を、シナプスから行動まで多階層に検証することにより、非常に強いシナプス(巨大スパイン)の出現が病態生理を担うことを示しました。
これは新しい仮説であり、グルタミン酸シナプスの重要性を示しています。これまでの統合失調症の治療薬はドーパミンやセロトニンといった神経伝達物質の機能を修飾する薬剤であり、グルタミン酸シナプスに作用するものはありません。少なくとも一部の統合失調症群に関しては、新たな治療戦略を開発する必要があると考えられます。
補足説明
1.シナプス、興奮性シナプス、シナプス入力
「シナプス」は神経細胞間で情報伝達が行われる特殊な微細構造。シナプス前部(送信側)神経から放出される神経伝達物質が、シナプス後部(受信側)神経の受容体に結合し、電気的または化学的な信号が伝達される。この過程により、脳内でさまざまな機能が実現され、私たちの感覚・思考・行動が生じる。神経細胞の膜電位を上昇させる作用を持つシナプスを「興奮性シナプス」、膜電位を低下させる作用のシナプスは「抑制性シナプス」という。シナプスの前部側を構成する神経細胞に神経発火が誘発されると、シナプス前部より神経伝達物質が放出される。その結果、シナプス後部にシグナル伝達が生じ、このような現象を「シナプス入力」と呼ぶ。
2.スパイン
樹状突起スパインとも呼ばれる。大脳皮質の興奮性シナプスの約8割は、スパインという小突起構造上に形成される。スパインは学習・記憶に応じて、その形態・サイズが劇的に変化し、それに伴って電気的伝達効率を変化させることから、脳機能の記憶素子と考えられている。
3.統合失調症
幻覚や妄想などさまざまな症状が現れる精神疾患の一つであり、10~20歳代の青年期~成人期にかけて発病することが多い。日常生活や対人関係に影響を与える精神疾患だが、その病態解明はいまだに不十分である。
4.神経発火
神経細胞が電気信号を発生し、それを他の神経細胞へと伝達する現象。神経発火が脳機能と密接に結び付いていることは、電気生理学的研究などで多くのエビデンスがある。
5.自閉症スペクトラム障害
対人関係やコミュニケーションが苦手といった特徴を持つ発達障害の一つ。これらの特性が少しでもあることで生活に何らかの影響を及ぼす状態から、福祉的・医療的サポートが必要な状態まで幅広く含まれる。最近の調査では、子どものおよそ20~50人に1人が自閉症スペクトラム障害と診断されるともいわれる。
6.遺伝子多型、機能喪失型遺伝子多型
ヒトのゲノムには数百万以上の遺伝子があり、それぞれが特定の機能や役割を担っている。しかし、個体間で遺伝子の塩基配列に差異が生じることがあり、これを遺伝子多型と呼ぶ。この差異によって、特定の遺伝子が異なる形質や疾患のリスクに関連していることがある。機能喪失型遺伝子多型とは、遺伝子の働きが失われるか、あるいは機能が低下する変異のこと。これにより、遺伝子がコードするタンパク質の機能が損なわれ、特定の疾患や症状の原因となることがある。
7.神経伝達物質
脳内や神経系で重要な役割を果たす化学物質。神経伝達物質は、神経細胞間の情報伝達を担当しており、神経系の正常な機能に不可欠である。神経伝達物質がシナプスを通じて放出されると、微小な空間であるシナプス間隙を横断し、他の神経細胞の受容体と結合することで信号を伝える。
8.AMPA受容体
興奮性神経伝達物質であるグルタミン酸の受容体の一種で、脳内で重要な役割を果たしている。この受容体は、神経細胞間の情報伝達において興奮性シナプス伝達を担当している。グルタミン酸がAMPA受容体に結合すると、神経細胞内にナトリウムイオンなどの陽イオンが流入し、神経活動が増強される。
9.NMDA受容体
グルタミン酸受容体の一種であり、興奮性シナプス伝達において重要な役割を果たしている。NMDA受容体はAMPA受容体とは異なり、カルシウムイオンの流入を制御する特性を持っていることと、膜電位依存的に開閉することが特徴である。AMPA受容体とNMDA受容体は、脳内の情報伝達において相互に補完し合い、神経細胞の興奮性や可塑性を調節している。このような受容体の機能に関する研究は、神経科学や脳疾患の理解、新たな治療法の開発に向けて重要な一歩となっている。
10.神経演算
シナプス入力が細胞の中で最終的にどのように集計されるかを表現したもの。例えば、シナプスAから1の入力があり、シナプスBから1の入力があったとする。単純に線形加算ならば集計値は2であるが、これが3や4(超線形)や1未満(劣線形)と計算される場合がある。さらにAかBかどちらかの入力だと1、どちらからも入力があると0というような排他的論理和というような演算が生じることも知られており、シナプス入力がどのように集計され、神経細胞の神経発火に反映されるかは非常に複雑である。
11.ヘテロノックアウトマウス
ノックアウトマウスとは、特定の遺伝子を標的として無効化(ノックアウト)することで作られる実験動物であり、ヘテロノックアウトでは一つの遺伝子が標的となり、その遺伝子の一つのアレル(対立遺伝子)が無効化される。この場合、ヘテロノックアウトマウスは、ノックアウトされた遺伝子の変異アレルを一つ持ち、もう一つのアレルは通常の機能を持っている。つまり、ヘテロノックアウトマウスは、ノックアウトされた遺伝子の効果を半減させた状態である。
12.コンディショナルノックダウンマウス
特定の遺伝子の機能を、特定の組織や時間帯で一時的または条件付きに抑制するために使用される実験動物である。通常のノックアウトマウスでは、全身の組織や全ての発達段階で遺伝子の機能が失われるため、その遺伝子の機能の役割や影響を調べることができる。しかし、一部の遺伝子は発生段階や特定の組織において重要な役割を果たしており、全身的なノックアウトでは生存や発達に重大な影響を及ぼす場合がある。そこで、コンディショナルノックダウンマウスでは、遺伝子をターゲットとする特定の組織や時間において遺伝子の機能を抑制するための方法が採用される。本研究では、生後20日目に脳の一部だけDISC1をノックダウンしている。
13.電気生理学
神経細胞が活動する際に生じる電気信号を測定・解析する方法。これにより、神経細胞の働きや情報伝達のメカニズムが明らかになる。主に電極を用いて、神経細胞の膜電位や発火パターンを調べる。このような細胞興奮現象の中核をなす電気的活動を研究する生理学的手法であり、時間分解能に優れる。
14.自己再生的な電位増幅
神経細胞の場合、膜電位が一定の閾値(しきいち)を超えると、電位依存性のチャネルが開き、陽イオンが神経細胞内に流入する。これにより、膜電位がさらに陽性方向へと変化する。一度このようなイベントが発生すると、その過程は自動的に全体が進行する。これはある種のドミノ倒しのような現象で、一度最初のドミノ(ここでは巨大スパイン上の電位依存性チャネルの開放)が倒れ始めると、最後のドミノ(ここでは電位の回復)が倒れるまで連鎖的に進行する。この現象を自己再生的な電位増幅と呼ぶ。
15.光遺伝学
光遺伝学では、特定の光敏感タンパク質(例えばチャネルロドプシンやハロロドプシン)を遺伝子組換え技術によって神経細胞に導入することにより、神経細胞が光刺激に反応し、特定の刺激に対して興奮または抑制させることが可能となる。
国際共同研究グループ
理化学研究所 脳神経科学研究センター 多階層精神疾患研究チーム
客員研究員 小尾(永田)紀翔(オビ・ナガタ・キショウ)
テクニカルスタッフⅠ 鈴木 紀光(スズキ・ノリミツ)
研究生(研究当時)三宅 隆平(ミヤケ・リュウヘイ)
テクニカルスタッフⅠ 小澤 克也(オザワ・カツヤ)
チームリーダー 林(高木)朗子(ハヤシ・タカギ・アキコ)
ピッツバーグ大学(米国)医学部 精神科・神経学・統計学・神経生物学
トランスレーショナル神経科学プログラム
准教授 マシュー・マクドナルド(Matthew L. MacDonald)
准教授 ケネス・フィッシュ(Kenneth N. Fish)
教授 ロバート・スウィート(Robert Sweet)
東京大学大学院 医学系研究科
特任研究員 長濱 健一(ナガハマ・ケンイチ)
教授 狩野 方伸(カノ・マサノブ)
上智大学 理工学部
教授 田中 昌司(タナカ・ショウジ)
昭和大学 発達障害医療研究所
講師 沖村 宰(オキムラ・ツカサ)
福井大学 医学系部門 医学領域
教授 深澤 有吾(フカザワ・ユウゴ)
研究支援
本研究は、日本医療研究開発機構(AMED)脳とこころの研究推進プログラム(領域横断的かつ萌芽的脳研究プロジェクト)「エフェクトサイズの大きな責任分子シグナルと臨床症状に立脚した精神疾患モデル系の創出(研究代表者:林(高木)朗子)」、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究「操作・モデリングから迫る精神病態シナプスパソロジーの多階層理解(研究代表者:林(高木)朗子)」、同基盤研究(C)「樹状突起スパインの形態変異を伴う統合失調症モデルマウスの電気生理学的解析(研究代表者:鈴木紀光)」による助成を受けて行われました。
原論文情報
Kisho Obi-Nagata, Norimitsu Suzuki, Ryuhei Miyake, Matthew L. MacDonald, Kenneth N. Fish, Katsuya Ozawa, Kenichiro Nagahama, Tsukasa Okimura, Shoji Tanaka, Masanobu Kano, Yugo Fukazawa, Robert A. Sweet, and Akiko Hayashi-Takagi, “Distorted neurocomputation by a small number of extra-large spines in psychiatric disorders”, Science Advances, 10.1126/sciadv.ade5973
発表者
理化学研究所
脳神経科学研究センター 多階層精神疾患研究チーム
チームリーダー 林(高木)朗子(ハヤシ・タカギ・アキコ)
客員研究員 小尾(永田)紀翔(オビ・ナガタ・キショウ)
報道担当
理化学研究所 広報室 報道担当


