2023-08-19 理化学研究所
理化学研究所(理研)生命医科学研究センター 環境応答制御研究チーム(研究当時)の角川 清和 研究員(現 理研生命医科学研究センター 炎症性免疫代謝研究チーム 研究員)、ヒルデ・シェルートレチームリーダー(現 ラホヤ免疫学研究所 教授)らの国際共同研究グループは、レチノイン酸受容体α(RARα)の新たな構造体を発見し、その構造体がT細胞受容体[1]のシグナル伝達に重要な役割を果たし、T細胞[1]を活性化することを突き止めました。
本研究成果は、病原体への免疫反応や自己免疫疾患[2]の発症メカニズムの解明に貢献すると期待できます。
レチノイン酸はビタミンAの代謝産物で、成長や発達に不可欠です。レチノイン酸受容体の一つであるRARαは核内受容体[3]として、レチノイン酸と結合し転写因子[4]として働いていると考えられていました。
今回、国際共同研究グループはT細胞の転写産物の解析から、T細胞が既報のRARα(核RARα)とは異なる構造のRARαを産生していることを見いだしました。この新たな構造体は主に細胞質に存在し(細胞質RARα)、その分子量は核RARαよりも小さいことが明らかになりました。そして、細胞質RARαがT細胞受容体およびシグナル伝達を担うタンパク質ZAP70と結合し、T細胞を活性化させることが分かりました。
本研究は、科学雑誌『Immunity』オンライン版(8月18日付:日本時間8月19日)に掲載されました。
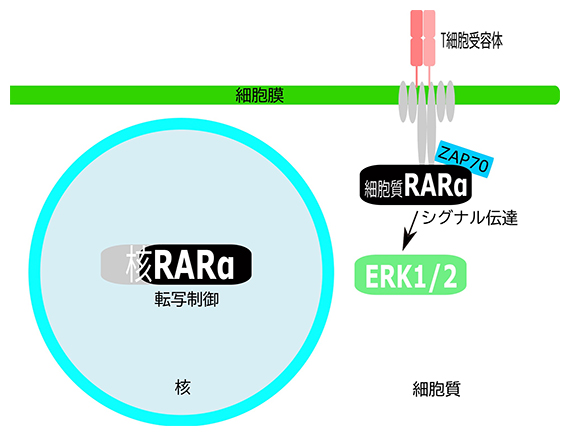
T細胞におけるレチノイン酸受容体(RARα)の二つの機能
背景
レチノイン酸はビタミンAの代謝産物で、成長や発達に必須の物質です。レチノイン酸受容体(retinoic acid receptor; RAR)は核内受容体であり、α、β、γの3種類が存在します。いずれも転写因子として、細胞成長、分化、器官形成などの重要な働きを担っています。また、免疫反応や免疫反応が起こるリンパ節などの形成などにも深く関わっています。
RARの発見は古く、発生学の分野での研究は比較的進んでいます。一方で、免疫学の分野ではその重要な働きにもかかわらず、不明な点が多く残されています。病原体やがん細胞の排除を担うT細胞においては、レチノイン酸がレチノイン酸受容体α(RARα)を活性化することで、T細胞の腸への移動、細胞増殖、制御性T細胞[5]への分化促進、炎症性T細胞[5]への分化抑制が起こることまでは分かっています注1)。しかし、これら反応の分子メカニズムはほとんど解明されていません。
注1)Larange A, Cheroutre H. Retinoic Acid and Retinoic Acid Receptors as Pleiotropic Modulators of the Immune System. Annu Rev Immunol. 2016 May 20;34:369-94. doi: 10.1146/annurev-immunol-041015-055427. PMID: 27168242.
研究手法と成果
レチノイン酸はサイトカイン[6]の一つである形質転換増殖因子β(TGFβ)とともに、T細胞を制御性T細胞(免疫反応を抑制するT細胞)へと分化させる働きを持つことが知られています。一方で、このレチノイン酸の受容体(RARα)は、細胞核で転写因子として働くことが分かっていました。
国際共同研究グループはまず、RARαの転写因子としての働きを欠損させた変異体を作製し、レチノイン酸とTGFβとともに培養し、制御性T細胞の誘導を試みました。すると、驚くべきことに、この変異体を持つT細胞においても正常に制御性T細胞が分化誘導されました(図1)。このことは、RARαが転写制御以外の働きを持つことを意味しています。
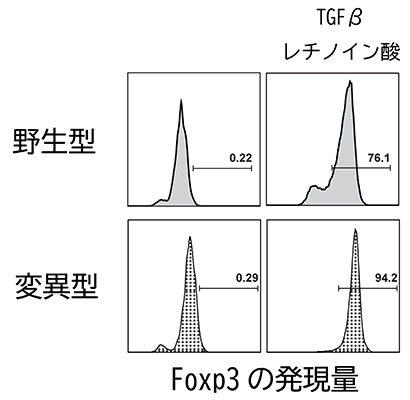
図1 制御性T細胞の誘導にはRARαの転写因子としての働きは不要
左はT細胞のみ、右はT細胞をTGFβとレチノイン酸とともに培養し、制御性T細胞への分化を調べた。Foxp3陽性細胞の発現量は、制御性T細胞の指標であり、グラフ内の数字は制御性T細胞の割合を示す。野生型とレチノイン酸受容体αが転写因子として働けない変異型とを比較すると、Foxp3陽性細胞の発現量の割合にあまり差がない。
次に、RARαがT細胞のどこに局在するのか、蛍光顕微鏡を用いて観察しました。T細胞は樹状細胞[7]などの抗原提示細胞[8]から刺激を受け、免疫反応を起こし、病原体やがん細胞を排除します。このとき、T細胞の目として働くのがT細胞受容体です。T細胞は、T細胞受容体からZAP70、ERK1/2などのシグナル伝達分子を介して活性化されたり、分化誘導されたりします。これまでRARαは細胞核内で転写因子として働くと考えられていましたが、T細胞受容体やシグナル伝達因子とともに細胞質にも局在することが明らかになりました(図2)。
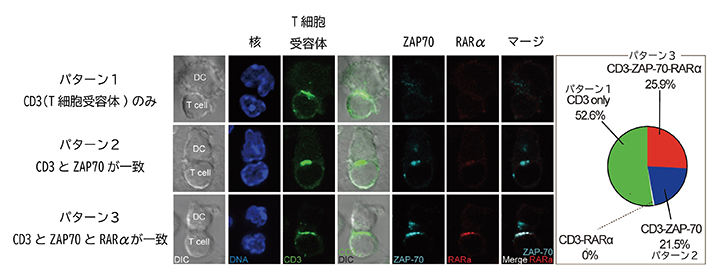
図2 RARαとT細胞受容体の局在
T細胞受容体に含まれるCD3(細胞表面マーカー)、シグナル伝達分子であるZAP70、RARαの三つの分子のT細胞内局在を調べ、3パターンに分類した。蛍光色素により核は青、T細胞受容体は緑、ZAP70はシアン、RARαは赤で示す。25.9%ものT細胞(パターン3)の細胞質で、T細胞受容体、ZAP70、RARαの集合が観察された。
この細胞質に存在するRARα(細胞質RARα)と核に存在するRARα(核RARα)とを比較するため、ウエスタンブロット法[9]を用いて分子量を調べました。マウスT細胞では、核RARαは既報の通り50.7キロダルトン[10](kD)でしたが、細胞質RARαは約38.2kDと小さいことが分かりました(図3)。
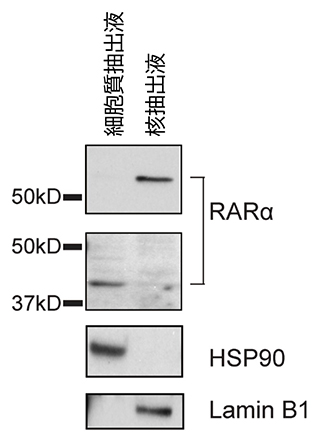
図3 細胞質RARαと核RARαのウエスタンブロット法の結果
細胞質RARαと核RARαをウエスタンブロット法で解析し、分子量を調べた。HSP90は細胞質にのみ、Lamin B1は核にのみ存在するタンパク質である。
そこで、T細胞の転写産物を詳しく調べたところ、細胞質RARαの遺伝子の転写開始点は核RARαよりも下流にあることから、細胞質RARαは本来の核RARαの一部の遺伝子がタンパク質として発現していることが分かりました(図4上段)。核RARαはN末端ドメイン、DNA結合ドメイン、リガンド結合ドメインから構成されていますが、細胞質RARαはN末端ドメインとDNA結合ドメインの一部を欠くため、転写因子としての機能は持たないと考えられます(図4下段)。
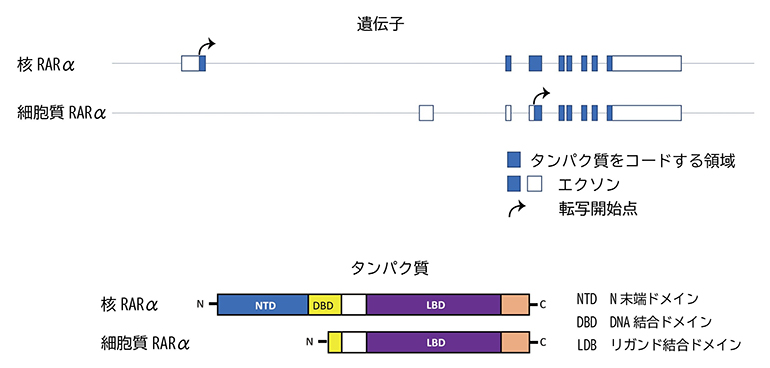
図4 核RARαと細胞質RARαの遺伝子とタンパク質の比較
(上段)二つのRARαの転写産物解析の結果。細胞質RARαは遺伝子の転写開始点が核RARαの下流(右側)にあるため、核RARαの一部が転写されてタンパク質として発現している。
(下段)二つのRARαのタンパク質の構造。細胞質RARαは、核RARαが持つN末端ドメインとDNA結合ドメインの一部を欠いている。
また、二つのRARαの細胞内局在を確認するため、緑色蛍光タンパク質(GFP)と結合させて強制発現させたところ、本来のRARα(核RARα)は核に、新たに同定した細胞質RARαは主に細胞質に観察されました。これにより細胞質RARαが細胞質でT細胞受容体シグナルをつかさどることが確認されました(図5)。
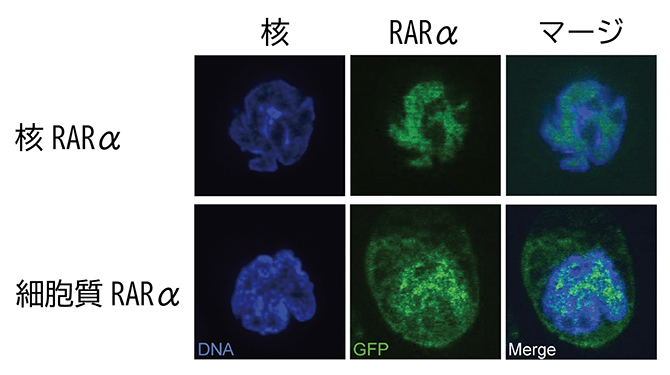
図5 新たな構造体は主に細胞質に存在
核RARαと細胞質RARαに蛍光タンパクであるGFPを結合し、それらの局在を蛍光顕微鏡で観察した。蛍光色素DAPIにより核は青、GFPによりRARαは緑に見える。上段の核RARαは核内に、下段の細胞質RARαは主に細胞質内に局在することが分かる。
今後の期待
これまで、RARαの機能は核内における転写因子にとどまると考えられていました。本研究により、新たにT細胞の細胞質でシグナル伝達因子として機能し、T細胞を活性化させることが明らかになりました。細胞質RARαを選択的に制御することで自己免疫反応を抑える制御性T細胞の分化誘導を促すことにより、自己免疫免疾患の治療に役立つ可能性があります。
また、レチノイン酸は既にさまざまな病気の治療に使われており、ドラッグリポジショニング[11]などによる臨床応用にも役立つと考えられます。
補足説明
1.T細胞受容体、T細胞
T細胞は病原体を攻撃したり、他の免疫細胞を刺激したりして抗体の生産を活性化する免疫細胞。T細胞受容体はT細胞の細胞膜上に発現し、抗原物質を認識して細胞内に活性化刺激を伝える受容体。
2.自己免疫疾患
本来は、腫瘍などの自己と異なる異物を排除して生体を守るはずの免疫システムが異常を来し、誤って自分自身の細胞や組織を攻撃してしまう疾患。関節リウマチがその代表である。
3.核内受容体
低分子の脂溶性物質が結合することにより、転写因子として働く細胞内タンパク質のファミリーで、共通するタンパクドメイン構造を持っている。
4.転写因子
DNAに配列特異的に結合するタンパク質で、プロモーターやエンハンサーといった転写制御領域に結合し、RNAポリメラーゼによる遺伝子の転写を活性化あるいは不活性化する。
5.制御性T細胞、炎症性T細胞
制御性T細胞はヘルパーT細胞に属するT細胞で、免疫反応を抑制する働きがあり、特に自己抗原に対する免疫反応を抑制する。炎症性T細胞は、炎症・疾患を誘導するT細胞のこと。
6.サイトカイン
主に免疫系細胞から分泌され、免疫シグナルを伝達する低分子タンパクの総称。
7.樹状細胞
樹状突起を持つ白血球で、病原体を認識して取り込み、感染局所に炎症反応を誘導するとともに、T細胞に異物の情報を伝える細胞。
8.抗原提示細胞
抗原を細胞内に取り込み処理してT細胞に提示することで、T細胞を活性化させる機能を持つ細胞群で、樹状細胞やマクロファージなどが含まれる。
9.ウエスタンブロット法
電気泳動によって分離したタンパク質を特殊な膜に転写した後、ある特定の抗体を利用することで目的タンパク質の存在を検出もしくは定量する方法。
10.ダルトン(D)
原子や分子の質量を表す単位。炭素12(12C)の質量の12分の1が1ダルトン(1D)と定義される。
11.ドラッグリポジショニング
既存のある病気に有効な治療薬から、別の病気に有効な薬効を見つけ出し新たな疾患の治療薬として転用すること。日本語では既存薬再開発ともいわれる。
国際共同研究グループ
理化学研究所 生命医科学研究センター
環境応答制御研究チーム(研究当時)
チームリーダー ヒルデ・シェルートレ(Hilde Cheroutre)
(現 ラホヤ免疫学研究所 教授)
研究員 角川 清和(カクガワ・キヨカズ)
(現 生命医科学研究センター 炎症性免疫代謝研究チーム 研究員)
免疫転写制御研究チーム
チームリーダー 谷内 一郎(タニウチ・イチロウ)
ラホヤ免疫学研究所(米国)自己免疫・炎症センター
研究員 髙澤 郁夫(タカザワ・イクオ)
研究員 アレキサンダー・ラランジェ(Alexandre Larange)
研究員 岩谷 一史(イワヤ・ヒトシ)
原論文情報
Alexandre LARANGE, Ikuo TAKAZAWA, Kiyokazu KAKUGAWA, Nicolas THIAULT, SooMun, NGOI, Meagan E. OLIVE, Hitoshi IWAYA, Laetitia SEGUIN, Ildefonso VICENTE-SUAREZ, Stephane BECART, Greet VERSTICHEL, Ann BALANCIO, Amnon ALTMAN, John T. CHANG, Ichiro TANIUCHI, Bjorn LILLEMEIER, Mitchell KRONENBERG, Samuel A. MYERS and Hilde CHEROUTRE, “A REGULATORY CIRCUIT CONTROLLED BY EXTRANUCLEAR AND NUCLEAR RETINOIC ACID RECEPTOR α DETERMINES T CELL ACTIVATION AND FUNCTION.”, Immunity, 10.1016/j.immuni.2023.07.017
発表者
理化学研究所
生命医科学研究センター 環境応答制御研究チーム(研究当時)
研究員 角川 清和(カクガワ・キヨカズ)
(現 生命医科学研究センター 炎症性免疫代謝研究チーム 研究員)
チームリーダー ヒルデ・シェルートレ(Hilde Cheroutre)
(現 ラホヤ免疫学研究所 教授)
報道担当
理化学研究所 広報室 報道担当