2023-08-21 東北大学
大学院薬学研究科 分子細胞生化学分野
教授 井上飛鳥
【発表のポイント】
- 細胞における機能未解明の情報伝達経路、G12シグナルを操作できる人工受容体を開発しました。
- この人工受容体を発現させた遺伝子改変マウスの解析から、G12シグナルは脂肪を燃やす働きを助けることがわかりました。
- 生体内に存在する受容体のうち、脂肪細胞に発現してG12シグナルを誘導する受容体が肥満治療薬の分子標的となる可能性を提唱しました。
- G12シグナル型人工受容体を用いた手法論を用いることで、様々な疾患に対する治療薬開発の効率化が期待されます。
【概要】
現在市販されている医薬品のうち、最も多くの種類を占めるのがGタンパク質共役型受容体(GPCR)(注1)と呼ばれる膜表面センサータンパク質(細胞外の分子情報を細胞内に伝える機能を有する)に作用するタイプの薬です。これらGPCR作用薬のほとんどは、3種類のGタンパク質シグナル伝達経路(Gs, Gi, Gq)のいずれかの機能を正常化することで薬効を発揮します。これらとは別に、G12と呼ばれるシグナル伝達経路が存在しますが、G12シグナルが薬効に寄与するかどうか不明でした。
東北大学大学院薬学研究科の井上飛鳥教授らの研究グループは、G12シグナルを誘導できるデザイナーGPCR(注2)を開発しました。このデザイナーGPCRを脂肪細胞に発現する遺伝子組換えマウスを用いることで、通常はエネルギーを貯蓄するタイプの脂肪細胞(白色脂肪)からエネルギーを消費するタイプの脂肪細胞(褐色脂肪)(注3)への転換をG12シグナルが促進することがわかりました。
GPCRの中にはG12シグナルをオンにするタイプが存在します。脂肪細胞に発現するこれらGPCRの作動薬を開発することで、脂肪を「燃やす」肥満治療薬となることが期待されます。また、この遺伝子改変マウスを利用すると、デザイナーGPCRを別の調べたい組織に発現させることが可能であり、様々な疾患に対するG12シグナルの効果を検証することが可能となります。
本研究成果は、2023年8月21日に、科学雑誌Signal Transduction and Targeted Therapyに掲載されます。
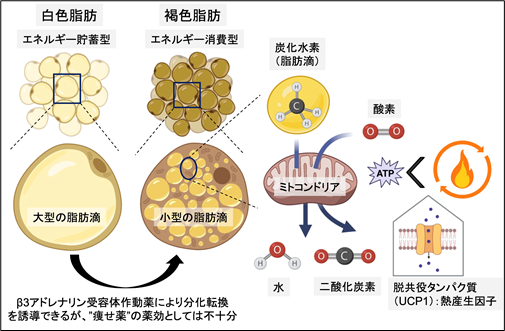
図1. 白色脂肪と褐色脂肪
白色脂肪細胞はエネルギーの貯蓄を、褐色脂肪細胞はエネルギーの消費の役割を担う。褐色脂肪細胞に豊富に含まれるミトコンドリアは、脂肪滴の脂質成分(組成は炭化水素)を”燃やして”、水と二酸化炭素に分解する。通常のミトコンドリアは、この時に細胞エネルギー通貨のATPを産生するが、褐色脂肪細胞は脱共役タンパク質(UCP1)を発現しており、熱エネルギーを産生する。
【用語解説】
注1 Gタンパク質共役型受容体(GPCR)
細胞膜表面に発現し、主に細胞外のホルモン様分子の作用を仲介する。ヒトにおいて約800種類存在し、そのうち約110種類が薬の標的となることが知られる。
注2 デザイナーGPCR
化学遺伝学(ケモジェネティクス)で使われる人工的に改変したGPCR。内因性代謝物には応答せず、元来生物活性を有さない特定の作動薬(デザイナー薬)により活性化できる。神経科学分野において、神経細胞の活性化(Gq型デザイナーGPCR)や不活化(Gi型デザイナーGPCR)の操作手法として汎用される。別名、DREADD(ドレッド)。
注3 褐色脂肪
脂肪細胞のうち熱産生能が高い細胞種。脂肪滴を代謝分解するために細胞内に大量のミトコンドリア(含有する色素により褐色を示す)を含んでおり、細胞が褐色であることからその名称が付けられている。ヒトでは肩甲骨付近に存在する。
問い合わせ先
(研究に関すること)
東北大学 大学院薬学研究科
教授 井上 飛鳥
(報道に関すること)
東北大学 大学院薬学研究科 総務係