2023-09-15 東京大学
発表のポイント
◆ 全ゲノムスクリーニング法により、これまでDNA脱メチル化薬とされてきたデシタビンの重要な作用機序として有糸分裂制御因子の関与を示しました。
◆ デシタビンは、臨床的低濃度で、DNA脱メチル化ではなく、DNMT1-DNA架橋の直接的作用により正常な有糸分裂の顕著な阻害および細胞死を誘導しました。
◆ ATR-CLSPN-CHK1経路の阻害は、デシタビンと協調的にこれらの作用を増強しました。今後実臨床におけるデシタビンの治療成績向上が期待されます。

本研究のイメージ図
本画像は、骨髄性悪性腫瘍に対するデシタビンの作用機序に関するパラダイムシフトを擬人化した寓意になります。腰に帯を巻いた着物姿の女性は、デシタビンによりDNAと共有結合したDNMT1を比喩的に表現しています。彼女はエピジェネティクスの世界(赤/右)を飛び出し、今回の論文で説明される新しい世界(白/左)へと駆け出します。
発表概要
東京大学大学院新領域創成科学研究科メディカル情報生命専攻先進分子腫瘍学の合山進教授、同大学の北村俊雄名誉教授、同大学医科学研究所癌防御シグナル分野の中西真教授、西山敦哉准教授、同大学薬学系研究科分子腫瘍薬学分野の藪下知宏特任研究員、同研究科生理科学教室の北川大樹教授、知念拓実助教らによる研究グループは、DNA脱メチル化薬(注1)のひとつとされているデシタビン(DAC、国内未承認)が臨床的な低濃度で高度な有糸分裂(注2)異常を介した細胞死を誘導すること、これらの細胞死のプロセスは、DNA脱メチル化を介さずに、DNMT1-DNA架橋(注3)の直接的作用により引き起こされることを明らかにしました。
DNA脱メチル化薬は、海外および日本において最初に承認されたエピゲノム薬であり、高リスクの骨髄異形成症候群(MDS:注4)ならびに急性骨髄性白血病(AML:注5)の治療薬として用いられています。近年では、DNA脱メチル化薬のひとつであるアザシチジン(ビダーザ®)がBCL2阻害薬(ベネクレクスタ®)との併用療法でも使用可能となり、DNA脱メチル化薬は骨髄系腫瘍における中心的な位置づけの薬剤となりました。しかしながら、DNA脱メチル化薬の作用機序については、現在もなおその詳細は不明でした。
今回の成果は、骨髄系腫瘍に対する臨床試験がはじまって以降およそ四半世紀にわたり、DNA脱メチル化薬と考えられてきた概念からのパラダイムシフトを起こす重要な知見となります。さらに、今回の全ゲノムスクリーニング法により、デシタビンの上記の作用機序を増強させる併用療法の分子標的として、ATR-CLSPN-CHK1経路(注6)を同定しました。これらの発見は、今後のデシタビンを含めたDNA脱メチル化薬を用いた骨髄系腫瘍に対する治療成績の向上に寄与すると期待されます。
本研究成果は9月14日に国際科学誌「Cell Reports」(オンライン版)で公開されました。
発表内容
<研究の背景>
DNA脱メチル化薬は、エピゲノム薬として欧米ならびに日本国内で最初に承認された薬剤で、デシタビンやアザシチジンなどが代表的な薬剤となります。これらの薬剤は、骨髄異形成症候群(MDS)や急性骨髄性白血病(AML)の治療薬として現在臨床で使用されています。DNA脱メチル化薬は(造血幹細胞移植という根治的な治療法を除けば)、MDS患者の予後を改善した唯一の治療法であり、現在も治療の中心的薬剤です。近年では、複数の経口薬や併用療法などが開発され、これらの薬剤の重要性がますます高まっています。
しかし、DNA脱メチル化薬の開発の経緯は、紆余曲折を経て現在に至りました。1960年代に開発された当時は毒性が強く、治療薬としての開発が一旦断念されていました。しかし、1980年に細胞毒性を示さない低用量でDNAの脱メチル化により細胞分化を誘導することが報告され、再度DNA脱メチル化薬としての開発に注目が集まりました。実際に、現在承認されているDNA脱メチル化薬の投与量ならびに投与様式は、この非細胞毒性濃度とされる低濃度を最高血中濃度とし、DNA低メチル化を効率的に誘導できるように設計された臨床試験に基づいています。
これまでDNA脱メチル化がどのように抗腫瘍活性を示すのかについては、様々な説明がなされてきました。癌抑制遺伝子のプロモーター領域のCpGアイランド(注7)における癌細胞特異的にみられる過剰なDNAメチル化は、しばしば、がん抑制遺伝子の発現を低下させています。これは、DNA脱メチル化薬によりこれらの遺伝子の発現抑制が解除されることで抗腫瘍活性につながる、というものが代表的な説明のひとつです。しかしながら、どの特定の癌抑制遺伝子が重要なのか実際に臨床試験で検証できたものはひとつとしてなく、作用機序の本質を明らかにすることは極めて重要な課題でした。
<研究の内容>
今回、本研究グループでは、CRISPR活性化システムを用いた全ゲノムスクリーニングを行い、DNA脱メチル化薬とされるデシタビンの真の作用機序・耐性機構を明らかにすることを目標としました。
まず、デシタビンの骨髄系腫瘍における本質的な作用点・経路を探索するために、MDS由来AML細胞株にSunTagシステム(ME Tanenbaum et al., 2014, Cell)という任意の遺伝子発現を誘導できるシステムを導入し、全ゲノムCRISPR活性化(CRISPRa:注8)スクリーニングをおこないました。その結果、CDK1、CDC20、CDCA8などの有糸分裂制御因子がDACの治療抵抗性に関与していることを明らかにしました。本スクリーニング法を用いることで、CRISPR/Cas9(注9)を用いた機能喪失型スクリーニングでは検出が難しい必須遺伝子を同定することが可能になりました。実際に臨床的な低濃度のデシタビンは、二次性AML細胞株を中心に多くの骨髄系腫瘍の細胞株で、高頻度に染色体異数性が誘導されました。
しかしながら、骨髄系細胞株の有糸分裂を観察する際には、浮遊細胞であるため各細胞は短時間で観察視野から消失し、長期的な観察が難しいことが問題となります。そこで、東京大学大学院薬学系研究科生理化学教室の北川大樹教授、知念拓実助教との共同研究にて、卵母細胞の培養法を参考にして、浮遊細胞の有糸分裂過程を長期間観察できる新しいタイムラプス撮影システム(注10)を確立しました。この新しいイメージングシステムを用いることで、観察対象の移動度を下げることができ、骨髄系腫瘍細胞の有糸分裂過程を詳細に観察可能となりました。
その結果、デシタビンは臨床的な低濃度で、MDSやAMLの細胞に、高頻度で多極分裂(注11)や細胞質分裂異常などの高度な有糸分裂異常を誘導することがわかりました。一方で、上記のような有糸分裂異常は、DNA脱メチル化の原因とされているDNMT1発現低下をCRISPR/Cas9による遺伝子編集技術でおこなっても、再現されませんでした。これは、デシタビンの作用に重要な有糸分裂異常が、DNA脱メチル化でない他の原因によって引き起こされることを示していました。表現型解析により、DACによるこれらの有糸分裂異常は、DNA脱メチル化ではなく、DNMT1がDNAと異常な共有結合によって形成された架橋構造(adducts)によって引き起こされることを示しました。
これらの所見は、現在DACの適応疾患である骨髄系腫瘍に対してはエピゲノムの側面のみならず、DNMT1-DNA架橋産物による直接的な影響、特に正常な有糸分裂進行を阻害する作用の重要性を示唆しています。したがって、本研究は約四半世紀にわたりエピゲノム薬と考えられていたデシタビンの作用機序におけるパラダイム・シフトを提案しています。
また、本研究の全ゲノムスクリーニングにより、デシタビンの効果が十分でない骨髄系腫瘍に対して、有力な併用療法の候補を同定しました。ATR阻害剤(Ceralasertib)やCHK1阻害剤(Rabusertib)の投与は、デシタビンと協調的に有糸分裂の破綻ならびに細胞死を誘導しました。その他、コレステロール合成も一部の骨髄系腫瘍に対してDACの治療抵抗性に関わることがわかりました。コレステロール合成阻害薬であるスタチンは、実臨床で用いられている薬剤ですが、高用量での投与は有糸分裂阻害作用を介してDACと協調的に細胞死を誘導することを示しました。
<今後の展望>
骨髄系腫瘍に対するDNA脱メチル化薬を用いた治療は、今後さらに中心的な位置づけになると予想されます。今回、デシタビンの本質的な作用点を明らかにしたことで、今後デシタビンが有効な骨髄系腫瘍の亜群の抽出、適切な予後の層別化、新規のデシタビン併用療法の開発に非常に有用であると考えられます。
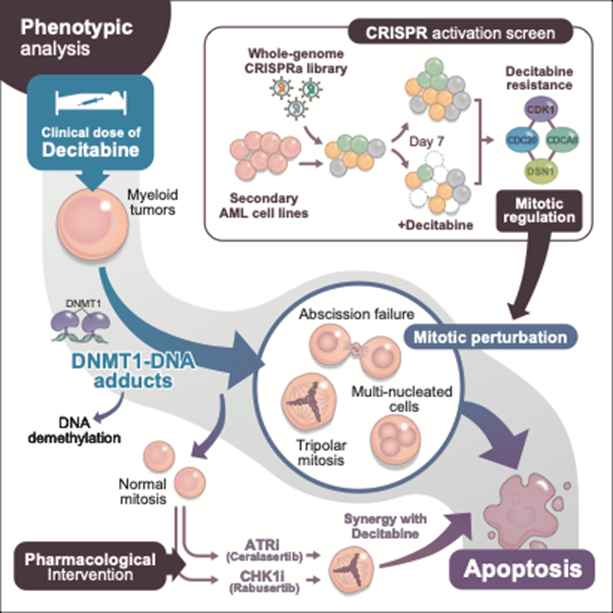
図:本研究の概略図
MDS/AML細胞株を用いた全ゲノムCRISPR活性化スクリーニング(右上)により、CDK1・CDC20・CDCA8・DSN1などの有糸分裂制御因子がデシタビン治療抵抗性因子として同定された。DACは臨床的な低濃度でMDSやAMLの細胞に、高頻度で多極分裂などの高度な有糸分裂異常を誘導した。上記の有糸分裂異常は、DNA脱メチル化ではなく、DNA-DNMT1架橋によって引き起こされることを示した。さらに、ATR-CHK1経路の阻害は、デシタビンと協調的に有糸分裂阻害・アポトーシスを誘導した。
<研究助成>
本研究は、科研費「骨髄異形成症候群(MDS)の病態解明と治療戦略(課題番号:20H00537)」、「タンパク質間相互作用制御に基づく転写・エピゲノム因子標的療法の開発(課題番号:19H03685)」、「骨髄異形成症候群における共通の分子基盤の解明(課題番号:19J21723)」の支援により実施されました。
発表者
東京大学
大学院新領域創成科学研究科 メディカル情報生命専攻 先進分子腫瘍学分野
合山 進(教授)<研究当時:東京大学医科学研究所 細胞療法分野 准教授>
大学院薬学系研究科 分子腫瘍薬学 社会連携講座
藪下 知宏(特任研究員)<研究当時:東京大学医科学研究所 細胞療法分野博士課程大学院生、日本学術振興会特別研究員 DC1>
大学院薬学系研究科 生理科学教室
北川大樹(教授)
知念拓実(助教)
医科学研究所 癌防御シグナル分野
中西真(教授)
西山敦哉(准教授)
北村 俊雄(東京大学名誉教授)<兼 神戸医療産業都市推進機構 先端医療研究センター センター長/研究当時:東京大学医科学研究所附属先端医療研究センター細胞療法分野 教授>
論文情報
〈雑誌〉「Cell Reports」(9月14日付けオンライン版)
〈題名〉 Mitotic Perturbation is a key mechanism of action of decitabine in myeloid tumor treatment
〈著者〉 Tomohiro Yabushita, Takumi Chinen, Atsuya Nishiyama, Shuhei Asada, Ruka Shimura, Tomoya Isobe, Keita Yamamoto, Naru Sato, Yutaka Enomoto, Yosuke Tanaka, Tomofusa Fukuyama, Hitoshi Satoh, Keiko Kato, Kaori Saitoh, Takamasa Ishikawa, Tomoyoshi Soga, Yasuhito Nannya, Tatsuo Fukagawa, Makoto Nakanishi, Daiju Kitagawa, Toshio Kitamura, Susumu Goyama*
用語解説
(注1)DNA脱メチル化薬
DNAメチル化(DNAの代表的な化学修飾であるメチル化修飾)を解除する薬剤。DNA メチル化異常は突然変異や染色体欠失とならんで、がん抑制遺伝子の不活性化の原因であり、がんの発生・進展に関わると考えられている。現在利用可能なDNA脱メチル化薬は、DNAメチルトランスフェラーゼ1(DNMT1)の活性を阻害する(DNMT1阻害薬)。
(注2)有糸分裂
1組の姉妹染色分体を二つの娘細胞に正確に均等分配する生命の維持に極めて重要な過程。有糸分裂期は、前期・中期・後期・終期に分かれ、前期では染色体凝縮し、中期では染色体の赤道面整列、後期では染色体分離、終期では姉妹染色体分体の脱凝縮が起こる。
(注3)DNMT1-DNA架橋
定常状態において、DNAには複製・転写・修復・組み換えなどに関わる様々なタンパク質が可逆的に結合し、ゲノム機能を制御・維持している。薬剤の添加のみならず、生理的条件下においてもDNAと結合タンパク質の間に共有結合を介したDNA架橋を形成することがあり、ゲノム損傷のひとつの様式とされる。DNMT1-DNA架橋はその一つである(DNMT1:メチル基をゲノムDNA のシトシンヌクレオチドに付加する酵素で、DNA 複製後のメチル化パターンの維持を担う必須タンパク質)。
(注4)骨髄異形成症候群(MDS)
骨髄中の造血幹細胞に遺伝子変異などの異常の蓄積が起き、正常な血液細胞の産生ができなくなる状態を指す症候群。正常な血液細胞の減少により、臨床的には、貧血・出血傾向・感染に伴う発熱などの症状を呈する。臨床所見とあわせて、骨髄の血液細胞の形態異常(異形成)に基づいて診断をおこなうため、そのように呼ばれる。
(注5)急性骨髄性白血病(AML)
骨髄中で骨髄芽球(白血球に分化する過程の未熟な細胞)に遺伝子変異や染色体転座などの異常が起こり、がん化した細胞(白血病細胞)が骨髄で異常に増える疾患。骨髄異形成症候群(MDS)から移行した場合には、特に二次性AMLと呼ばれる。
(注6)ATR-CLSPN-CHK1経路
DNA損傷を受けた細胞は、DNA 障害チェックポイントを活性化させることで、細胞周期を停止させる。ATM-CHK2経路は主にG1/Sチェックポイントで機能するのに対して、ATR-CHK1経路は主にS期のDNA複製チェックポイントならびにG2/Mチェックポイントで機能する。また、後者の経路におけるATRによるCHK1のリン酸化修飾・活性化には、CLSPNのCHK1との結合が必要とされる。
(注7)CpGアイランド
シトシンの次にグアニンが現れるタイプの2塩基配列(ジヌクレオチド)であるCpGサイトの出現頻度が、ゲノム中で他と比べ高い領域を指す。ヒトゲノムにおいて、遺伝子プロモーター領域の約70%がCpGアイランドを含む。CpGアイランドは正常細胞においてはメチル化されていないが、癌細胞ではしばしばCpGアイランドのメチル化による遺伝子転写抑制がみられる。
(注8)CRISPR活性化
CRISPR/Cas9から派生した新しい遺伝子発現調節技術で、内在性の遺伝子発現の活性化を誘導する。DNAの切断活性を欠失させた変異体(dCas9)と非特異的転写誘導ドメインの融合タンパク質を用いることで、標的遺伝子の発現を活性化することが可能となる。これまでに、VPR、SAM、SunTagといった3つの手法が異なるグループから報告されている。SunTagがVP64(転写活性化ドメイン)に結合する抗体をリクルートするペプチドアレイであり、今回のスクリーニングでも本手法を用いた。
(注9)CRISPR/Cas9
DNAの二本鎖切断を原理とする遺伝子改変ツール。標的部位に対してRNA(ガイドRNA)を設計し、Cas9と共導入します。gRNAがゲノム上の標的配列を認識し、Cas9ヌクレアーゼがゲノムDNAの両鎖を切断し二重鎖切断を誘導する。
(注10)タイムラプス撮影システム
一定の間隔ごとに連続して画像を撮影し、観察対象の動きを長時間にわたり撮影する撮影手法。インキュベータ内で観察を同時に行うことで細胞の外部環境を変えることなく観察を実行でき、定常状態の長期観察が可能となった。
(注11)多極分裂
紡錘体の極を2つに限定することが染色体の均等分配にとって重要である。通常は中心体と呼ばれる細胞内小器官が紡錘体の極として機能している。多極分裂とは、3つ以上の極を形成した染色体の不均等分配を指し、癌細胞ではしばしば観察される。
お問い合わせ
新領域創成科学研究科 広報室