2020-10-22 次世代天然物化学技術研究組合,産業技術総合研究所,北里研究所北里大学,バイオ産業情報化コンソーシアム,日本医療研究開発機構
上市されている医薬品の6割は天然物由来、あるいは天然化合物の構造を模倣して開発された化合物です。天然化合物は人知を超えたユニークな構造を持つことが魅力の一つですが、その構造が複雑であるが故に、医薬品開発における副作用軽減などのための化学合成では誘導体展開が困難、特に母核改変については極めて困難であるという問題を抱えています。一方で、新しい創薬ターゲットに適したリソースとして、低分子と抗体などの高分子医薬品の間の分子量の大きさを埋める中分子化合物ライブラリーの整備が切望されており、中分子天然化合物が再注目されています。
国立研究開発法人産業技術総合研究所および次世代天然物化学技術研究組合の新家研究グループ長、および学校法人北里研究所北里大学の池田治生特任教授らの研究グループは、この天然化合物の医薬品開発における弱点を克服するため、中分子天然化合物の母骨格改変技術の開発を行いました。本研究グループは、通常細胞内で用いられるCRISPR/Cas91)によるゲノム編集技術を試験管内で用い、組換え遺伝子断片の連結に適したGibson assembly2)技術と組合せることで、遺伝子操作によってモジュールを交換する技術(モジュール編集技術)を確立しました。本技術をラパマイシン生合成遺伝子に適用することで、機能改変遺伝子を多数構築し、ホスト微生物に導入、培養することで、18種類の母核改変ラパマイシンを生産することに成功しました。
このように、既存の生物活性物質の母核を改変することができる本技術を、今後は様々な化合物へ応用することで、新たな活性物質の発見や、構造活性相関の理解につながることが期待できます。
研究開発のポイント
- 化学合成では極めて困難な中分子天然化合物の母核改変を、生合成遺伝子の精密な編集によって実現することに成功した。
- 従来の遺伝子操作技術とは異なり、通常細胞内で用いられるCRISPR/Cas9によるゲノム編集を試験管内で行い、Gibson assemblyと組み合わせることで精密な遺伝子編集技術を確立した。
- この技術を用いることによって、当初の予想より高い成功率で母核改変化合物を生産可能であることが示され、今後の創薬における問題点、すなわち中分子天然化合物の誘導体展開を克服することが大きく期待される。
研究概要
生合成遺伝子の機能改変においては、一塩基のエラーも無く、デザイン通りの遺伝子配列を作り上げることが求められます。しかし、中分子天然化合物の生合成遺伝子は、10万塩基以上にもおよぶ遺伝子群からなるものも多く、従来の遺伝子組換え法や制限酵素を用いた手法では、本遺伝子を正確に改変することは極めて困難でした。特に、ポリケタイドと呼ばれる化合物群は、駆虫薬エバーメクチンや、抗菌薬エリスロマイシン、抗腫瘍薬・免疫抑制薬ラパマイシンなど重要な生物活性を示す中分子天然化合物を数多く含んでいますが、その生合成の鍵となる遺伝子は高度かつ相互に類似した配列の繰り返し単位からなるため、遺伝子改変のための技術および方法論が欠如していました。この繰り返し単位は、翻訳産物であるポリケタイド合成酵素の機能単位(モジュールと呼ぶ)と一致しており、正確な遺伝子編集により酵素の機能、すなわち生産される中分子化合物の構造改変が可能になると考えられています。そこで本研究グループは、通常細胞内で用いられるCRISPR/Cas9によるゲノム編集技術を試験管内で用い、組換え遺伝子断片の連結に適したGibson assembly技術と組合せることで、モジュール編集技術を確立しました(図1)。本研究では、ラパマイシン生合成遺伝子に本技術を適用することで、機能改変遺伝子を多数構築し、ホスト微生物に導入、培養することで、デザイン通りに18種類の母核改変ラパマイシンを生産することに成功しました。
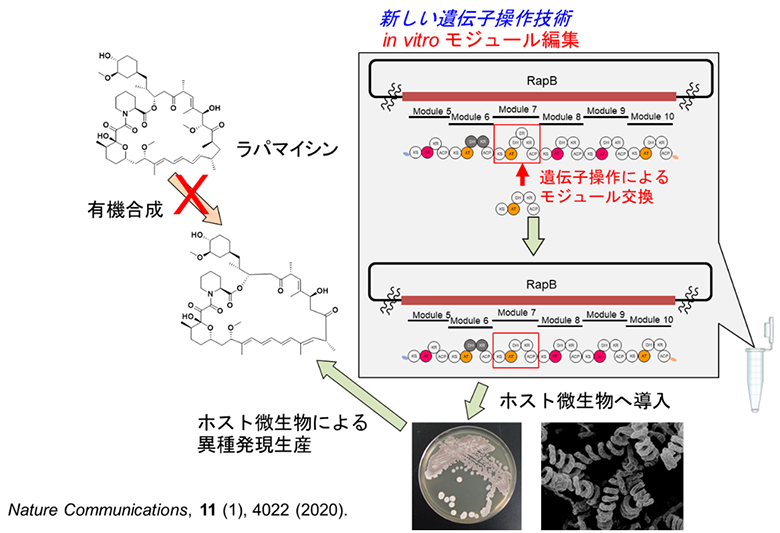
研究グループは、ラパマイシンの母核について、環サイズの拡大縮小、メチル基の有無、二重結合の有無、酸化度の制御、水酸基の立体制御をデザインし、いずれも狙い通りに生産できることを実証しました。ポリケタイドは数個から10個以上(ラパマイシンでは14個)のモジュールが順に機能することによって生合成されますが、あるモジュールによって生合成される部分構造は、モジュールの構成によって規定されています(図2上段)。例えば、KS-AT-DH-KR-ACPという構成のモジュール(右から2番目)をKS-AT-DH-ER-KR-ACPという構成のモジュール(一番右)と交換することによって、ラパマイシンの特定の位置の二重結合を単結合へと改変することができました(図2下段)。このほか、研究グループは計18個の母核改変化合物を設計し、それらを異種発現生産することに成功しました。この中には、従来の遺伝子組換え技術では遺伝子配列を構築すること自体が不可能であったものも含まれることから、本技術の高い汎用性が示されました。また興味深いことに、いくつかの母核改変化合物について、細胞増殖阻害活性試験およびタンパク質相互作用(FKBP-mTOR相互作用促進活性3))を行ったところ、細胞増殖阻害活性は著しく減弱するがFKBP-mTOR相互作用促進活性はラパマイシンと同等の活性を示す新規誘導体を創製する結果を得ることに成功しました。このように、既存の生物活性物質の母核を改変することができる本技術を、今後は様々な化合物へ応用することで、新たな活性物質の発見や、構造活性相関の理解につながることが期待できます。
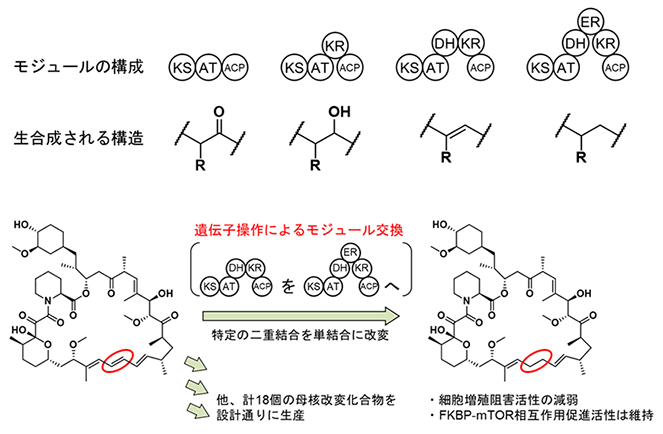
(下段)ラパマイシンを用いた具体例。特定の二重結合を単結合に改変するなど、計18個のラパマイシン誘導体を設計通りに生産。
本研究以前は、このようなモジュール編集はほんの一部のポリケタイド系化合物にしか適用できず、遺伝子配列の改変ができたとしても、化合物の生産には至りませんでした。しかし、本研究において方法論が確立したことによって様々な検証が可能となり、予測されたよりも高い成功率で中分子天然化合物の母核改変化合物が生産可能であることが明らかとなりました。また、本技術は研究グループが開発を続けてきた巨大遺伝子(バクテリア人工染色体)の取り扱い技術と、クリーンホストにおける異種発現技術を土台とした独自性の高いものです。今後は、本技術を基盤として、インシリコ解析等との組み合わせにより、合目的に望んだ構造をもった中分子天然化合物、あるいは副作用などの弱点を克服した天然化合物を創製するなど、創薬における問題点が克服されていくものと考えられます。
なお、本研究成果は、2020年8月11日に英国科学誌『Nature Communications』のオンライン版に掲載されました。
用語解説
- 1)CRISPR/Cas9
- CRISPR(clustered regularly interspaced short palindromic repeat)は短いリピート配列とスペーサー配列の繰返しからなる非翻訳配列であり、Cas9はヌクレアーゼ。元々は原核生物の一種の獲得免疫機構を構成する要素であるが、任意のターゲット配列を人工的に組み込んだ一本鎖RNAを用いることで、特定の塩基配列を認識・切断する遺伝子工学的ツールとして利用されている。
- 2)Gibson assembly
- 3種の酵素の混合試薬を用いたDNA断片の連結手法。開発者の名前を取ってGibson assemblyと呼ばれている。数十塩基の相同配列をのりしろとした、いわゆるseamless cloning(余分な配列が残らない)であるため、制限酵素の認識配列に拠らない配列を設計・構築可能である。
- 3)FKBP-mTOR相互作用促進活性
- ラパマイシンの作用機序。ラパマイシンがFKBP(FK506 binding protein;別の免疫抑制薬であるFK506の標的分子として発見された)と結合すると、mTOR(mammalian target of rapamycin)との相互作用が惹起される。mTORは様々な細胞内シグナル経路の上流に位置するキナーゼであり、FKBP-ラパマイシン-mTOR複合体が形成されることで様々な生理作用(抗腫瘍活性や免疫抑制活性など)が生じる。
特記事項
※この研究は、日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業(革新的中分子創薬技術の開発/中分子製造技術の開発)」の支援によって行われました。
論文情報
- 雑誌名
- Nature Communications(2020年8月11日)
- 論文タイトル
- In vitro Cas9-assisted editing of modular polyketide synthase genes to produce desired natural product derivatives
- (所望の天然化合物誘導体製造のための試験管内Cas9反応を利用したモジュラー型ポリケタイド合成酵素遺伝子の編集)
- 著者
- Kei Kudo, Takuya Hashimoto, Junko Hashimoto, Ikuko Kozone, Noritaka Kagaya, Reiko Ueoka, Takehiro Nishimura, Mamoru Komatsu, Hikaru Suenaga, Haruo Ikeda & Kazuo Shin-ya
- DOI番号
- 10.1038/s41467-020-17769-2
お問い合わせ先
内容に関するお問い合わせ
国立研究開発法人産業技術総合研究所
生命工学領域 細胞分子工学研究部門 最先端バイオ技術探求グループ
研究グループ長 新家一男(しんやかずお)
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
創薬事業部 医薬品研究開発課
次世代治療・診断実現のための創薬基盤技術開発事業担当