免疫チェックポイント阻害薬治療耐性の克服を目指す
2019-03-14 がん研究会,日本医療研究開発機構
1.概要
私たちの体は、体外から侵入した細菌やウィルス等の異物を排除し自己を守る免疫防御機構を持っており、体内で発生したがん細胞の排除にも重要な働きをしています。しかしながら、2018年にノーベル賞を受賞された本庶佑博士らをはじめとする様々な研究者らによって、がんはPD-1並びにそのリガンドであるPD-L1などの「免疫チェックポイント分子」と呼ばれる免疫抑制性因子を巧みに利用して、免疫システムによる排除から逃れて増殖していることが明らかにされてきました。この免疫逃避機構を解除することにより免疫細胞が再活性化し、がん細胞を再び殺傷できるようになることが実験的に証明され、現在では、この概念を応用した「免疫チェックポイント阻害薬」が肺がん、悪性黒色腫など幅広いがん腫で臨床応用されています。特に、免疫チェックポイント阻害薬はこれまでの化学療法や分子標的療法ではあまり見られなかった2~3年を超える長期奏効例が、一部の患者で観察されています。その一方で、治療耐性となり腫瘍が再増悪する(獲得耐性)症例も多く観察され始めています。これまでの免疫チェックポイント阻害薬に対する治療耐性の研究は、ニボルマブをはじめとする抗PD-1抗体薬を対象としたものが多く、免疫細胞ががんを攻撃する目印(抗原提示)が消失してしまうといったメカニズムなどが明らかにされてきました。しかしながら、抗PD-L1抗体薬に対する治療耐性メカニズムについては、ほとんど明らかになっていませんでした。
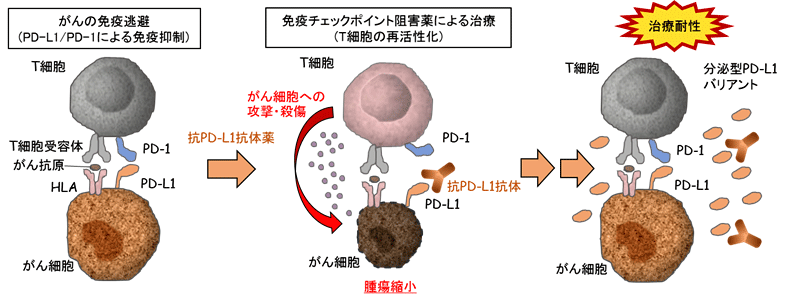
図1:分泌型PD-L1バリアントを介した免疫チェックポイント阻害薬耐性メカニズム
今回、がん研究会の片山量平(がん研究会 がん化学療法センター 基礎研究部 部長)、龔(キョウ)博(ハク)(東京大学大学院 新領域創成科学研究科 大学院博士課程)らを中心とする研究グループは、抗PD-L1抗体薬治療に対して獲得耐性となった17症例について網羅的な遺伝子解析を行ったところ、4症例(約20%)において、治療標的にあたるPD-L1タンパク質でRNAスプライシング*1の異常により分泌型バリアントが出現することを発見しました。また、分泌型PD-L1バリアントの機能を検証するため、京都大学の河本宏(京都大学 ウィルス・再生医科学研究所 再生免疫学分野 教授)らの研究グループとの共同研究により、ヒトT-iPS細胞(iPS細胞より再生した腫瘍を特異的に認識するキラーT細胞)を用いた実験系を利用し、分泌型PD-L1バリアントが抗PD-L1抗体薬の活性を競合的に中和し、T細胞の再活性化を抑制することを証明しました。さらに、実験動物を用いたin vivoモデルにて、分泌型PD-L1バリアントを発現する細胞が、がん全体のわずか1%の頻度で存在するだけで分泌型PD-L1が腫瘍組織内および生体内に蓄積され、抗PD-L1抗体薬の治療耐性を誘導することを示しました。また上記に加え、抗PD-1抗体薬が分泌型PD-L1バリアントによる治療耐性を克服できる可能性を示すことにも成功しました。
本研究の成果は、ロックフェラー大学出版がサポートする米国科学誌Journal of Experimental Medicine誌に、2019年3月14日に公開されます。
2.ポイント
- 抗PD-L1抗体薬治療に対していったん奏効したにもかかわらず耐性となった症例の組織検体を利用し、網羅的な遺伝子解析を行った結果、異常なRNAスプライシングにより分泌型PD-L1バリアントが産生されるようになることを発見しました。
- 分泌型PD-L1バリアントを持つがんの患者から採取された血漿中・胸水中には、健常者や、分泌型バリアントが認められなかったがん患者よりも高い濃度の可溶型PD-L1が検出されました。
- 分泌型PD-L1バリアントは競合的に抗PD-L1抗体薬の活性を減弱することを示しました。
- 分泌型PD-L1バリアントを発現する細胞が腫瘍中にわずか1%の頻度で存在するだけで、治療耐性を誘導する可能性を明らかにしました。
- 分泌型PD-L1バリアントによる抗PD-L1抗体への耐性は、抗PD-1抗体により克服できる可能性が示されました。
- 本研究から、臨床上よく使用されている免疫チェックポイント阻害治療薬の一つである抗PD-L1抗体薬の耐性機構として分泌型PD-L1バリアントの存在が示され、今後血液などの体液を用いた分泌型PD-L1のモニタリングが治療効果予測に有益な情報を与える可能性があります。また、分泌型PD-L1バリアントによる治療耐性は抗PD-1抗体薬により克服できる可能性が明らかとなり、分子メカニズムに合わせた免疫チェックポイント阻害薬の治療に貢献できることが期待されます。
3.論文名、著者およびその所属
- 論文名
- Secreted PD-L1 variants mediate resistance to PD-L1 blockade therapy in non-small cell lung cancer
- ジャーナル名
- Journal of Experimental Medicine(ロックフェラー大学出版がサポートする米国科学誌)
(※2019年3月14日 日本時間午後10時にオンラインに掲載されます。) - 著者
- Bo Gong1,2, Kazuma Kiyotani3, Seiji Sakata4, Seiji Nagano5,6, Shun Kumehara5,6, Satoko Baba4, Benjamin Besse7,8, Noriko Yanagitani9, Luc Friboulet7, Makoto Nishio9, Kengo Takeuchi4,10, Hiroshi Kawamoto5, Naoya Fujita1,2, Ryohei Katayama1*
* 責任著者 - 著者の所属機関
-
- (公財)がん研究会 がん化学療法センター 基礎研究部
- 東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻
- (公財)がん研究会 がんプレシジョン医療研究センター 免疫ゲノム医療開発プロジェクト
- (公財)がん研究会 がん研究所 分子標的病理プロジェクト
- 京都大学 ウイルス・再生医科学研究所 再生免疫学分野
- 京都大学大学院 医学研究科 血液・腫瘍内科学
- INSERM U981, Gustave Roussy Cancer Campus, Université Paris Saclay
- Department of Cancer Medicine, Gustave Roussy Cancer Campus
- (公財)がん研究会 がん研有明病院 呼吸器内科
- (公財)がん研究会 がん研究所 病理部
4.研究の詳細
背景と経緯
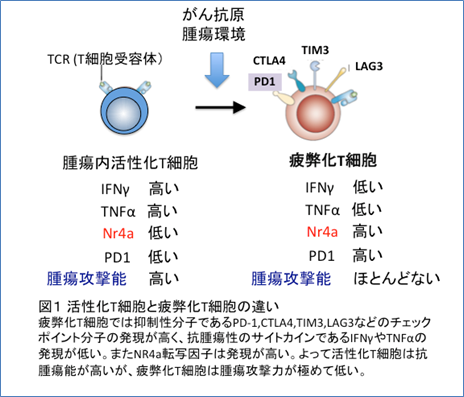
進行がんの治療において、がん免疫療法、特に免疫チェックポイント阻害薬による治療は、肺がん、悪性黒色腫、腎臓がんをはじめ、様々ながんにおいて重要な役割を果たすようになり、肺がんなどの一部の進行がんの治療においては、第1選択薬となってきています。現在臨床応用されているがん免疫チェックポイント阻害薬は、PD-1並びにPD-L1を標的とした抗体医薬です。PD-L1は様々な腫瘍において高発現しているだけでなく、マクロファージや樹状細胞などの抗原提示細胞や、心臓内の内皮細胞など、多種類の細胞に発現しています。一方その結合相手であるPD-1は主に細胞障害性T細胞などの免疫細胞に発現しています。腫瘍細胞等のPD-L1が細胞障害性T細胞上のPD-1に結合すると、T細胞の活性が抑制されます。このようなメカニズムにより、腫瘍は細胞障害性T細胞により異物として認識されても、T細胞を抑制することで免疫監視機構から逃れて増殖しています。このPD-1分子のように、免疫系を抑制する分子や、類似の機能を有する分子等を総称して免疫チェックポイント分子と呼び、免疫チェックポイント阻害機構を阻害する抗体医薬が、多数開発されています。これまでに臨床での使用が承認された免疫チェックポイント阻害薬である、抗PD-1抗体や抗PD-L1抗体は、数割程度の患者さんにおいて、長期にわたり腫瘍増殖を抑制する効果が認められても、やがて耐性を獲得し腫瘍が再増悪してしまう臨床例が報告され問題となっています。これまでに、抗PD-1抗体に対する耐性機構としては、細胞障害性T細胞が腫瘍細胞を異物として認識するために必須の抗原提示がされなくなるといったメカニズムなどが相次いで報告されていますが、抗PD-L1抗体に対する耐性機構はほとんど明らかになっていませんでした。
がん研究会の片山量平(がん研究会 がん化学療法センター 基礎研究部 部長)、龔キョウ博ハク(東京大学大学院 新領域創成科学研究科 大学院博士課程)らの研究グループは、抗PD-L1抗体療法に一度奏功したのちに耐性となり、腫瘍が再憎悪した症例を詳細に解析し、新たな耐性機構として、PD-L1のRNAスプライシング異常により膜貫通領域を欠損し、細胞外に分泌されるPD-L1バリアントが産生されていることを発見しました。この分泌型PD-L1バリアントは、抗PD-L1抗体をトラップし抗体の効力を打ち消すことで、抗PD-L1抗体耐性を引き起こすことを見出しました。さらに、この分泌されるPD-L1による耐性には、PD-1に対する抗体により克服できる可能性があることを、培養細胞、ヒトiPS由来T細胞、および動物実験により示すことに成功しました。
研究内容
我々はまず、がん研有明病院において十分なインフォームド・コンセントを受けた肺がん患者2症例(抗PD-L1抗体による治療を受け、一旦腫瘍の縮小がみられたのちに耐性となった症例)の抗PD-L1抗体耐性腫瘍を用いて、網羅的な遺伝子解析と遺伝子発現解析(RNAシーケンス)を行いました。その結果、一部のエクソン(遺伝子をコードする領域)が欠損したPD-L1スプライシングバリアントが耐性検体で発現していることを発見しました。耐性検体から見つかったPD-L1スプライシングバリアントはいずれも正常なPD-L1が有する細胞膜貫通領域が欠損していることが明らかとなりました。また、網羅的遺伝子変異解析からは、抗PD-L1抗体治療耐性2症例において共通した遺伝子変異として、TARDBP (TDP-43)*2の変異が認められました。TDP43はALS(筋萎縮性側索硬化症)の原因遺伝子の1つであり、見つかった変異は、ALSで変異が見つかる部位に相当していました。このTDP43を、PD-L1遺伝子をコードするゲノムDNAの一部(Exon4からExon7までの領域)と一緒に細胞に遺伝子導入すると、PD-L1の異常なスプライシング産物が見られることを発見いたしましたが、詳細なメカニズムは未だ明らかにできていません。
耐性症例で発見された膜貫通領域欠損型PD-L1バリアントとしては、v242(exon5の一部が欠失したバリアント)とv229 (exon 5, 6欠失型) の2種類が見つかりましたが、いずれも細胞外領域をほぼ完全に保有し膜貫通領域が欠損していました(図2)。また、フランスのGustave Roussy Cancer CampusのLuc Friboulet博士らとの共同研究により行われた網羅的RNA発現解析の結果から、抗PD-L1抗体耐性が確認された15例のがん患者のうち2名の耐性時の腫瘍検体から、同じPD-L1v242バリアントが発見されました。
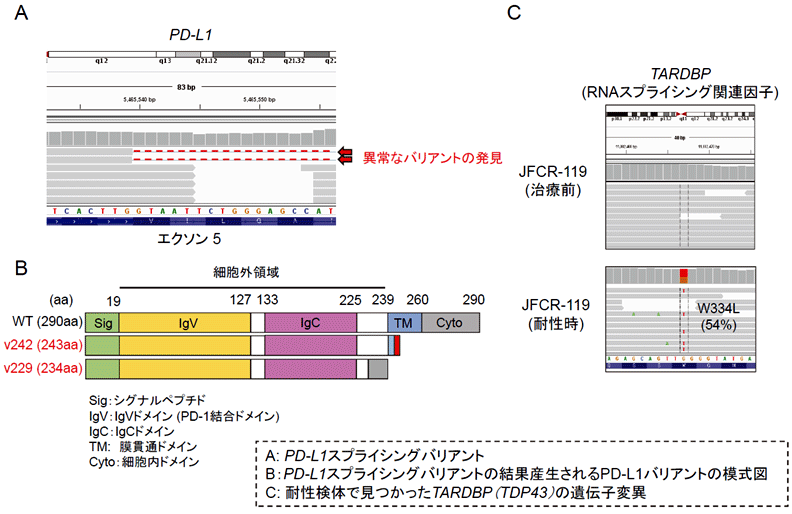
図2:抗PD-L1抗体耐性患者検体から発見されたPD-L1スプライスバリアント
これらPD-L1バリアントの発現様式を調べるために、肺がん細胞株であるPC9細胞に野生型PD-L1または、これらPD-L1バリアントを遺伝子導入したところ、野生型PD-L1は正常な膜貫通たんぱく質として細胞膜にみられたのに対し、v242, v229のPD-L1バリアントは、細胞から分泌されて培養上清中にほとんどが存在しました。なお、PD-L1v242バリアントは糖鎖修飾を受けており、半減期が長く安定であることも明らかとなりました(図3)。
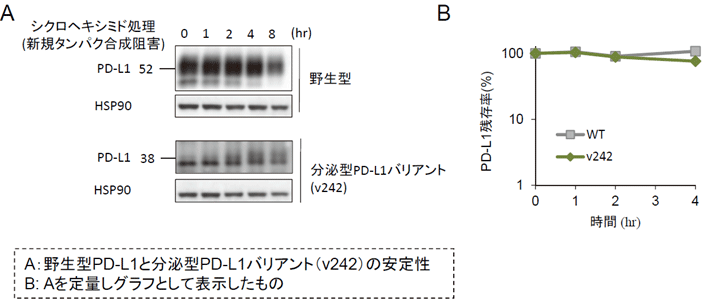
図3:分泌型PD-L1バリアントは比較的安定
次に、この分泌型PD-L1が抗PD-L1抗体や抗PD-1抗体に対してどの様に影響するかを調べたところ、抗PD-L1抗体が細胞膜上に発現するPD-L1に結合してPD-L1とPD-1の結合を阻害する機能を、分泌型PD-L1は濃度依存的に、競合阻害することを見出しました。一方、抗PD-1抗体がT細胞などに発現するPD-1に結合してT細胞の再活性化を促すことには、分泌型PD-L1は全く影響しませんでした。
このことを更に確認するために、京都大学 ウィルス・再生医科学研究所の河本宏らとの共同研究により、河本教授らが有するiPS細胞技術を利用したキラーT細胞 (T-iPS) の技術を応用して研究を行いました。具体的には、がん細胞を認識するT-iPS細胞をがん細胞と共培養する実験系で、がん細胞側にPD-L1を、T-iPS細胞側にPD-1を過剰発現させました。その結果、抗PD-L1抗体によるT-iPS細胞活性化は、分泌型PD-L1を添加することによりキャンセルされることが明らかとなりました(図4)。
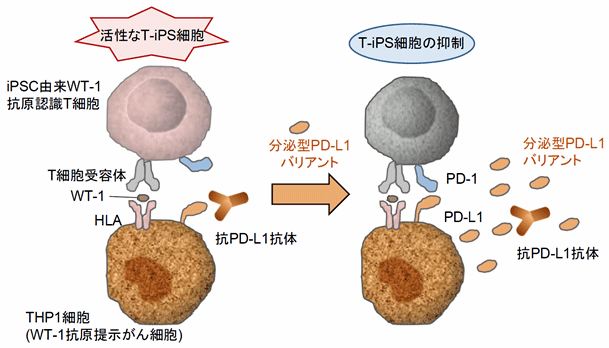
図4:iPS細胞由来キラーT細胞を用いた検討からも分泌型PD-L1は抗体のデコイとして働く
分泌型PD-L1による抗PD-L1抗体のトラップを介したT細胞の抑制が、生体内でも耐性に関わるのかどうかを明らかにするために、マウスの実験系を用いた検証を行いました。マウス大腸がん細胞株のMC38細胞は、その由来となったC57BL/6系統のマウスの皮下に移植すると、皮下腫瘍を形成します。この腫瘍を移植したマウスに、抗マウスPD-1抗体や抗マウスPD-L1抗体を投与することで、顕著な腫瘍縮小が認められるモデルです。そこでまず、MC38細胞に野生型PD-L1を過剰発現させ皮下に移植したところ、MC38の親株に比べやや増大の早い腫瘍が形成されました(おそらくT細胞を介した抗腫瘍免疫が働きにくいため)。しかし、抗PD-L1抗体で治療すると、MC38親株の時と同様に腫瘍縮小が認められました。一方、ヒトv242型PD-L1バリアントと相同のマウス分泌型PD-L1バリアント (mPD-L1v242) を発現させたMC38細胞では、抗PD-L1抗体に耐性になっていることが確認されたことから、確かに分泌型PD-L1バリアントにより抗PD-L1抗体耐性が誘導されることが明らかになりました(図5)。一方、これらの野生型および分泌型バリアントPD-L1を過剰発現したMC38の腫瘍を抗PD-1抗体で治療すると、いずれにおいても腫瘍縮小が認められたことから、分泌型PD-L1バリアントによる抗PD-L1抗体への耐性は、抗PD-1抗体でキャンセルできることが明らかになりました(図6)。
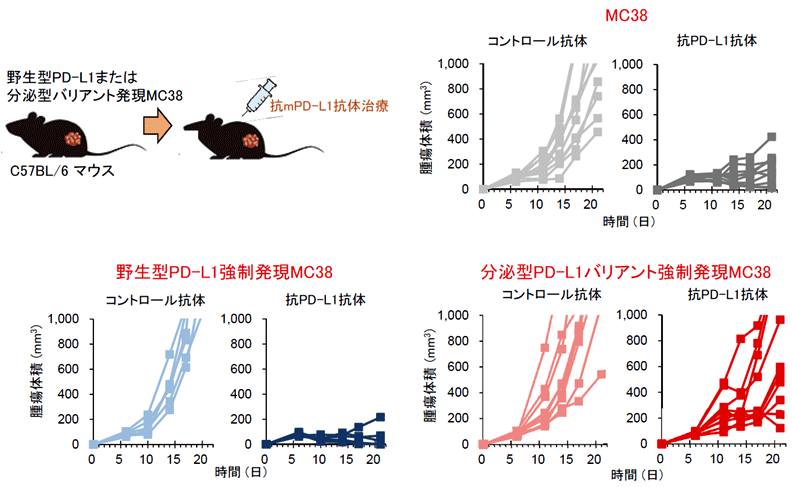
図5:分泌型PD-L1バリアントは動物実験モデルにおいて抗PD-L1抗体耐性を誘導する
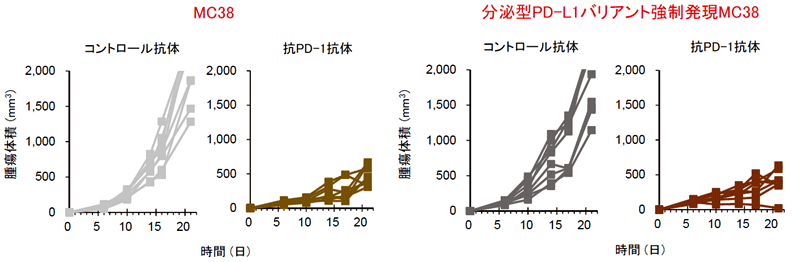
図6:分泌型PD-L1バリアントによるPD-L1抗体耐性は、抗PD-1抗体で克服される
また、この分泌型PD-L1バリアントを発現したMC38細胞と、野生型PD-L1を発現したMC38細胞を、比を変えてマウス皮下に移植し、抗PD-L1抗体で治療したところ、わずか1%の分泌型PD-L1バリアントを発現するMC38細胞が存在するだけで、腫瘍全体が治療抵抗性になることも明らかになりました。このことは、分泌されたPD-L1バリアントが腫瘍内に一定以上の濃度になると、バリアの様に、抗PD-L1抗体をトラップして耐性を誘導することを示唆しているものと考えられます。実際に、分泌型PD-L1バリアントを発現するMC38細胞と野生型PD-L1を発現するMC38細胞を1対99の比で混ぜて皮下移植したマウスからは、血中に分泌型されたと考えられるPD-L1の濃度が経時的に上昇していることが、確認されました。さらに、分泌型バリアントが発見された患者さんの血液中には、健常者や他のがん患者さん(分泌型バリアントがないことは確認済み)と比較して、高い濃度のPD-L1が検出されました。また、分泌型バリアントが認められた患者さんの胸水中にはさらに高い濃度のPD-L1が検出されました(図7)。これらのことから、分泌型PD-L1バリアントがスプライシング異常により産生されるようになると、分泌された安定なPD-L1バリアントが蓄積し、抗PD-L1抗体の治療効果を弱めることで耐性を獲得するということと、その耐性には抗PD-1抗体が有効である可能性が、実験的に示されました。
今後更なる詳細なメカニズムの解明と、実際の抗PD-L1抗体耐性患者さんにおいてどの程度の頻度で見られ、抗PD-1抗体が有効なのか、ということを含めた検証が必要です。
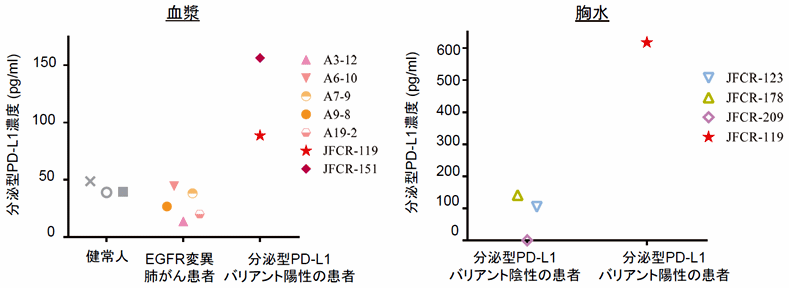
図7:分泌型PD-L1バリアントの見つかった患者の血液および体腔液からは高濃度のPD-L1が検出された
本研究への支援
本研究は、下記機関より資金的支援等を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)
「異分野先端技術融合による薬剤抵抗性を標的とした革新的複合治療戦略の開発」 - 独立行政法人日本学術振興会 科学研究費補助金
- 文部科学省科学研究費助成事業
新学術領域研究「細胞社会ダイバーシティーの統合的解明と制御」 - 公益財団法人車両競技公益資金記念財団
用語解説
- *1:RNAスプライシング
- ヒトをはじめとする真核生物では、ゲノムDNAのエクソンと呼ばれる領域に遺伝情報がコードされ、イントロンと呼ばれている領域に挟まれています。DNAから遺伝情報を読み取り、メッセンジャーRNA (mRNA)を経てたんぱく質が作られるまでに、まずDNAの配列を読み取る「転写」によりmRNA前駆体が合成されます。このmRNA前駆体には、遺伝子をコードするエクソンとその間にあるイントロンの両方が含まれており、mRNAに成熟する過程でイントロンを除去してたんぱく質をコードするエクソンだけから構成されるmRNAが作り出されます。このステップをRNAスプライシングと呼び、一部の疾患やがんなどではRNAスプライシングの異常が見られ、発症に関与することが知られています。
- *2:TARDBP (TDP-43) 遺伝子
- TARDBP遺伝子はヒト・エイズウイルス(HIV-1)遺伝子の末端反復配列(long terminal repeat:LTR)内のTAR(trans activation responsive region)に結合し、その発現を抑制する因子として最初に同定され、この名が付けられました。ALS(筋萎縮性側索硬化症)患者では遺伝子変異が見つかっており、ALS発症の原因遺伝子の1つとして知られています。その機能としては複数の遺伝子のRNAスプライシングの調節に関わるとされているものの、まだ詳細は十分には明らかになっていません。
お問い合わせ先
本研究に関すること
公益財団法人がん研究会 がん化学療法センター 基礎研究部
片山量平
取材等に関すること
公益財団法人がん研究会 広報部
がん対策全般についてのお問い合わせ
厚生労働省健康局 がん・疾病対策課
次世代がん医療創生研究事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)戦略推進部 がん研究課