2023-09-15 理化学研究所,京都大学
理化学研究所(理研)生命医科学研究センター プロテオーム恒常性研究ユニットの今見 考志 ユニットリーダー、京都大学大学院 薬学研究科創発医薬科学講座の李 優嘉 大学院生(研究当時)、金尾 英佑 助教、石濱 泰 教授らの共同研究グループは、細胞外小胞(EV)[1]が標的細胞に取り込まれる過程において、EVと近接するタンパク質を包括的に同定する技術の開発に成功しました。
本研究成果は、EVの標的細胞への取り込み機構の分子レベルでの理解やその応用(ドラッグデリバリー[2]など)に貢献すると期待できます。
EVは細胞から放出される、タンパク質や核酸などの生体分子を内包する膜小胞です。EVを介してその内包物が細胞間で移行し、細胞間情報伝達の役割を担う可能性が示されています。しかし、細胞外のEVがどのようにして標的細胞内に取り込まれるのかについては不明な点が多く残されています。
今回、共同研究グループは、数十ナノメートル(nm、1nmは10億分の1メートル)に近接するタンパク質にビオチン化標識[3]を施す酵素(TurboID)を搭載した、特殊なEV(改良型EV)をヒト培養細胞に産出させることに成功しました。これによって、EVが標的細胞に取り込まれる際に、近接するタンパク質をビオチン化標識できます。さらに、独自のプロテオミクス[4]解析技術を組み合わせることで、EV取り込みに関与する標識タンパク質を包括的に同定することに成功しました。本技術により、EV取り込み過程に関わる新しいタンパク質の存在が明らかになりました。
本研究は、科学雑誌『Analytical Chemistry』オンライン版(9月14日付:日本時間9月15日)に掲載されました。
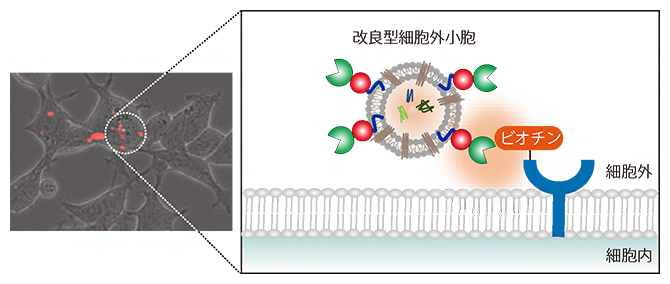
改良型細胞外小胞が細胞に取り込まれる軌跡が化学標識(ビオチン)によって照らされる概念図
背景
細胞外小胞(EV)は、タンパク質や核酸などの生体分子を内包する直径50~1,000ナノメートル(nm、1nmは10億分の1メートル)の膜小胞です。バクテリアからヒトまで全ての生物の細胞から、EVが放出されるといわれています。1960年代に初めてEVが報告され、当初は不要な細胞内タンパク質を排出する機構を担うものの一つとして考えられていました。
近年では、EVを介してその内包物が細胞間で移行し、細胞間情報伝達の役割を担う可能性が示されています。特に、後期エンドソーム[5]由来の直径50~200nmの小型EV(エクソソームとも呼ばれる)が細胞間情報伝達の主役として注目を浴びています。さらに、EVはがん細胞の転移や浸潤などの疾病への関与、またリキッドバイオプシー[6]やドラッグデリバリーなどの臨床面への応用でも注目されています。
一方、EV内包タンパク質や核酸の包括的な解析や、バイオマーカーとしての評価は進んでいるものの、細胞外のEVがどのようにして標的細胞内に取り込まれるのかといった基本的な疑問については不明な点が多く残されています。特に、同じ細胞由来のEVであっても、標的細胞種によって取り込み量が異なり、EV-標的細胞間には何らかの選択性があることが示唆されています。
これまでの報告から、標的細胞膜に発現しているタンパク質(例えばインテグリン[7])が取り込み選択性を規定している因子の一つであるといわれています。一方、顕微鏡を用いた従来の研究手法では、特定のタンパク質に着目してEVの相互作用を観察することはできるものの、EVの取り込みに関わる多くのタンパク質の種類を網羅的に把握することはできません。
そこで、共同研究グループは、改良型EVと新しいプロテオミクス解析技術を組み合わせ、EVの取り込み過程に関与するタンパク質を包括的に同定し、EVの取り込み機構の全体像を捉えることに挑みました。
研究手法と成果
共同研究グループは、数十nmに近接するタンパク質をビオチン化標識する、近位依存性ビオチン化酵素[8]TurboIDをEV膜上に搭載した改良型EV(TurboID-EV)をヒト培養細胞に産出させました(図1左)。MFG-E8[9]というタンパク質は、EV膜を構成している脂質の一つであるホスファチジルセリンに結合することが知られています。そこで、MFG-E8とTurboID、さらにEVの動態を生細胞でモニターするための赤色蛍光タンパク質から成る融合タンパク質をヒト培養細胞に発現させ、TurboIDがEV膜上に結合したTurboID-EVを作製しました。TurboID-EVは、EVに近接するタンパク質をビオチン化標識でき、EVの軌跡を照らすことを可能にします。また、ヒト細胞培養液中の改良型EVの濃度は1mL当たり17億個、サイズは平均150nmであり、通常のEVと変わりませんでした(図1右)。
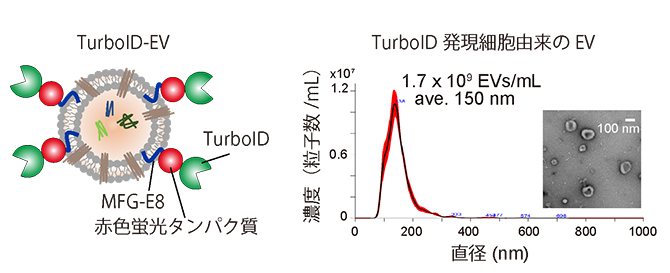
図1 TurboID-EVとその特性
(左)TurboID-EVの概念図(図左)。EV膜上に、近位依存性ビオチン化酵素TurboIDと赤色蛍光タンパク質、MFG-E8タンパク質を結合させた。
(右)TurboID発現細胞由来のEV(改良型EV)の濃度とサイズを示したグラフ(左)と改良型EVの電子顕微鏡写真(右)。
ヒト細胞培養液から回収したTurboID-EVを標的細胞とともにインキュベーション(定温放置)すると、標的細胞内に取り込まれます。取り込まれたEVは、標的細胞膜で膜融合しEVの内包物がすぐに放出されるのではなく、細胞内でしばらく滞在した後で分解されると考えられています。本実験では、標的細胞由来のタンパク質だけでなく、ドナーであるTurboID-EV内に存在するタンパク質もビオチン化されるためどれが真の標的細胞由来のタンパク質なのか区別できないという問題がありました。さらに、TurboID-EVを取り込んだ標的細胞はわずかであり、極微量のビオチン化標識タンパク質しか存在しませんでした。
そこで、これらの問題を解決する高感度プロテオミクス解析技術を確立しました(図2)。まず、安定同位体アミノ酸[10]で標的細胞を標識することで、未標識のドナーEV由来のタンパク質と区別することに成功しました。また、EVを取り込んだ赤色蛍光タンパク質陽性の標的細胞をフローサイトメトリー[11]で分取・濃縮し、さらにスピンチップ型デバイス[12]を用いて微量のビオチン化標識タンパク質を濃縮することに成功しました。
その後、質量分析[13]を用いたプロテオーム解析によって、400種以上のビオチン化標識タンパク質(EVに近接する標的細胞由来のタンパク質)を同定しました(図3左)。また、EVを取り込んだ標的細胞で見つかったビオチン化標識タンパク質の中には、EVの取り込みに関与する既知のタンパク質が多く含まれていたことから、本手法の妥当性が示されました(図3右)。
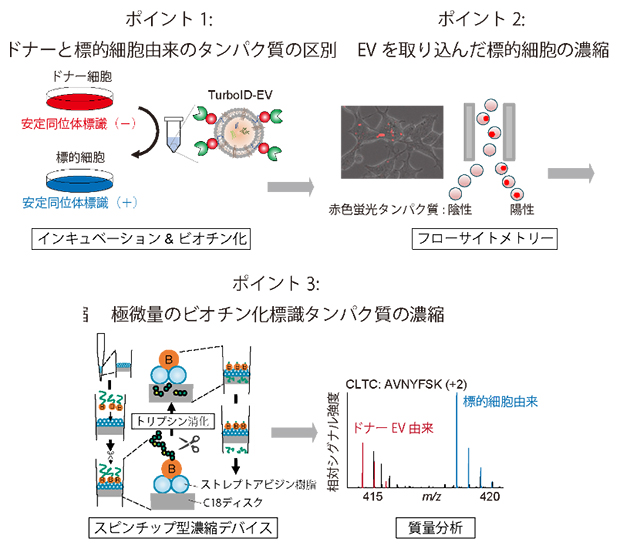
図2 高感度プロテオーム解析技術
安定同位体標識、フローサイトメトリー、スピンチップ型濃縮デバイス、質量分析を組み合わせることで微量のビオチン化標識タンパク質の同定に成功した。
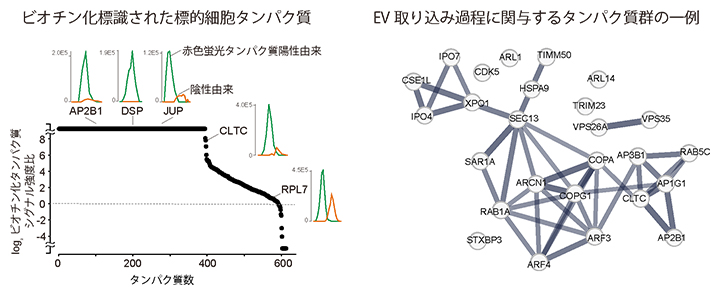
図3 本手法で同定したEVと近接する標的細胞由来のタンパク質
(左)EVを取り込んだ標的細胞(赤色蛍光タンパク質陽性)とEVを取り込んでいない細胞(陰性)間のビオチン化標識タンパク質のシグナル強度を質量分析計で比較することで、EVに近接するタンパク質を400種以上同定できた。
(右)EVを取り込んだ標的細胞で見つかったビオチン化標識タンパク質の中には、EVの取り込みに関与する既知のタンパク質が多く含まれていた。
同定したビオチン化標識タンパク質には、例えば、細胞表面の受容体タンパク質に細胞外分子が結合することで、細胞外分子が細胞内に取り込まれる受容体媒介エンドサイトーシス[14]や、細胞骨格タンパク質であるアクチンの重合により、細胞外分子が細胞内に取り込まれるマクロピノサイトーシス[14]に関与するタンパク質が濃縮されていました(図4)。
さらに重要なポイントとして、プロテオーム解析による包括的なタンパク質プロファイリングを行うことで、これまでEVの取り込み過程に関与することが知られていなかったタンパク質も明らかになりました。例えば、細胞膜やその内側に存在するタンパク質(FCRL3、DSP、JUP、ATP1A1など)はEVの取り込み過程に関与することが示唆されます。
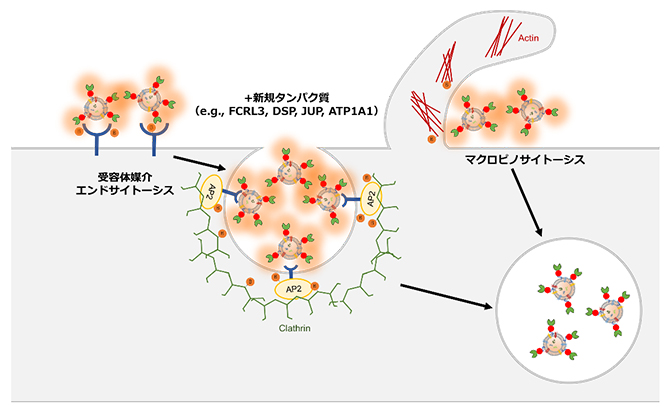
図4 本手法で明らかにされたEV取り込み過程に関わる機構
本手法により、TurboID-EVは受容体媒介エンドサイトーシス(細胞表面の受容体タンパク質に細胞外分子が結合することで、細胞膜が陥没し、細胞外分子を積んだ膜小胞が形成され、細胞内に取り込まれる)やマクロピノサイトーシス(細胞骨格タンパク質であるアクチンの重合により,細胞外に向けて波のように細胞膜が突出後、細胞膜と融合することにより、膜小胞が形成され、細胞外分子が細胞内に取り込まれる)によって、細胞内に取り込まれることが分かった。さらに、EVの取り込み過程にこれまで関与することが知られていなかったタンパク質(FCRL3、DSP、JUP、ATP1A1など)も明らかになった。
今後の期待
本研究では、改良型EV(TurboID-EV)と高感度プロテオーム解析技術を組み合わせることで、EVの標的細胞への取り込み中および取り込み後に関わるタンパク質群を包括的に捉える技術を実現しました。今後、新しく同定されたタンパク質をさらに検証することで、詳細なEV取り込み機構の理解につながると期待できます。
今回はヒト培養細胞をモデルとしてTurboID-EVの有用性を示しましたが、本手法はさまざまなドナーEV種や標的細胞種に応用可能であり、EV取り込み量の細胞特異性に関する知見が得られると期待できます。また、本手法をマウスなどのin vivo(生体内)モデルに適用し、がん細胞由来のEVの臓器特異的な取り込み過程を調べることで、がんの発症機構の理解にも貢献すると期待できます。
補足説明
1.細胞外小胞(EV)
細胞から放出され、脂質二重層で囲まれ、複製できない粒子の総称。本研究では、後期エンドソームから放出される小型の細胞外小胞(エクソソームとも呼ばれる)のことを指す。近年、細胞外小胞の内包タンパク質や核酸が細胞間で移行することで、細胞から細胞への情報伝達を担う可能性が示されており、注目を集めている。EVはExtracellular Vesicleの略。
2.ドラッグデリバリー
薬剤を生体内の特定の場所に必要量送達するシステムのこと。従来、人工脂質膜から成るリポソームに薬剤を内包したものが用いられている。EVを利用したドラッグデリバリーも近年研究されている。
3.ビオチン化標識
水溶性ビタミンの一種であるビオチンでタンパク質を化学標識すること。ビオチンは、ストレプトアビジンと呼ばれるタンパク質と強固に結合することから、ストレプトアビジンでコートしたビーズなどを用いることで、ビオチン化標識タンパク質を混合物中から濃縮できるという特徴がある。
4.プロテオミクス
個別のタンパク質ではなく、細胞に存在する全タンパク質を対象とした研究のこと。本研究では、タンパク質消化後のペプチドをナノ液体クロマトグラフィーで分離しながら、質量分析するショットガンプロテオミクス法を用いている。
5.エンドソーム
エンドサイトーシスにより細胞外分子を細胞膜から取り込んだ際に形成される膜小胞のこと。エンドソームは内腔の環境を変化させながら最終的に後期エンドソームに成熟し、リソソームと融合し、内容物を分解する。後期エンドソーム由来のEVはエクソソームとも呼ばれ、細胞間情報伝達などを担う可能性があり、近年注目を浴びている。
6.リキッドバイオプシー
血液や唾液、尿など体液を用いた検査・診断のこと。従来の組織生検よりも低侵襲のため、体への負担が少ない。
7.インテグリン
細胞表面に存在する膜タンパク質で、細胞同士の強固な接着に関与したり、細胞外からの情報を伝達したりする。
8.近位依存性ビオチン化酵素
基質としてビオチンとATP(アデノシン三リン酸)を利用し、10nm程度の近接に存在する生体分子(タンパク質など)にビオチン化標識する酵素のこと。本研究で用いたTurboIDのほかにさまざまなビオチン化酵素(BioID、AirIDなど)が開発されている。
9.MFG-E8
細胞外に分泌されるタンパク質の一つ。このタンパク質内のC1C2ドメインと呼ばれる領域が、EV膜に存在するホスファチジルセリンと結合する。
10.安定同位体アミノ酸
アミノ酸内の炭素原子(12C)の代わりに、質量数が異なる13Cなどで置換されているアミノ酸のこと。通常のアミノ酸と安定同位体アミノ酸も物理化学的性質は同じとされているが、質量が異なるため質量分析で両者を区別できる。プロテオーム解析における相対定量法として利用されている。
11.フローサイトメトリー
1個1個の細胞にレーザー光を照射し、その散乱光や蛍光を測定することで、細胞の情報を取得したり、特定の細胞を分取する技術。本研究では、赤色蛍光タンパク質を持つEVを取り込んだ細胞を分離・分取するために用いた。
12.スピンチップ型デバイス
特定のタンパク質を濃縮する機能などを付与したピペットチップ。タンパク質混合溶液をそのピペットチップに導入し、遠心分離するだけで、特定のタンパク質を簡便に濃縮できる。本研究ではビオチン化標識タンパク質を濃縮するために、ビオチンに強固に結合するストレプトアビジン(タンパク質の一種)でコートしたビーズをピペットチップ先端に配置している。
13.質量分析
分子や原子を各種のイオン化法でイオン化し、そのイオンの質量を計測する分析法。ここでは、タンパク質を酵素消化することで生じるペプチドをイオン化し、それらの質量などの情報を取得することで、サンプル内にどんなタンパク質がどれぐらい存在しているかが分かる。
14.受容体媒介エンドサイトーシス、マクロピノサイトーシス
どちらも細胞外分子を細胞内に取り込むプロセス。日本語では飲食作用ともいう。受容体媒介エンドサイトーシスは、細胞表面の受容体タンパク質に細胞外分子が結合することで、細胞膜が陥没し、細胞外分子を積んだ膜小胞が形成され、細胞内に取り込まれる。マクロピノサイトーシスは、細胞骨格タンパク質であるアクチンの重合により,細胞外に向けて波のように細胞膜が突出後、細胞膜と融合することにより、膜小胞が形成され、細胞外分子が細胞内に取り込まれる。
共同研究グループ
理化学研究所 生命医学研究センター
プロテオーム恒常性研究ユニット
ユニットリーダー 今見 考志(イマミ・コウシ)
京都大学大学院 薬学研究科 創発医薬科学講座
大学院生(研究当時)李 優嘉(リ・ユカ)
助教 金尾 英佑(カナオ・エイスケ)
教授 石濱 泰(イシハマ・ヤスシ)
金沢大学 医薬保健研究域 医学系免疫学
准教授 山野 友義(ヤマノ・トモヨシ)
研究支援
本研究はJST戦略的創造研究推進事業個人型研究(さきがけ)「生体における微粒子の機能と制御(研究総括:中野明彦)」の研究課題「エクソソームの動態と細胞応答を捉える Exo プロテオミクステクノロジーの開発(研究者:今見考志、JPMJPR18H2)」の助成を受けて行われました。
原論文情報
Yuka Li, Eisuke Kanao, Tomoyoshi Yamano, Yasushi Ishihama, Koshi Imami, “TurboID-EV: proteomic mapping of recipient cellular proteins proximal to small extracellular vesicles”, Analytical Chemistry, 10.1021/acs.analchem.3c01015
発表者
理化学研究所
生命医学研究センター プロテオーム恒常性研究ユニット
ユニットリーダー 今見 考志(イマミ・コウシ)
京都大学大学院 薬学研究科 創発医薬科学講座
大学院生(研究当時)李 優嘉(リ・ユカ)
助教 金尾 英佑(カナオ・エイスケ)
教授 石濱 泰(イシハマ・ヤスシ)
報道担当
理化学研究所 広報室 報道担当
京都大学 渉外部広報課国際広報室