2023-09-27 東京工業大学
要点
- 試験管内で生命に必須な鉄硫黄タンパク質を迅速かつ簡便に合成する手法を確立。
- 無細胞翻訳系、酸素除去系、鉄硫黄クラスター生合成系を組み合わせることで、グローブボックスなどを用いることなく、試験管内で人工的な嫌気環境を構築。
- さまざまな生体内の化学反応に関わる、鉄硫黄タンパク質や酵素の簡便な合成は、新たなバイオテクノロジーおよび酵素開発などへの応用が期待される。
概要
東京工業大学 国際先駆研究機構 地球生命研究所(ELSI)の藤島皓介准教授、Shawn McGlynn(ショウン・マックグリン)准教授および同 生命理工学院 生命理工学系の西川将太大学院生(博士後期課程3年)、台湾中央大学の王柏翔助教の国際共同研究チームは、活性のある鉄硫黄タンパク質[用語1]を好気的なベンチトップで迅速かつ簡便に合成することに成功した。
鉄硫黄クラスター[用語2]は全ての生物が有する普遍的な補因子で、光合成、電子伝達、炭素固定や窒素固定など重要な機能を支えている一方、酸素に対して非常に脆弱である。従来、鉄硫黄クラスターを含む鉄硫黄タンパク質は微生物内で合成したのちに、酸素を排除した嫌気環境で再構成する必要があり、グローブボックス[用語3]などの特殊な設備が必要だった。
そこで研究チームは、タンパク質合成が可能な無細胞翻訳系[用語4](PUREシステム)に酸素を除去するための3種類の酵素反応系と、鉄硫黄クラスター生合成系[用語5](SUF)に対応する6種類の計9種類のタンパク質を加えることで、試験管内で初めて[4Fe-4S]型の鉄硫黄クラスターを持つアコニターゼ酵素の合成に成功した。
本研究により、試験管内で合成可能な酵素の種類に鉄硫黄タンパク質が加わったことで、酸化還元反応を伴う代謝系の再構築や、それらを組み込んだ人工細胞の作成など、幅広いバイオテクノロジー分野への応用が期待される。
本研究成果は、7月19日付の「ACS Synthetic Biology」のSynthetic Cell特集号に掲載された。

試験管内での[4Fe-4S]型の鉄硫黄クラスターを持つ活性型タンパク質の再構成の模式図
背景
鉄硫黄(Fe-S)クラスターは、電子伝達、酸化還元反応そしてさまざまな触媒反応に関与する鉄硫黄タンパク質において必須な補因子である。また、鉄硫黄クラスターの一部は鉄と硫黄から構成される硫化鉱物と類似する構造を持つことから、最も古い金属補因子の1つであると考えられている。しかし鉄硫黄クラスターは鉄を含むため、酸素と結びついて分解されやすい欠点も持つ。そのため従来の成熟鉄硫黄タンパク質の合成は、嫌気的に培養した大腸菌内で目的のタンパク質を合成し、グローブボックスなどの大型装置を用いて無酸素環境下で高濃度の鉄イオンと硫黄源を加えるなどして成熟させる手法が一般的だった。そこで本研究では、簡便かつ短時間に試験管内で成熟した鉄硫黄タンパク質の合成を達成できる新しい手法を探索した。
結果として、3つの系(無細胞翻訳系、鉄硫黄クラスター生合成系、酸素除去系)をワンポットで組み合わせることにより、実験室のベンチトップで任意の鉄硫黄タンパク質を合成することが可能となった。
研究成果
鉄硫黄クラスター生合成系(SUF系)の開発
生物が利用する鉄硫黄クラスター生合成系は、主にニトロゲナーゼの生合成に関与するNIFマシナリー、一部のバクテリアやミトコンドリアで利用されているISCマシナリー、そしてバクテリア、古細菌、高等植物の色素体など広範に保存されているSUFマシナリーの3種類が知られている。そこで本研究グループではSUF系を構成する6つのタンパク質(SufABCDSE)をそれぞれ大腸菌で合成・精製し、グローブボックス内の嫌気環境で鉄イオンや硫黄源であるシステインと混合した。その結果、時間経過とともに鉄硫黄クラスターである[4Fe-4S]クラスターが合成されることが確認できた(図1)。
![図1 SUF鉄硫黄クラスター生合成系の試験管内再構成 (A)試験管内で再構成した鉄硫黄クラスター生合成系の1つであるSUFマシナリー。SufS/SufE複合体がシステインから硫黄原子を提供し、SufBC2D複合体上で硫黄原子と鉄原子が集積し、FADH2[用語6]の還元力を利用しながら[4Fe-4S]クラスターを形成する。(B)時間経過とともに鉄硫黄クラスターが合成されていることを波長430 nmの吸光度で確認。](https://www.titech.ac.jp/news/img/news-33320-p1.jpg)
図1. SUF鉄硫黄クラスター生合成系の試験管内再構成
(A)試験管内で再構成した鉄硫黄クラスター生合成系の1つであるSUFマシナリー。SufS/SufE複合体がシステインから硫黄原子を提供し、SufBC2D複合体上で硫黄原子と鉄原子が集積し、FADH2[用語6]の還元力を利用しながら[4Fe-4S]クラスターを形成する。(B)時間経過とともに鉄硫黄クラスターが合成されていることを波長430 nmの吸光度で確認。
酸素除去系の考案と実装
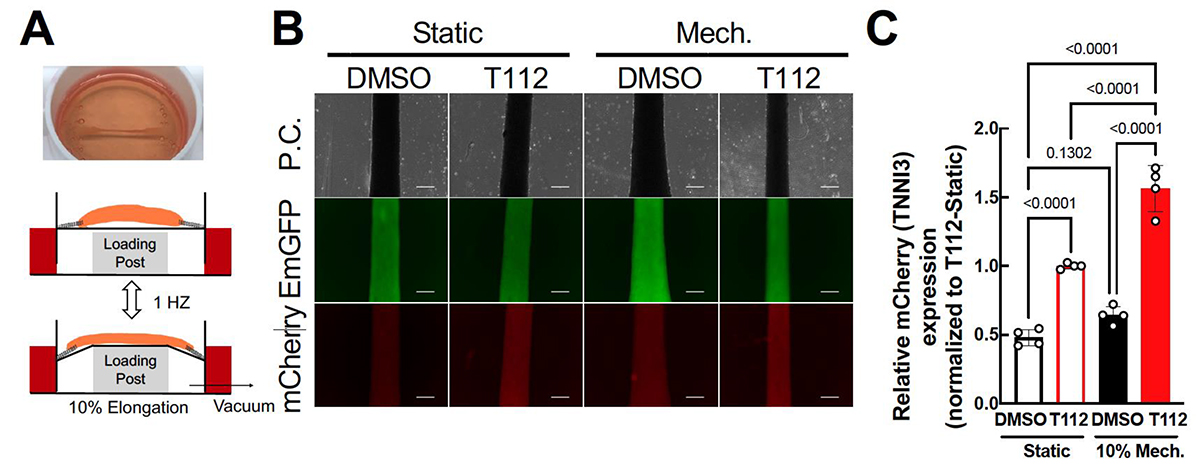
次にこのSUF系をグローブボックス外で利用するために、ギ酸デヒドロゲナーゼ、FAD還元酵素、カタラーゼの3種類の酵素のカスケード反応による人工的な酸素除去系を考案した。ギ酸由来の電子を利用して最終的に酸素をFADH2で還元することで、試験管内の酸素を取り除くことに成功した(図3)。実際に酸素除去系の存在下で鉄硫黄クラスターが安定に維持されること、そして無細胞翻訳系に影響を与えないことが確認された。また同時にこの酸素除去系は生命が利用する補酵素[用語7]群(NADH[用語8]やFADH2)の再生系としても利用可能である。
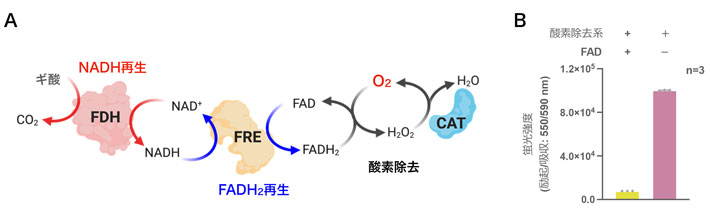
図2. 酸素除去と補酵素合成を同時に行う3酵素カスケード反応
(A)ギ酸を還元力にNADHを再生するギ酸デヒドロゲナーゼ(FDH)、NADHの還元力を利用してFADH2を再生するFAD還元酵素(FRE)、そしてFADH2と酸素が自発的に反応することによって生じる過酸化水素を水と酸素に変換するカタラーゼ(CAT)による連続反応によって、酸素除去と補酵素合成を同時に実現している。(B)酸素除去系(3酵素カスケード反応)とFADの存在下で酸素が効率的に取り除かれていることを示した図。溶液中の酸素の残存量評価はレゾルフィンと呼ばれる蛍光色素を用いて行った。レゾルフィンは還元的な環境では半透明非蛍光のジヒドロレゾルフィンとなる。
アコニターゼの試験管内ワンポット合成
図3に示すように、試験管内で無細胞翻訳系PUREfrexに(2)で開発した酸素除去系の酵素群およびクエン酸回路の鍵酵素の1つであるアコニターゼのメッセンジャーRNAを添加することで、まず人工的な嫌気環境下でアポ酵素[用語9]を合成した。その後(1)で合成したSUF系のタンパク質群および鉄イオンを添加することで最終的に活性を示すアコニターゼのワンポット合成を達成した(図4)。試験管内で合成したアコニターゼは大腸菌由来のアコニターゼとほぼ同等の活性を示すことが分かった。また酵素除去系がない場合でも約30%の非活性を示したことから、試験管内SUF系は酸素存在下でも鉄硫黄クラスターの再構成を一部達成できることを示す結果となった。
![図3 試験管内での鉄硫黄タンパク質アコニターゼのワンポット合成 0.2 mLの無細胞翻訳系の反応溶液が入った試験管(チューブ)の中でアポ酵素をmRNAから合成すると同時に、3種類の酵素反応で酸素を除去しながらSUF系に必要な補酵素FADH2を合成する[ステップ1]。そこに6種類のSUFタンパク質(SufABCDSE)と鉄イオンを添加することで鉄硫黄クラスター生合成系を動かし、アポ酵素に[4Fe-4S]クラスターを受け渡すことでホロ酵素[用語10]を最終的に作る[ステップ1]。本研究ではクエン酸回路に必須な鉄硫黄クラスターを有する酵素であるアコニターゼを合成する実験を行った。(Credit: Wang and Nishikawa et al. 2023 ACS Synthetic Biologyから改変)](https://www.titech.ac.jp/news/img/news-33320-p3.jpg)
図3. 試験管内での鉄硫黄タンパク質アコニターゼのワンポット合成
0.2 mLの無細胞翻訳系の反応溶液が入った試験管(チューブ)の中でアポ酵素をmRNAから合成すると同時に、3種類の酵素反応で酸素を除去しながらSUF系に必要な補酵素FADH2を合成する[ステップ1]。そこに6種類のSUFタンパク質(SufABCDSE)と鉄イオンを添加することで鉄硫黄クラスター生合成系を動かし、アポ酵素に[4Fe-4S]クラスターを受け渡すことでホロ酵素[用語10]を最終的に作る[ステップ1]。本研究ではクエン酸回路に必須な鉄硫黄クラスターを有する酵素であるアコニターゼを合成する実験を行った。(Credit: Wang and Nishikawa et al. 2023 ACS Synthetic Biologyから改変)
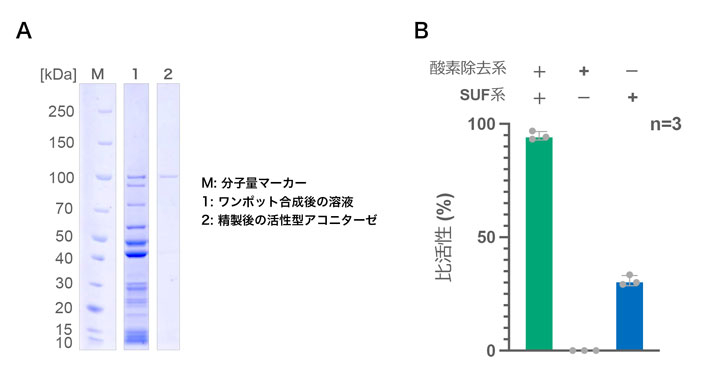
図4. 試験管内でワンポット合成したアコニターゼ酵素及びその活性確認
(A)無細胞翻訳系PUREfrexに酸素除去系、鉄硫黄クラスター生合成系(SUF系)と鉄イオンを加えてワンポット合成した活性型アコニターゼ酵素の泳動結果。(B)化学的に鉄硫黄クラスターを再構成した大腸菌由来アコニターゼとの活性比較。試験管内でワンポット合成した活性型アコニターゼの非活性は約95%の非活性を示した(n=3)。またSUF系のみで合成したアコニターゼも約30%の非活性を示した。
社会的インパクト
本研究で得られた知見は、一般の人々には直接関わりが薄いかもしれないが、試験管の中で簡便に扱える酵素の種類を増やすような合成生物学ツールの拡張は、バイオテクノロジーの発展に伴い、やがて社会全体にとって重要な意味を持つと考える。今回本研究グループが示した生物学的に必須な鉄硫黄タンパク質を簡便かつ効率的な方法で合成する手法は、生命科学のみならず宇宙生物学や環境科学、人工細胞の研究など様々な分野への波及効果が期待される。例えば、新しい酸化還元酵素の性状解析や進化工学は生体触媒や新規代謝経路の開発につながる可能性がある。
今後の展開
本研究は、試験管内で人工的に嫌気的環境を構築することで、酸素に感受性の高い酵素の合成を簡便に行う道筋を示した。例えば窒素固定や炭素固定などの主要な代謝経路に関与する酸化還元酵素の多くが有機-金属補酵素を有していることから、将来的に多様な金属酵素を試験管内で合成・進化できるようになると考える。同時にNADHなどの汎用性の高い補酵素の再生も担えることから、酸化還元反応で駆動する人工細胞の創成や、新たな人工触媒酵素の開発などへの応用も期待できる。
付記
本研究は、台湾の国家科学及技術委員会(111-2628-E-008-009)および自然科学研究機構アストロバイオロジーセンタープロジェクト研究(AB301003 / AB311001)の助成を受けて行われた。
用語説明
[用語1] 鉄硫黄タンパク質 : 鉄硫黄クラスターを含むタンパク質。
[用語2] 鉄硫黄クラスター : 鉄と硫黄から構成される金属補酵素で主に[2Fe-2S]、[3Fe-4S]、 [4Fe-4S]の3つの種類が知られている。
[用語3] グローブボックス : 外部環境から遮断された状況で作業を行うためにグローブで内部に手を入れられるようにした密閉容器。嫌気チャンバーとも呼ばれる。
[用語4] 無細胞翻訳系 : 試験管内でタンパク質合成(翻訳系)に関連した構成因子(リボソーム、RNA、酵素、エネルギー分子など)を使って再構成した人工的な系を指す。
[用語5] 鉄硫黄クラスター生合成系 : 細胞内で鉄硫黄クラスターの生合成を行う多タンパク質からなるマシナリー。自然界ではNIF、ISC、SUFの3つのマシナリーが知られている。
[用語6] FADH2 : フラビンアデニンジヌクレオチド。生体内で普遍的に利用される補酵素の一種で、酸化型のFADと還元型のFADH2の2つの状態をとる。
[用語7] 補酵素 : 酵素反応の化学基の授受に関与し、触媒反応を手助けする低分子化合物。
[用語8] NADH : ニコチンアミドアデニンジヌクレオチド。生体内で普遍的に利用される補酵素の一種で、酸化型のNAD+と還元型のNADHの2つの状態をとる。
[用語9] アポ酵素 : 補酵素を含まないタンパク質のみの酵素をアポ酵素、補酵素を含み活性を有する状態の酵素をホロ酵素と呼ぶ。
[用語10] ホロ酵素 : 補酵素を含まないタンパク質のみの酵素をアポ酵素、補酵素を含み活性を有する状態の酵素をホロ酵素と呼ぶ。
論文情報
掲載誌 :ACS Synthetic Biology
論文タイトル :One-Pot De Novo Synthesis of [4Fe-4S] Proteins Using a Recombinant SUF System under Aerobic Conditions
著者 :Po-Hsiang Wang, Shota Nishikawa, Shawn Erin McGlynn, and Kosuke Fujishima
DOI :10.1021/acssynbio.3c00155