2023-10-20 理化学研究所,慶應義塾大学医学部,大阪大学
理化学研究所(理研)生命医科学研究センター 免疫器官形成研究チームの関田 愛子 研究員、川崎 洋 上級研究員、古関 明彦 チームリーダー、皮膚恒常性研究チームの天谷 雅行 チームリーダー(慶應義塾大学 医学部 皮膚科学教室 教授)、システム遺伝学チームの岡田 随象 チームリーダー(大阪大学 大学院医学系研究科 遺伝統計学 教授)らの共同研究グループは、アトピー性皮膚炎患者の複数の形質に関わる病態の違いを同定しました。
本研究成果は、アトピー性皮膚炎患者の個別化医療[1]に向けた病態多様性の理解と患者層別化[2]に貢献すると期待できます。
今回、共同研究グループは、アトピー性皮膚炎患者115人と健常者14人の皮膚組織および血液の遺伝子発現を解析し、アトピー性皮膚炎に特徴的な皮疹性状[3]に関わる遺伝子発現パターンを詳しく調べました。紅斑[3](こうはん)と丘疹[3](きゅうしん)という皮疹性状に着目して遺伝子発現との関係性を解析した結果、アトピー性皮膚炎としてひとくくりにされてきた多様な皮膚症状の根底には異なる分子病態が関わっていることが明らかになりました。また、30人の患者について、1年間にわたる血液の時系列データを解析し、患者ごとの寛解・増悪といった病勢のパターンと遺伝子発現変動パターンが関連すること、また、これが患者の治療履歴を反映していることを示しました。
本研究は、科学雑誌『Nature Communications』オンライン版(10月2日付)に掲載されました。
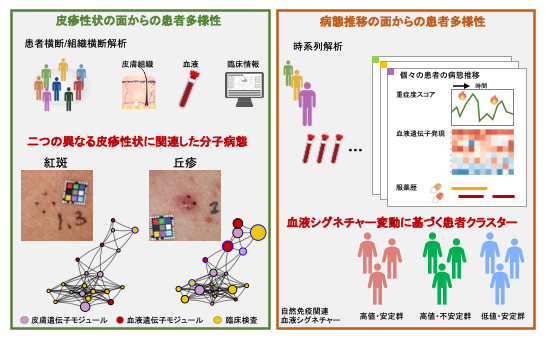
アトピー性皮膚炎患者の病態多様性研究の概略
背景
アトピー性皮膚炎(AD:atopic dermatitis)は、皮膚機能や免疫システムの異常により誘発される慢性の炎症性皮膚疾患です。患者によって異なる遺伝的・後天的要素が絡み合ってさまざまな臨床症状を引き起こします。ADは、症状の違いによる分類の他に、症状の原因となる遺伝的特徴や生理学的背景などに基づく分類が可能であると考えられています。このような分類をエンドタイプと呼び、特定の治療に対する患者ごとの効果の違いに強く関連すると考えられています。しかし、エンドタイプの分類方法は確立されておらず、どの患者にも一様に、皮膚の炎症を抑えるステロイドなどの抗炎症治療薬が主に使われてきました。近年、新たな分子標的薬が次々に開発され、治療の選択肢が広がっていますが、それぞれの患者に合った治療を選択するための知見は十分に得られていません。このため、患者から計測される指標(バイオマーカー)によって各患者の病態の特性を規定した上で、最適化した治療・予防法を提案する個別化医療の実現が求められています。
また、大部分の患者は長年にわたり寛解と増悪を繰り返します。ある一時点の症状の評価だけでは患者の特徴を十分に捉えきれていない可能性があります。このため同一患者の症状の経時的変動を理解した上で予測医療[4]につなげることが期待されています。
このようなADの病態の多様性を理解するには、患者に起きている皮膚の機能的変化および全身の免疫状態を調べる必要があります。組織の遺伝子発現情報は、このような個人の生物学的変化を詳細に評価する有用な指標です。しかし、過去の遺伝子解析研究では、1人の患者からの血液または皮膚組織のみのデータでしか解析されていなかったため、ADにおける全身的な免疫システムの多様性を十分に解明できていませんでした。症状と分子病態の関連についても、皮膚炎の症状が重症か軽症かという単純な評価が使われるだけで、どのような性状の皮疹を来すかといった、より細かいレベルでの症状の多様性が考慮されることはありませんでした。
そこで本研究では、紅斑と丘疹という2種類の特徴的な皮疹性状に着目し、これらと特定の遺伝子発現の関係性からADの病態多様性を解明することを目指しました。また、症状の経時的変化と遺伝子発現変動パターンの関連の解明を試みました。
研究手法と成果
共同研究グループはまず、AD患者115人と健常者14人の被験者の皮膚組織および血液のRNAシーケンス[5]を行い、各組織における遺伝子発現量を網羅的に調べました。
AD患者における皮膚組織と血液の組織間の相互作用を調べるために、サイトカイン[6]などの可溶性因子とその受容体の遺伝子が同時に発現している状態(共発現)に着目した組織間相互作用解析を行いました。その結果、AD患者群では健常群に比べて、皮膚―皮膚の組織内相互作用に加えて皮膚―血液の組織間相互作用の度合いが増大していることが示されました(図1)。すなわち、ADの病態には皮膚組織と血液が互いに作用しながら関与しており、両者の遺伝子発現量を統合して解析することが病態解明に重要と考えられました。
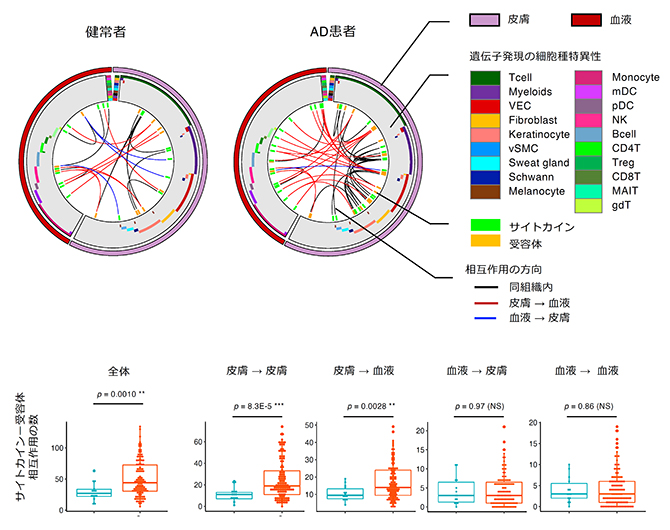
図1 皮膚組織と血液の組織間の相互作用
(上)健常者とAD患者の代表例。サイトカイン(緑色)とその受容体(黄色)の発現について、一定数以上のペアが組織横断的に曲線で連結されている。灰色の帯は、該当のサイトカインあるいは受容体を主に発現している細胞の種類を示す。
(下)サイトカインー受容体間相互作用の数。健常者(青)に比べて、AD患者(赤)では皮膚→皮膚の組織内相互作用および皮膚→血液の組織間相互作用の数が多い。矢印の方向は、サイトカインを発現している組織から受容体を発現している組織への作用の方向を示す。
異なる組織のRNAシーケンスデータは、発現量の分布が大きく違うため、皮膚と血液の絶対発現量を単純に結合すると解釈が難しくなってしまいます。また、RNAシーケンスでは2万個程度の遺伝子の発現データが得られるため、複数組織のデータを合わせると、発現量の関係を解析する指標の数(次元数[7])が膨大になってしまいます。
そこで共同研究グループは、各組織における遺伝子発現量を、遺伝子間の共発現の大きさに基づき次元圧縮[7]しました。AD患者横断データを用いて、共発現する遺伝子同士を一つのグループにまとめる遺伝子発現モジュールを定義することにより、データ次元数を大幅に削減できるだけでなく、ADに特徴的な遺伝子発現パターンを強調することができます。この解析では、皮膚組織で21モジュール、血液で15モジュールをそれぞれ同定できました。これらのモジュールを構成する遺伝子群は、各免疫細胞種や皮膚細胞種に特異的な発現パターンを持つこと(図2)、また免疫制御や代謝など特定の分子の反応に関わっていることが、公共データベース上のデータを活用した解析により明らかになりました。すなわち、これらのモジュールはADの病態に関連する生物学的機能を反映した遺伝子の集団であると示唆されました。
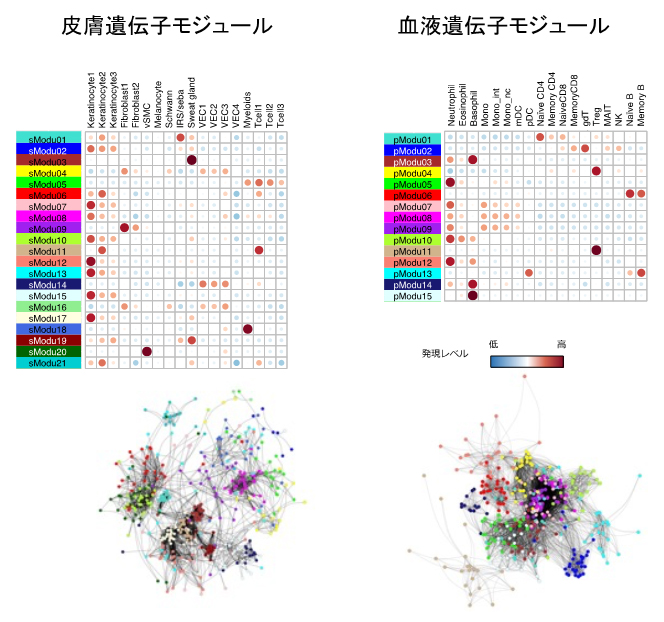
図2 遺伝子発現モジュールの細胞種ごとの発現特異性と遺伝子ネットワークのイメージ図
(上)縦軸は遺伝子発現モジュール、横軸は発現量解析に使用した細胞の種類。丸が大きく濃い赤であるほど、その細胞種で高く発現していることを示す。例えば、皮膚遺伝子発現モジュールのsModu18はMyeloids(骨髄系細胞)で特異的に高発現していることが見てとれる。
(下)丸は一個の遺伝子を示し、同一モジュール内の遺伝子は同一色(上図のモジュールごとの色に対応)で描かれている。モジュール内およびモジュール間で共発現レベルの高いもの同士が近くに位置するように配置されている。免疫細胞によるサイトカイン制御に関わるモジュールとケラチノサイトにおけるストレスに関わるモジュールが密接に関連しているなど、モジュール間の関係性が分かる。
次に、共同研究グループは、病型多様性の一つの切り口として、紅斑および丘疹という2種類の皮疹性状に着目し、それぞれの皮疹性状の度合いと皮膚組織の遺伝子発現モジュールの関係性を解析しました。
その結果、紅斑には、皮膚のケラチノサイト[8]、皮膚に分布する単球や樹状細胞、および血液の制御性T細胞で主に発現するモジュールが寄与していることが明らかになりました。一方、丘疹には、血液のB細胞、血液のCD4陽性T細胞、皮膚の血管内皮細胞、および皮膚の線維芽細胞で主に発現するモジュールが寄与していました。これらのことから、アトピー性皮膚炎としてひとくくりにされてきた多様な皮疹性状の根底には異なる分子病態が存在することが示されました。
また、30人のAD患者について、1年間にわたる血液時系列データを解析し、病勢パターンと遺伝子発現変動パターンの関連解析を行いました。まず、血液遺伝子発現の時系列特徴量[9]で患者を分類したところ、自然免疫に関わる分子シグナチャー[10]が1年間にわたり①比較的高値で安定なクラスター、②高値と低値の変動が大きいクラスター、③比較的低値で安定なクラスターに分かれました。これらの患者の症状の時系列特徴量を照らし合わせると、症状の推移は、クラスター①では比較的重症な状態が継続的に続く、クラスター②では寛解と増悪を繰り返す、クラスター③では比較的軽症な状態を維持していることが分かりました(図3)。さらに、クラスター①の患者は免疫抑制剤の服用歴のある患者が多く、いわゆる難治性ADと高度に重複していることが示唆されました。以上のことから、患者ごとの寛解と増悪といった病勢のパターンと遺伝子発現変動パターンが関連することと、これが患者の治療履歴を反映していることが示されました。
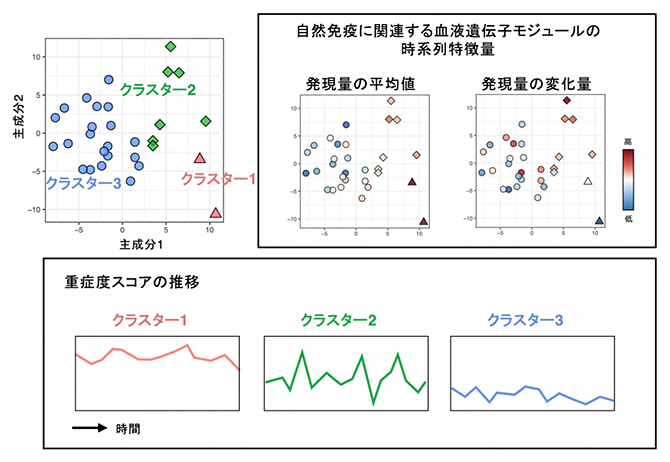
図3 血液遺伝子発現の時系列特徴量に基づき見いだされた三つの患者クラスター
(左上) 患者を三つのクラスターに分類し、主成分分析のプロット上に可視化した図。一つの点は1人の患者を示す。
(右上) 血液遺伝子モジュールの時系列特徴量の大きさを色で示した図。濃い赤色ほど特徴量が高値、濃い青ほど低値である。点の配置は左上図に同じ。
(下) 患者クラスターごとの病勢の推移。
今後の期待
ADについては、今回着目した皮疹性状や病態推移の観点以外にも、気管支喘息などの合併症の有無や遺伝的素因といったさまざまな切り口からの患者病態の多様性を議論できると考えられます。今後は、より広範囲の臨床情報および生体分子の網羅的情報を統合し解析することで、患者の多様性およびADのエンドタイプについて理解を深めるとともに、各患者の治療標的の同定を通して個別化医療の実践につなげることが期待されます。
補足説明
1.個別化医療
遺伝子情報、ライフスタイルや環境(食事、喫煙、紫外線暴露など)といった情報に基づき、個別の患者病態の違いを考慮し個々に最適と考えられる治療を提供する医療。
2.患者層別化
個人が診断された疾患のタイプに応じて、患者が属する部分集団を定義すること。
3.皮疹性状、紅斑、丘疹
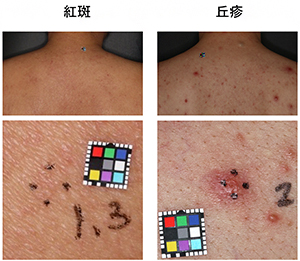
皮膚の病的変異のうち、炎症性のものを皮疹という。皮疹は見た目などの性状から複数のタイプに分類できる。紅斑は真皮内血管の拡張による皮膚の赤みや平坦な皮膚表面を特徴とする皮疹。丘疹は皮膚表面が小さく盛り上がった発疹。どちらもADの代表的な皮疹性状である。図は紅斑(左)と丘疹(右)の臨床外観写真で、カラースケールの一辺は1cm。
4.予測医療
現在あるいは過去の個人の状態から、未来の病気の発症・増悪を予測し、早めに治療を開始したり食事などの環境要因の改善に取り組んだりすることで、発症・増悪を未然に防ぐことを狙いとした医療。
5.RNAシーケンス
次世代シーケンサーと呼ばれる一度に大量の塩基配列を読み取ることができる装置を用いて、網羅的に遺伝子の発現量を解析する手法。
6.サイトカイン
主に免疫系細胞から分泌され、免疫シグナルを伝達する低分子タンパクの総称。炎症性疾患では多くの場合、サイトカインの調節異常が認められる。
7.次元数、次元圧縮
次元数とは、データにおける測定項目の数など、解析に使う変数の数。次元圧縮とは、多次元から成る情報を、その特徴を保ったまま、それより少ない次元の情報に落とし込むこと。
8.ケラチノサイト
皮膚表皮を形成する上皮細胞。外側に向かって成熟分化し、最終的には表皮バリア機能に特に重要な角層を形成する。AD患者では高頻度に表皮バリア機能の異常が見られる。
9.時系列特徴量
対象となる時系列データの特徴を数値にして表したもの。代表的なものに、同一個体における複数測定点の平均値や変化量がある。
10.分子シグナチャー
ある患者群、細胞種などの集団を特徴付ける遺伝子やタンパク質の発現パターン。
共同研究グループ
理化学研究所
生命医科学研究センター
免疫器官形成研究チーム
研究員 関田 愛子(セキタ・アイコ)
上級研究員 川崎 洋(カワサキ・ヒロシ)
チームリーダー 古関 明彦(コセキ・ハルヒコ)
皮膚恒常性研究チーム
チームリーダー 天谷 雅行(アマガイ・マサユキ)
(慶應義塾大学 医学部 皮膚科学教室 教授)
システム遺伝学チーム
チームリーダー 岡田 随象(オカダ・ユキノリ)
(大阪大学 大学院医学系研究科 遺伝統計学 教授)
情報統合本部 先端データサイエンスプロジェクト
プロジェクトリーダー 桜田 一洋(サクラダ・カズヒロ)
医療データ数理推論チーム
チームリーダー 川上 英良(カワカミ・エイリョウ)
医科学データ共有開発ユニット
ユニットリーダー 清田 純(セイタ・ジュン)
慶應義塾大学 医学部 皮膚科学教室
助教 福島―野村 彩乃(フクシマーノムラ・アヤノ)
研究支援
本研究は、日本医療研究開発機構(AMED)免疫アレルギー疾患実用化研究事業「臨床・オミクス情報の統合解析による、アトピー性皮膚炎とそれに併発する他臓器アレルギー疾患の病態解明(研究開発代表者:古関明彦)」「アトピー性皮膚炎の個別化医療・予測医療実現に向けた、皮膚トランスクリプトーム解析研究(研究開発代表者:古関明彦)」「アトピー性皮膚炎の個別化予測医療を目指した皮膚微生物叢解析研究(研究開発代表者:天谷雅行)」「皮膚・腸内微生物叢解析によるアトピー性皮膚炎発症機序の解明(研究開発代表者:天谷雅行)」、科学技術振興機構(JST)イノベーションハブ構築支援事業「高精度の予測に基づく予防医療の実現に向けた疾患ビッグデータ主導型イノベーションハブ(代表:小安重夫)」、日本学術振興会(JSPS)科学研究費助成事業若手研究「皮膚システム病理解析による各アトピー性皮膚炎層別化集団の皮膚炎症動態の解明(研究代表者:関田愛子)」「アトピー性皮膚炎の炎症長期化にともなう血管機能変化の制御機構解明(研究代表者:関田愛子)」による助成を受けて行われました。
原論文情報
Aiko Sekita, Hiroshi Kawasaki, Ayano Fukushima-Nomura, Kiyoshi Yashiro, Keiji Tanese, Susumu Toshima, Koichi Ashizaki, Tomohiro Miyai, Junshi Yazaki, Atsuo Kobayashi, Shinichi Namba, Tatsuhiko Naito, Qingbo Wang, Eiryo Kawakami, Jun Seita, Osamu Ohara, Kazuhiro Sakurada, Yukinori Okada, Masayuki Amagai, and Haruhiko Koseki, “Multifaceted analysis of cross-tissue transcriptomes reveals phenotype-endotype associations in atopic dermatitis”, Nature Communications, 10.1038/s41467-023-41857-8
発表者
理化学研究所
生命医科学研究センター 免疫器官形成研究チーム
研究員 関田 愛子(セキタ・アイコ)
上級研究員 川崎 洋(カワサキ・ヒロシ)
チームリーダー 古関 明彦(コセキ・ハルヒコ)
皮膚恒常性研究チーム
チームリーダー 天谷 雅行(アマガイ・マサユキ)
(慶應義塾大学 医学部 皮膚科学教室 教授)
システム遺伝学チーム
チームリーダー 岡田 随象(オカダ・ユキノリ)
(大阪大学 大学院医学系研究科 遺伝統計学 教授)
報道担当
理化学研究所 広報室 報道担当
慶應義塾大学 信濃町キャンパス 総務課:飯塚・奈良・岸
大阪大学大学院医学系研究科 広報室