2023-10-30 理化学研究所
理化学研究所(理研)生命医科学研究センター 免疫細胞治療研究チームの伊豫田 智典 技師、清水 佳奈子 上級研究員、藤井 眞一郎 チームリーダー(科技ハブ産連本部 創薬・医療技術基盤プログラム 副プログラムディレクター)らの研究グループは、マウスの自然免疫[1]リンパ球の一つであるナチュラルキラーT細胞(NKT細胞)[2]において、抗原[3]刺激後の長期エフェクター細胞[4]が末梢組織で分化する際に、転写制御因子Zeb2[5]が中心的な役割を果たすことを明らかにしました。
本研究成果は、自然免疫であるNKT細胞が長期メモリー細胞を誘導するメカニズムの理解を深めるとともに、NKT細胞を免疫療法におけるバイオマーカーとして利用する手法の開発に貢献すると期待されます。
今回、研究グループは、NKT細胞の抗原を提示したCD1d発現細胞(CD1d細胞/NKT-L)[6]を投与することで誘導されるKlrg1陽性NKT細胞[7]が、Zeb2を高発現することを見いだし、NKT細胞の活性化後に長期メモリーNKT細胞へ分化する上でZeb2が中心的な役割を果たすことを示しました。この分化過程でZeb2は、活性化したNKT細胞のアポトーシス[8]を抑制し、Klrg1陽性エフェクター細胞への分化を促進させます。
本研究は、科学雑誌『Communications Biology』オンライン版(10月30日付、日本時間10月30日)に掲載されました。
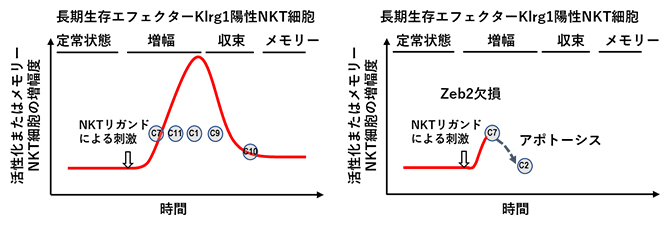
NKT細胞が抗原(リガンド)刺激を受けた際の転写制御因子の有無による活性遷移の違い
背景
T細胞[3]やB細胞[3]では、一度出合ったウイルスなどの病原体やがん細胞に対して免疫記憶[9]が誘導され、同じ抗原に対しては長期間免疫応答を維持することがよく知られています。一方、自然免疫リンパ球はこれまで病原体やがん細胞に対して素早く攻撃を開始するものの、その後エフェクター細胞は死んでいなくなると考えられていました。NKT細胞などの自然免疫リンパ球はがん細胞に対する免疫応答を強力に誘導する細胞であり、これらの細胞の活性を長期間維持することは効果的ながん免疫治療を開発する上で重要な課題でした。
藤井チームリーダーらは、2014年に、マウスにCD1d細胞/NKT-Lを投与して誘導されるKlrg1陽性NKT細胞が長期生存エフェクター細胞として抗腫瘍効果を発揮することを発見しました注1)。2019年には、NKT細胞が胸腺においてIFN-γなどのTヘルパー1型のサイトカインを産生するNKT1サブセット[10]へ分化する過程と、末梢組織で抗原刺激を受けた際にKlrg1陽性細胞へ分化する上で転写制御因子EOMES[11]が必要であることを明らかにしていました注2)。しかし、胸腺での分化に影響しないKlrg1陽性NKT細胞の分化・維持に関与する転写制御因子は見つかっていませんでした。
注1)Shimizu K et al., 2014, KLRG1+ invariant natural killer T cells are long-lived effectors. Proc Natl Acad Sci U S A, volume 111, page 12474-12479
注2)Shimizu K. et al., 2019, Eomes transcription factor is required for the development and differentiation of invariant NKT cells. Commun Biol. volume 2, eCollection 2019.
研究手法と成果
研究グループはCD1d陽性細胞の一つである樹状細胞(DC)[12]やCD1d発現HEK293細胞を利用して、そこに、NKT細胞の抗原(リガンド)(NKT-L)の一つであるα-ガラクトシルセラミド(α-GalCer)[13]を添加してマウスに投与することにより、長期生存Klrg1陽性NKT細胞が誘導できることを報告してきました注1)。
今回、α-GalCerを添加したDC(DC/Gal[12])投与マウスの肺NKT細胞の遺伝子発現パターンについて、転写因子に着目して、既報のRNAseqデータ[14]を用いて解析すると、DC/Galを投与していないマウスの肺NKT細胞に比べてZeb2の発現が非常に高いことを発見しました。
この発現を確認するために定量PCR[15]によりZeb2の発現量を比較しました。DC/Gal投与後1週間の野生型(WT)マウスでのZeb2の発現は、Klrg1陽性NKT細胞の方がKlrg1陰性NKT細胞[7]に比べて非常に高いことが分かりました。T細胞やナチュラルキラー細胞(NK細胞)[2]ではZeb2の発現が転写因子T-bet[16]により制御されることが分かっています。そこで、T-bet欠損マウスにDC/Galを投与し、Zeb2の発現をKlrg1陽性と陰性のNKT細胞で比較したところ、NKT細胞でもT細胞やNK細胞と同様に、Zeb2の発現はT-betにより制御されていることが分かりました(図1)。
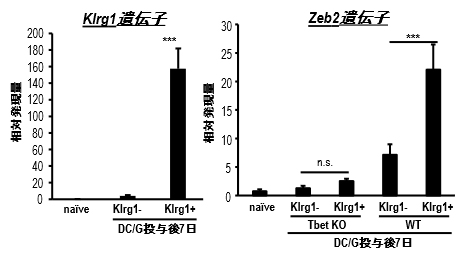
図1 Klrg1陽性NKT細胞のZeb2遺伝子発現
DC/Gal投与後1週間の肺NKT細胞のKlrg1遺伝子(左図)とZeb2遺伝子の発現を定量PCRで比較。野生型マウス(WT)ではKlrg1陽性NKT細胞がKlrg1陰性NKT細胞よりも有意に高くZeb2遺伝子を発現していた。T-bet欠損マウスではこの差は認められなかった。
NKT細胞でZeb2がどのような働きをしているのかを調べるために、Cre/loxPシステムを用いたコンディショナルノックアウト法[17](cKO法)によりZeb2を欠損したNKT細胞(Zeb2-cKO)を作製しました。Zeb2-cKOを用いてZeb2が胸腺におけるNKT細胞発生成熟過程に与える影響を調べました。胸腺NKT細胞は細胞表面マーカー[18](CD24、CD44、NK1.1)の発現パターンで成熟過程をステージ0~3の4段階に分けることができます。各ステージのNKT細胞の割合をZeb2-cKOとWTやCre陰性同腹仔[19]で比較するといずれも差がないことから、Zeb2の発現は胸腺からのNKT細胞の発生過程には影響を与えないことが分かりました(図2)。
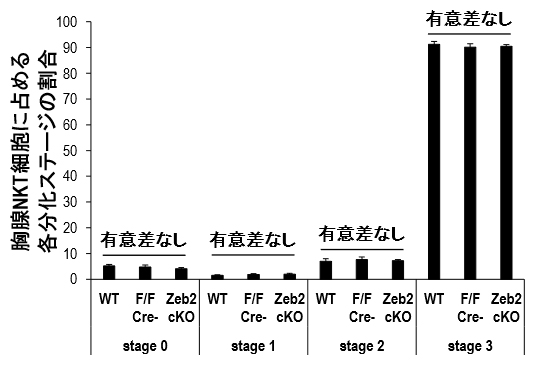
図2 NKT細胞の胸腺分化におけるZeb2
胸腺内分化において、NKT細胞は細胞表面マーカー(CD24、CD44、NK1.1)の発現でステージ0~3の4段階に成熟過程を分けられる。Zeb2コンディショナルノックアウトマウスのNKT細胞数は野生型マウスや同腹仔と比較して各分化ステージで差がなかった。
次に、末梢組織でのNKT細胞の機能にZeb2が与える影響を調べました。Zeb2-cKOとWTやCre陰性の同腹仔で肺、脾臓や肝臓のNKT細胞の数が変わらないことから、胸腺から移動したNKT細胞が末梢組織で生存するにはZeb2は必要ないことが分かりました。以前の研究より抗原刺激を受けたNKT細胞はKlrg1陽性になるとともに、エフェクター細胞マーカーであるグランザイムA(GzmA)やCx3cr1を発現することが分かっています。そして、DC/Gal投与により誘導されたKlrg1陽性NKT細胞はWTマウスの肺で9カ月以上にわたり存在し、長期生存エフェクター細胞として機能することが示されています注1)。
そこで、活性化NKT細胞の長期生存にZeb2の欠損が与える影響を調べました。WTおよび同腹仔ではKlrg1陽性NKT細胞は高い頻度で維持されるのに対して、Zeb2-cKOではKlrg1陽性NKT細胞は著しく減少していました。さらにKlrg1陽性NKT細胞の中のGzmA陽性Cx3cr1陽性エフェクター細胞を調べると、Zeb2-cKOではほとんどエフェクター細胞が存在しませんでした(図3)。
これらの結果から、Zeb2は末梢組織におけるNKT細胞の活性化から長期エフェクター細胞への分化と生存に重要な働きをしていることが分かりました。
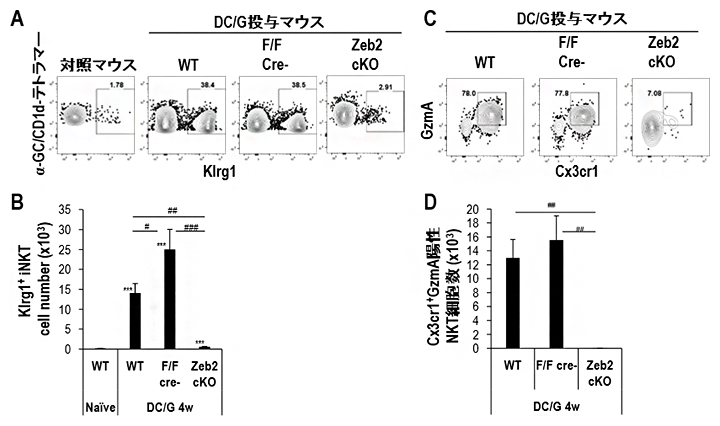
図3 活性化刺激後のNKT細胞におけるZeb2の機能
DC/Gal投与後4週間で肺のNKT細胞をフローサイトメトリーで解析した。
(A、B)Klrg1陽性NKT細胞の割合をフローサイトメトリーで測定(A)。Zeb2コンディショナルノックアウトマウス(Zeb2-cKOマウス)のKlrg1陽性NKT細胞数を野生型マウスや同腹仔と比較した(B)。
(C、D)Klrg1陽性NKT細胞におけるグランザイムA(GzmA)とCx3cr1発現陽性細胞をフローサイトメトリーで測定(C)。Zeb2-cKOマウスのGzmA陽性Cx3cr1陽性Klrg1陽性NKT細胞数を野生型マウスや同腹仔と比較(D)。
DC/Gal投与後に長期間Klrg1陽性NKT細胞が肺に存在する現象は、胸腺から新しいNKT細胞が肺へ移動し継続的に活性化しているという可能性も考えられます。そこで、WTマウスに胸腺摘出処置を施し2週間後にDC/Galを投与しました。DC/Gal投与後4週間で肺のNKT細胞を偽処置マウス(胸腺を摘出しなかったマウス)と比較すると、Klrg1陽性NKT細胞やその中のエフェクター細胞の割合も胸腺摘出マウスと偽処置マウスで差はありませんでした(図4)。この結果から肺において抗原刺激後に分化したKlrg1陽性NKT細胞が末梢で維持されることが示されました。
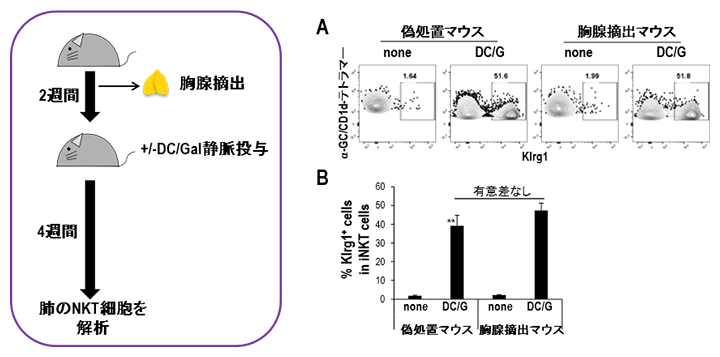
図4 胸腺摘出マウスを用いたNKT細胞の長期生存実験
A.胸腺摘出後2週間でDC/Galを投与し、さらに4週間後に肺のNKT細胞をフローサイトメトリーで解析。
B.胸腺摘出マウスと偽処置マウスでKlrg1陽性NKT細胞の割合に差はないことから、活性化したNKT細胞が長期生存することが示された。
Klrg1陽性NKT細胞が分化していく過程でZeb2がどのような役割を果たしているのか、より詳細に解明するため、Zeb2-cKOマウスと同腹のコントロールマウスにDC/Galを投与し、1週間後に肺Klrg1陽性NKT細胞をソーティング(より分けて精製)し、シングルセルトランスクリプトーム解析[20]を行いました。その結果、コントロール群ではNKT1タイプの細胞のクラスターが大部分を占めるのに対し、Zeb2欠損Klrg1陽性NKT細胞はアポトーシスを起こしているクラスターが大半を占めていることが判明しました。trajectory解析[21]を行うと、コントロール群ではNKT1タイプのクラスターが「C7-C11-C1-C9-C10」と分化していることが示唆されました。実際、Zeb2欠損Klrg1陽性細胞をフローサイトメトリー[22]で解析すると、増殖マーカーであるKi-67の陽性率はコントロール群に比べ低下し、アポトーシスのマーカーであるAnnexin-Vの陽性率がコントロール群に比べ有意に高いことが分かりました(図5)。
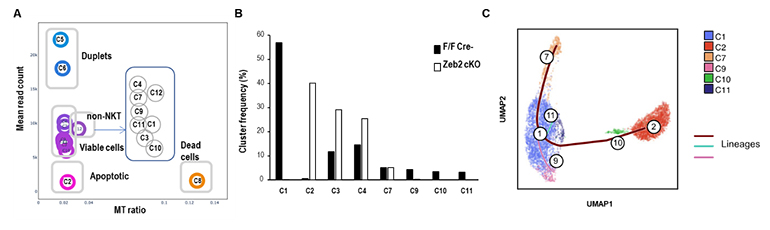
図5 Klrg1陽性細胞のシングルセル解析
Zeb2-cKOマウスと同腹のコントロールマウスにDC/Galを投与して1週間たったところで、肺Klrg1陽性NKT細胞をソーティングし、シングルセルトランスクリプトーム解析を行った。
A.両サンプルを統合したクラスターを示す。NKT細胞クラスターとして8クラスターを同定した。クラスター2(C2)はアポトーシスを起こしている。
B.クラスター頻度を示す。C2, C3, C4, C7はZeb2欠損でも検出されたことからZeb2非依存性のクラスターである。
C.遺伝子発現パターンから同定されたNKT1タイプのクラスターのtrajectory解析を示す。
今後の期待
今回、メモリーNKT細胞の末梢組織での分化誘導の成立について、Zeb2因子の同定とその記憶誘導機構[23]の分子メカニズムが明らかになりました。このことは今後、他の免疫細胞との相違点を比較することで、自然免疫の免疫記憶の意義を解明する糸口になると考えられます。またこの成果はがんやアレルギー等NKT細胞の関与するさまざまな疾患に対する免疫の役割を解明することに役立つと期待されます。
補足説明
1.自然免疫
先天的な免疫システムで、病原体やがん細胞などの異常を迅速に感知して初期の生体防御を行う。
2.ナチュラルキラーT細胞(NKT細胞)、ナチュラルキラー細胞(NK細胞)
両者とも自然免疫を担うリンパ球である。NK細胞は、ウイルスによる感染やがん細胞に対する初期防御機構としての働きを担っている。NKT細胞は、NK細胞のマーカーと1種類のT細胞受容体を発現していて、アレルギー疾患、がん、自己免疫疾患を制御する機能を持つ中核的な免疫調節細胞である。
3.抗原、T細胞、B細胞
抗原はT細胞やB細胞の受容体に結合して免疫応答を誘導する物質のこと。B細胞とは抗原に特異的な抗体分子を産生する細胞である。T細胞はヘルパーT細胞とキラーT細胞に分類され、ヘルパーT細胞の機能の一つとして、B細胞を補助してB細胞からの抗体産生を誘導する機能がある。
4.エフェクター細胞
直接的(接着や結合)あるいは間接的(生理活性物質の放出など)に他の細胞に働きかけることで、免疫反応を惹起させる機能を有する細胞。
5.転写制御因子Zeb2
胎児の発育、創傷治癒やがんなど、さまざまな生体現象に関与する転写制御因子。免疫系ではNK細胞の成熟、CD8 T細胞のエフェクター細胞への最終分化を制御することなどが知られている。
6.CD1d発現細胞(CD1d細胞/NKT-L)
CD1分子はMHCクラスⅠ分子と立体構造がよく似た分子で抗原として糖脂質を提示でき、グループ1(CD1a、CD1b、CD1c)とグループ2(CD1d)が存在し、CD1dと糖脂質の複合体はNKT細胞により特異的に認識される。CD1d細胞/NKT-LはNKT-Lを結合したCD1dを細胞表面に発現している細胞。
7.Klrg1陽性NKT細胞、Klrg1陰性NKT細胞
Klrg1はC型レクチン様ドメインを持つ膜タンパクでNK細胞やT細胞に発現することが知られている。NKT細胞は定常状態ではKlrg1陰性だが抗原刺激を受け活性化するとKlrg1陽性となる。
8.アポトーシス
細胞形態の変化を伴う制御された細胞死の一つで、カスパーゼの活性化により起こる。
9.免疫記憶
免疫反応で、特定の抗原に反応した細胞が同じ抗原と再び出合うとより強く反応する現象のこと。活性化したT細胞やB細胞から分化して長期間生き続けるものを長期メモリー細胞と呼ぶ。従来、獲得免疫であるT細胞やB細胞の機能として知られていたが、自然免疫細胞にも同様の機能があることが最近報告されている。
10.NKT1サブセット
NKT細胞の中でもIFN-γなどのTヘルパー1型のサイトカインを多く作ることができる細胞。
11.転写制御因子EOMES
活性化したCD8 T細胞やNK細胞に発現する転写制御因子で、CD8 T細胞のエフェクター分子の発現や長期メモリー細胞への分化に必須。
12.樹状細胞(DC)、DC/Gal
樹状細胞は、MHCクラスⅠやクラスⅡ分子を発現し、強力な抗原提示能を有している免疫細胞の一種(DCはdendritic cellsの略)。広く全身に存在し、周囲に突起を伸ばす形態から「樹状」と名付けられ、発現している表面抗原分子により、骨髄系樹状細胞、形質細胞様樹状細胞、ランゲルハンス細胞(Langerhans cell)などに分類されている。DC/GalはNKT細胞の抗原であるα-ガラクトシルセラミドを提示しているDC。
13.α-ガラクトシルセラミド(α-GalCer)
海綿より抽出されたスフィンゴ糖脂質の誘導体で、CD1dに結合したα-GalCerはNKT細胞のT細胞受容体と結合し、NKT細胞を活性化させる。
14.RNAseqデータ
いわゆる「次世代シークエンサー」による実験によって取得された、RNAの配列断片データ。これを基に、遺伝子などの転写産物の発現量や配列、スプライスバリアントなどが解析できる。
15.定量PCR
定量PCR(qPCR、quantitative PCR)とは、DNAを増幅するPCR(polymerase chain reaction)の手法を用いて、サンプルに含まれているDNA量を測定する手法。本研究で用いたqRT-PCR法では、RNAを逆転写して作ったcDNAをこの手法で測定することでRNA量を測定している。
16.転写因子T-bet
IFN-γを産生するTh1細胞の分化に必要なマスター転写因子。NKT1サブセットの分化にも必須である。
17.コンディショナルノックアウト法
Cre/loxPシステム(loxP配列と呼ばれるDNA配列に対し、DNA組換え酵素(Cre)を用いて組換えを行う方法)などにより、時期特異的、部位特異的に遺伝子を欠失させたマウスを作製する手法。
18.細胞表面マーカー
細胞の表面に発現しているタンパク質などの分子を指し、細胞の種類や活性化状態などを同定するために使用される。
19.同腹仔
母親が一度に身ごもった仔マウスのこと。
20.シングルセルトランススクリプトーム解析
細胞一つ一つについてDNAから転写されるRNAなどの全転写産物を網羅的に調べる手法。
21.trajectory解析
遺伝子発現のパターンから細胞がどのように遺伝子の発現を変えていくのか推定する手法。
22.フローサイトメトリー
1個1個の細胞にレーザー光を照射し、その散乱光や蛍光を測定することで、細胞の情報を取得したり、特定の細胞を分取したりする技術。
23.記憶誘導機構
長期メモリー細胞を作り出すメカニズムのこと。
研究グループ
理化学研究所 生命医科学研究センター
免疫細胞治療研究チーム
技師 伊豫田 智典(イヨダ・トモノリ)
上級研究員 清水 佳奈子(シミズ・カナコ)
大学院生(当時)青島 萌乃歌(アオシマ・ホノカ)
嘱託職員 佐藤 美紀子(サトウ・ミキコ)
研究員 植田 翔悟(ウエダ・ショウゴ)
テクニカルスタッフⅠ 中里 洋(ナカザト・ヒロシ)
研究員 山﨑 哲(ヤマサキ・サトル)
チームリーダー 藤井 眞一郎(フジイ・シンイチロウ)
(科技ハブ産連本部 創薬・医療技術基盤プログラム 副プログラムディレクター)
統合ゲノミクス研究チーム
技師 渡辺 貴志(ワタナベ・タカシ)
技師 遠藤 高帆(エンドウ・タカホ)
免疫転写制御研究チーム
チームリーダー 谷内 一郎(タニウチ・イチロウ)
研究支援
本研究は日本学術振興会(JSPS)科学研究費助成事業科研費基盤研究(C)「長期抗腫瘍効果を示すNKT細胞サブセットの同定(研究代表者:藤井眞一郎)」および理研理事長ファンドの助成を受けて行われました。
原論文情報
Tomonori Iyoda*, Kanako Shimizu*, Takashi Watanabe, Takaho Endo, Ichiro Taniuchi, Honoka Aoshima, Mikiko Satoh, Hiroshi Nakazato, Satoru Yamasaki and Shin-ichiro Fujii,(*equally contribution), “Zeb2 regulates differentiation of long-lived effector of invariant NKT cells”, Communication Biology, 10.1038/s42003-023-05421-w
発表者
理化学研究所
生命医科学研究センター 免疫細胞治療研究チーム
技師 伊豫田 智典(イヨダ・トモノリ)
上級研究員 清水 佳奈子(シミズ・カナコ)
チームリーダー 藤井 眞一郎(フジイ・シンイチロウ)
(科技ハブ産連本部 創薬・医療技術基盤プログラム 副プログラムディレクター)
報道担当
理化学研究所 広報室 報道担当