2023-12-23 理化学研究所,京都大学
理化学研究所(理研)生命機能科学研究センター 老化分子生物学研究チームの村田 梢 研究員(臨床橋渡しプログラム[1]・升本研究室 研究員)、升本 英利 上級研究員(同升本研究室研究リーダー、京都大学 医学附属病院 心臓血管外科 特定准教授)、京都大学 医生物学研究所 ウイルス感染研究部門の朝長 啓造 教授、牧野 晶子 准教授らの共同研究チームは、新型コロナウイルス(SARS-CoV-2)の持続的な感染が心不全のリスクを高める可能性があることを、ヒトiPS細胞[2]を用いた実験で明らかにしました。
本研究成果は、これまでほとんど報告のないヒト心臓組織に対するSARS-CoV-2の持続感染の影響を示したものであり、「ポストコロナ」においてパンデミック[3]が危惧される心不全(SARS-CoV-2心筋症)の発症・進行メカニズムの解明や、治療法の開発に貢献すると期待できます。
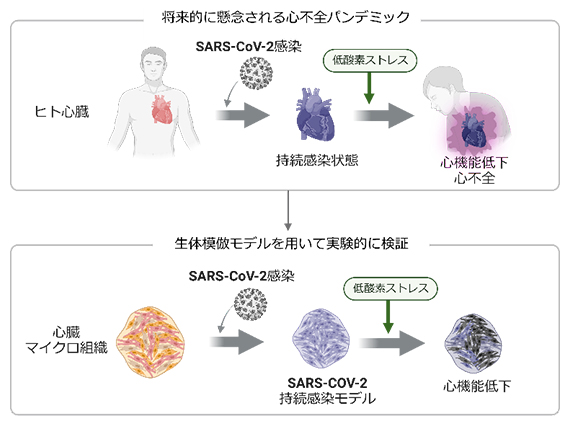
2019年から始まった新型コロナウイルス感染症(COVID-19)パンデミックでは、爆発的なウイルス感染者数の増加が起こりました。この状況は将来、SARS-CoV-2の持続感染を素因とする「心不全パンデミック」に発展する可能性があります。
今回、共同研究チームは、ヒトiPS細胞から作製した心臓マイクロ組織[4]にSARS-CoV-2を感染させた「SARS-CoV-2持続感染モデル」を確立しました。これにより、SARS-CoV-2が持続的に感染したヒト心臓組織は、非感染組織に比べて、虚血性心疾患[5]を模した低酸素ストレス下での心機能低下を引き起こしやすいことを明らかにしました。
本研究は、科学雑誌『iScience』オンライン版(12月22日付:日本時間12月23日)に掲載されました。
心不全パンデミックを実験的に検証する生体模倣モデル「SARS-CoV-2持続感染モデル」
背景
新型コロナウイルス(SARS-CoV-2)の累積感染者数は、2023年6月時点で7億6,700万人を超え、死亡者数は690万人に達しました注1)。一方、流行初期と比べて変異株の重症化率が低下していることや、ワクチン接種、治療薬の開発などを経て、現在の状況は「新型コロナウイルス感染症(COVID-19)パンデミック」から「ポストコロナ」に移行し、医療対策は急性期の症状だけではなく、慢性的な健康問題にも焦点が当てられるようになりました。
SARS-CoV-2は、アンジオテンシン変換酵素2(ACE2[6])を介して細胞に感染します。心臓におけるACE2の発現は他の臓器に比べて高く、さらに心不全患者では、心筋細胞におけるACE2の発現が健常対照者よりも高いことが複数の文献で報告されています。このことから、疾患状態の心臓はSARS-CoV-2に感染しやすい可能性があります。また、COVID-19が流行する10年以上前に行われた研究では、特発性慢性心筋症患者の心内膜生検[7]からウイルスゲノムが検出されたこと注2)や、慢性的なウイルス感染が心機能を低下させること注3)が報告されていました注4)。これらを総合的に勘案すると、今回のCOVID-19パンデミックにより、今後、SARS-CoV-2の持続感染を素因とする心不全リスク人口が指数関数的に増加する「心不全パンデミック」の発生が危惧されます。
SARS-CoV-2の持続感染が心機能低下と関連するという決定的な臨床証拠は、今のところ報告されていません。しかし、世界規模で生じる恐れのあるヘルスケア上のリスクに対しては、十分な警戒と対策が必要です。本研究では、SARS-CoV-2の心臓への持続感染の可能性と心不全の日和見的進行[8]の潜在リスクについて、ヒトiPS細胞を用いた心臓マイクロ組織注5)による検証を試みました。
注1)世界保健機関(WHO)WEBサイト「Weekly epidemiological update on COVID-19 – 8 June 2023![]() 」
」
注2)Kühl, U. et al., (2005). High prevalence of viral genomes and multiple viral infections in the myocardium of adults with “idiopathic” left ventricular dysfunction. Circulation 111, 887-893.
注3)Kühl, U. et al, (2005). Viral persistence in the myocardium is associated with progressive cardiac dysfunction. Circulation 112, 1965-1970.
注4)ただし、上記2論文で報告されているのはエンテロウイルス、アデノウイルス、パルボウイルス、ヘルペスウイルスなどであり、コロナウイルスは対象となっていない。
注5)2020年11月5日プレスリリース「iPS細胞でヒト心臓の機能を知る」
研究手法と成果
共同研究チームは、ヒトiPS細胞由来の心臓マイクロ組織(cardiac microtissue:CMT)を用いて、ヒト心臓のSARS-CoV-2持続感染モデルを作製しました。CMTは、ヒトiPS細胞から分化した心筋細胞およびその他の心臓構成細胞(血管内皮細胞、血管壁細胞など)で構成され、実際の心臓のように拍動します。また血管網様構造を持つことが特徴で、形態的・機能的にヒトの心臓を模倣したものです(図1)。
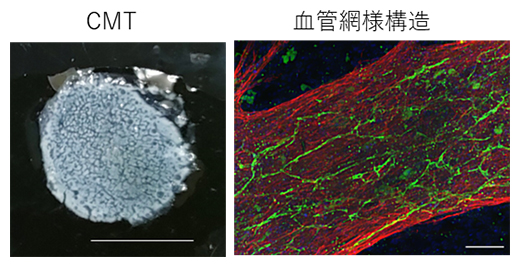
図1 心臓マイクロ組織(CMT)の全体像および血管網様構造の免疫染色図
CMTの全体像(左)および血管内皮細胞マーカー(緑色:CD31)と心筋細胞マーカー(赤色:cTnT)に対する抗体を用いた免疫蛍光染色像(右)。青色は細胞核。CMTでは、実際の心臓のような血管網様構造が再現されている。スケールバーは左が1cm、右は200μm。
COVID-19の症状には、無症状から重症まで広い幅があります。そこで、CMTにSARS-CoV-2をさまざまな力価[9]で感染させて影響を調べたところ、感染後7日目までに全ての例で心機能(組織の収縮力)の低下が見られました。その後、低力価群では4週間後に心機能が回復傾向を示しましたが、高力価群では回復することなく収縮力は低下したままでした(図2)。この高力価での感染モデルは、COVID-19の臨床症状の一つである重篤な急性心疾患を反映している可能性があります。
一方、低力価での感染がCMTに与える影響を詳しく調べたところ、心筋細胞にSARS-CoV-2由来のスパイクタンパク質[6](Sタンパク質)の局在が認められましたが、心筋細胞のアポトーシス[10]はSARS-CoV-2に感染していない組織と同レベルであり、心筋細胞の構造も維持されていました。しかし、組織外に放出されたSARS-CoV-2の力価を測定すると、4週間後も感染直後のウイルス力価と同等の力価を示したことから、CMTに持続感染しているSARS-CoV-2は増殖能を保持していることが示唆されました。
これらの結果は、SARS-CoV-2は軽度の感染であれば、機能障害を引き起こすことなく心筋組織に持続感染できることを示しています。すなわち、SARS-CoV-2感染が持続しながらも心不全を発症せず、表面的には心機能が維持されている患者群が存在している可能性があります。
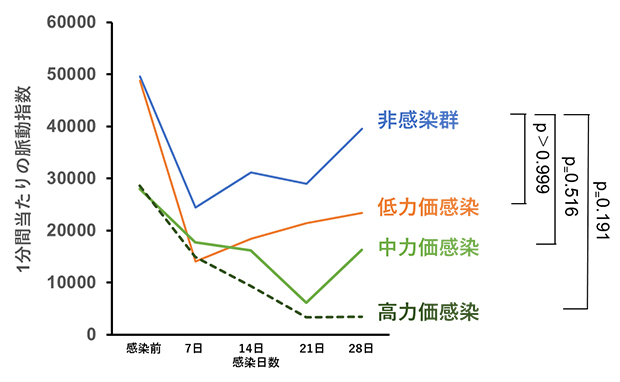
図2 SARS-COV-2感染後心機能の経時変化
CMTにSARS-COV-2を異なる力価で感染させた後、動画解析ツール(MUSCLEMOTION)により算出された1分間当たりの脈動指数の平均値で心機能の経時変化を比較した。非感染群は青(n=4)、低力価SARS-COV-2感染はオレンジ(n=5)、中力価SARS-COV-2感染は緑(n=3)、高力価SARS-COV-2感染は破線(n=3)で示した。28日後の比較では、低力価感染群と非感染群の心機能に統計的な差はないと推定できる。なお、非感染群で見られた脈動指数の低下は、対照実験においても感染実験と同等の操作(SARS-COV-2を含まない試薬の添加など)を行った影響によるものと考えられる。
そこで、低力価で感染したCMTを「SARS-CoV-2持続感染モデル」と見なし、「持続感染の確立した患者は心不全の限界リスクにあり、追加の心臓ストレスによって日和見的に心機能障害、最終的には心不全を発症する可能性がある」という仮説を実験的に検証しました。追加の心臓ストレスの例としては、臨床的には虚血などにより心臓が一時的な低酸素状態にさらされることが考えられます。
虚血性心疾患を模倣した低酸素ストレスに正常なCMTをさらすと、一定期間後に拍動数が上昇し収縮機能の回復が見られます。しかし、持続感染モデルでは、拍動数の上昇および収縮機能の回復は認められませんでした(図3)。また、低酸素ストレスによって心筋細胞におけるACE2の発現およびSARS-CoV-2スパイクタンパク質と心筋細胞の共局在が促進していたことから、細胞内においてSARS-CoV-2の再活性化が起こっていることが示唆されました。
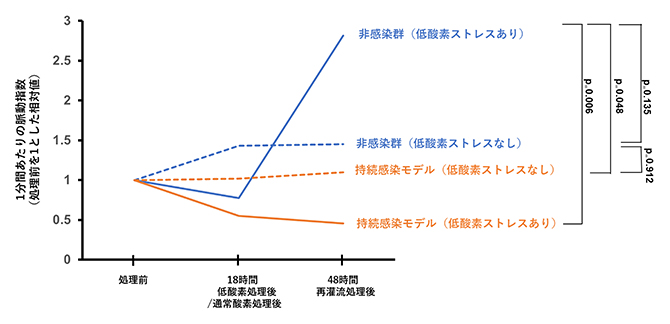
図3 低酸素ストレス処理前後の心機能の変化
持続感染モデルおよび非感染のCMTを、18時間低酸素処理もしくは対照処理(通常酸素濃度)し、それに続く48時間にわたって再灌流処理を行ったときの心機能の経時的変化。心機能は動画解析ツール(MUSCLEMOTION)により算出された1分間当たりの脈動指数の平均値で比較した。非感染群は青、低力価SARS-COV-2感染はオレンジ、低酸素ストレスありは実線、低酸素ストレスなしは破線で示した。(各n=6)。非感染群は低酸素ストレスを受けると拍動数が上昇し収縮機能の回復が見られたが、持続感染モデルは低酸素ストレス後の心機能回復を示さなかった。
さらに特筆すべきは、非感染CMTでは低酸素ストレス後でも血管網様構造が維持されているのに対し、持続感染モデルでは低酸素ストレス後に血管網様構造が全体的に分断されていたことです(図4)。低酸素ストレス後に再活性化したSARS-COV-2は近隣の内皮細胞へ感染を広げ、血管網様構造の維持を困難にした可能性が考えられます。これらの結果は、SARS-CoV-2の持続感染下にある心臓組織が追加の低酸素ストレスを受けた場合、SARS-CoV-2の細胞内再活性化が起こり、心機能低下および血管網の損傷を招く可能性があることを示しています。
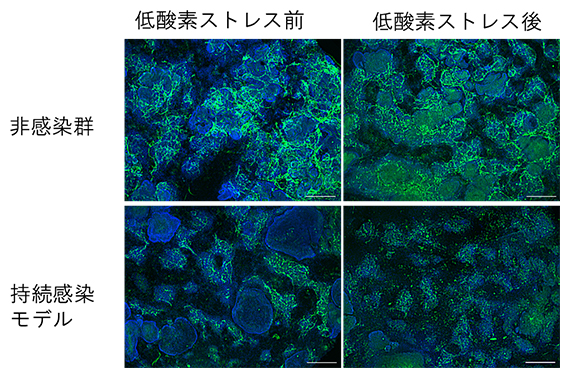
図4 低酸素ストレス処理前後での血管網様構造の様子
持続感染モデルおよび非感染のCMTを、18時間低酸素処理し、続いて48時間再灌流処理を行ったときの血管網様構造を示す蛍光免疫染色像。血管内皮細胞マーカー(緑色:CD31)で示される血管網様構造が、低酸素ストレス後の持続感染モデルでは消失していることが分かる(右下)。細胞核(青色:DAPI)。スケールバーは500μm。
今後の期待
本研究成果から、COVID-19パンデミック後に起こり得る心不全パンデミックが、ポストコロナにおいて警戒すべきヘルスケア上の課題の一つであることが示されました。このようなヘルスケアリスクへの対策として、本研究で確立したCMTを用いたSARS-CoV-2持続感染モデルは、SARS-CoV-2心筋症の発症・進行メカニズムの解明および治療法の開発における有用な生体模倣モデルとなると期待できます。
新型コロナウイルス感染症の重篤化には、免疫系の異常であるサイトカインストーム[11]が関与していると考えられています。しかし今回のSARS-CoV-2持続感染モデルでは、低酸素ストレスによってもサイトカインストームを引き起こすサイトカイン[11]の上昇は観察されなかったため、SARS-CoV-2心筋症はサイトカインストームとは独立に生じている可能性があります。一方で本モデルではサイトカインに反応する免疫細胞そのものは含まれていないため、心臓以外の他臓器が関与する感染メカニズムが十分に再現できていない課題が残されています。現在、オルガノイド[12]研究分野では複数の臓器間相互作用まで考慮したモデル臓器の開発が進んでおり、将来的にこれらの研究成果を今回の持続感染モデルに反映させることで、実際のヒト体内で起こっている現象をより忠実に再現できるようになると考えられます。
補足説明
1.臨床橋渡しプログラム
理研生命機能科学研究センター独自の研究プログラム。臨床医としての知識・経験を有する研究リーダーが、生命機能科学研究センターでの最先端研究と臨床現場でのニーズの融合から、疾病の理解や再生医療への実用化を目指す。
2.iPS細胞
人工多能性幹細胞。皮膚や血液などから採取した細胞に少数の遺伝子などを導入して作製された多能性幹細胞。iPSはinduced pluripotent stem cellsの略。
3.パンデミック
感染症などの疾患が世界規模で大流行していること。世界保健機関(WHO)は2020年3月11日に、新型コロナウイルス感染症がパンデミックにあたると宣言した。
4.心臓マイクロ組織
心臓に含まれる多様な細胞(心筋細胞や血管を構成する細胞など)をヒトiPS細胞から誘導し、それらを含むヒト心筋組織の機能を模した細胞シート状の人工心臓組織。升本上級研究員らが2020年に報告した。
5.虚血性心疾患
動脈硬化や血栓などの要因で心臓の血管が狭くなり、心臓に酸素・栄養が行きわたらず、前胸部などに心臓の痛み、圧迫感といった症状を生じる状態。狭心症や心筋梗塞などの病態がこれに当たる。
6.ACE2、SARS-CoV-2由来のスパイクタンパク質
ACE2は細胞膜に存在するタンパク質で、SARS-CoV-2の機能的受容体となる。ACE2はAngiotensin-converting enzyme 2(アンジオテンシン変換酵素2)の略。SARS-CoV-2由来のスパイクタンパク質は、ウイルス粒子の膜(脂質二重膜)に埋め込まれた形で粒子の外側に突き出ており、スパイクタンパク質に存在する受容体結合ドメインがヒト細胞表面のACE2に結合することでウイルスが侵入を開始する。
7.心内膜生検
心内膜側心筋の一部を心筋鉗子を用いて採取し、組織学的、遺伝子学的に心筋疾患の有無を検索する検査法。
8.日和見的進行
医学用語ではopportunisticの訳語に「日和見」が当てられており、健康な状態では発症につながらない常在菌などが、高齢者や抵抗力の低下した患者に感染症を引き起こすことを日和見感染opportunistic infectionと呼ぶ。本稿では、心臓に無症状で持続感染しているSARS-CoV-2が、心臓への追加ストレスなどをきっかけに心不全心を招くことを日和見的進行と表現した。
9.力価
生物学的な活性の指標で、ウイルスについては感染性を持つウイルス量を表し、この値が高いほど感染性が高い。本研究では、アフリカミドリザルに由来するVeroE6/TMPRSS2細胞に対するTCID50(50%培養細胞感染価)法を用いて、ウイルス力価を測定した。
10.アポトーシス
多細胞生物を構成する細胞の死に方の一つで、プログラムされた細胞死とも呼ばれる。ウイルスに対する生体防御機構の一つであり、感染した細胞を速やかに除去することで、ウイルスの体内での増殖を防ぐ。
11.サイトカインストーム、サイトカイン
サイトカインとは、炎症細胞(マクロファージ、リンパ球など)、上皮細胞、血管内皮細胞などから分泌されるタンパク質。感染症などによって、大量に産生された炎症性サイトカインが血液中に放出され、過剰な炎症反応が引き起こされることをサイトカインストームと呼ぶ。新型コロナウイルス感染症の重症例では、IL-6、IL-10、TNF-αなどのサイトカインの血中濃度の上昇が報告されている(Chen G et al. J Clin Invest. 2020)。
12.オルガノイド
試験管内など生体外で3次元的に作られた臓器。
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究センタープロジェクト「オルガノイド・プロジェクト(研究代表者:升本英利)」)による支援を受けて行われました。
原論文情報
Kozue Murata, Akiko Makino, Keizo Tomonaga*, Hidetoshi Masumoto*(*責任著者), “Predicted risk of heart failure pandemic due to persistent SARS-CoV-2 infection using a three-dimensional cardiac model”, iScience, 10.1016/j.isci.2023.108641
発表者
理化学研究所
生物機能科学研究センター 老化分子生物学研究チーム
上級研究員 升本 英利(マスモト・ヒデトシ)
(京都大学医学部附属病院 心臓血管外科 特定准教授)
(臨床橋渡しプログラム・升本研究室 研究リーダー)
研究員 村田 梢(ムラタ・コズエ)
(臨床橋渡しプログラム・升本研究室 研究員)
京都大学 医生物学研究所 ウイルス感染研究部門
教授 朝長 啓造(トモナガ・ケイゾウ)
准教授 牧野 晶子(マキノ・アキコ)
報道担当
理化学研究所 広報室 報道担当
京都大学 渉外部広報課国際広報室