2024-01-17 東京大学
発表のポイント
◆パーキンソン病において異常な活性化が示唆される病因タンパク質「LRRK2」の活性化をもたらす分子メカニズムを明らかにしました。
◆LRRK2 の活性化は、オートファジーに類似した「ATG8 一重膜結合機構」を介して、細胞小器官であるリソソーム上に LRRK2 が局在化することにより生じることを発見しました。
◆本研究成果は、パーキンソン病における LRRK2 異常活性化を適切に制御することで、新たな根本的治療法の開発につながることが期待されます。
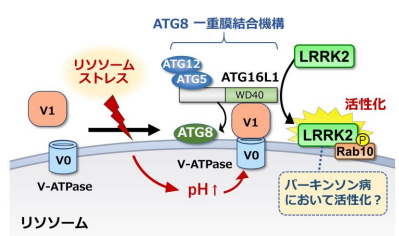
LRRK2 活性化のメカニズム
概要
東京大学大学院医学系研究科・神経病理学分野の桑原知樹講師、江口智也大学院生(研究当時、現:分子生物学分野助教)、櫻井まりあ特任研究員、岩坪威教授らのグループは、パーキンソン病(PD)の病因タンパク質 LRRK2(注1)が細胞小器官であるリソソーム(注2)へのストレスに応答して活性化する分子機構を明らかにしました。LRRK2 は家族性および孤発性 PD にかかわるタンパク質リン酸化酵素であり、その異常な活性化が PD の背景にあることが示唆されていますが、活性化の分子メカニズムや意義については多くが不明でした。研究グループは、リソソームにストレスを負荷すると LRRK2 が活性化するという発見をきっかけとして、リソソーム制御機構との関連を検討した結果、細胞内自己分解経路であるオートファジーに類似した「ATG8 一重膜結合機構」(注3)が LRRK2 を制御することを見出しました。この機構は LRRK2 をリソソーム膜上に局在化させることで活性化し、結果としてリソソームの形態調節や内容物放出に至ることが分かりました。これらの結果は、LRRK2 の異常活性化機構の理解につながるとともに、そのメカニズムへの介在が PD の治療戦略になる可能性を示すものです。本研究成果は、日本時間 2024 年 1 月 16 日に Journal of Cell Biology 誌に掲載されました。