2024-01-24 理化学研究所,名古屋大学,東京学芸大学 京都大学,東京理科大学
理化学研究所(理研)環境資源科学研究センター 代謝システム研究チームのワン・ムンヤオ 特別研究員、多部田 弘光 基礎科学特別研究員、平井 優美 チームリーダー(名古屋大学 大学院生命農学研究科 客員教授)、大髙 きぬ香 客員研究員(研究当時、現 日本女子大学 理学部 助教)、東京学芸大学 教育学部 生命科学分野のフェルジャニ・アリ 准教授、京都大学 大学院生命科学研究科の河内 孝之 教授、東京理科大学 創域理工学部 生命生物科学科の西浜 竜一 教授らの共同研究グループは、タンパク質を構成するアミノ酸の一種であるセリンが、ゼニゴケ[1]の精子形成や胞子体形成に欠かせない代謝産物であることを発見しました。
本研究は、陸上植物の共通祖先から分岐した非維管束植物(コケ植物)であるゼニゴケの生殖に関わる代謝産物を世界に先駆けて見いだした研究であり、植物の進化系統学と代謝生理学の新たな橋渡しとなる可能性があります。また、アミノ酸が持つ、今まで見過ごされてきた新たな機能について洞察を与えるものです。
今回、共同研究グループは、ゲノム編集技術を使って、セリン生合成に重要な酵素であるPGDH[2]の機能を喪失したゼニゴケ変異株を作製しました。さらに、電子顕微鏡による細胞形態の観察や、代謝産物の網羅的な解析によって、PGDHを介したセリン生合成が精子や胞子体の形成に必須なことを明らかにしました。被子植物のシロイヌナズナ[3]においても、PGDHを介して合成されるセリンが配偶子[4]形成に関与する可能性が示唆されていることから、維管束植物と非維管束植物(コケ植物)が進化の過程で分岐した約5億年前から、セリンの持つ生理活性が植物の生殖に欠かせなかったと考えられます。
本研究は、科学雑誌『Communications Biology』オンライン版(2024年1月24日付:日本時間1月24日)に掲載されました。
背景
アミノ酸は全ての生物に含まれている代謝産物で、タンパク質を構成するために欠かせない化合物です。中でもセリンは、植物体内に多く蓄積され、さまざまな生体内分子の材料として活用されています。
植物において、セリンは主に3種類の代謝経路により合成されます。その一つである「リン酸化経路(PPSB経路)[2]」は、動物・植物・細菌など、広い生物種で共通する生合成経路です。PPSB経路は、植物が持つ、病原菌や塩ストレス、低温ストレスに抵抗する能力とも関わっている可能性が指摘されています。さらに、この経路に異常があるモデル被子植物のシロイヌナズナの系統では、花粉の形成に異常が起こることが報告されています。
そのため、PPSB経路と、その経路によって合成されるセリンは、植物にとって重要な機能を持つのではないかと考えられてきました。しかし、PPSB経路の機能に着目した研究は乏しく、その実態は十分には明らかにされていませんでした。
PPSB経路の最初の段階に関わる酵素であるPGDHの活性は、大腸菌においては、セリンによりフィードバック抑制[5]されます。平井チームリーダーらの研究グループは、以前の研究で、進化のさまざまな段階にある植物において、どのようにPGDHの活性が制御されているのか調べました。その結果、被子植物や裸子植物では複数の種類のPGDHが存在する一方、陸上植物進化において維管束植物とは早期に分岐したコケ植物のゼニゴケにおいてはたった一つしか存在しないことが分かり、それらの生化学的性質の詳細を報告してきました注1、2)。植物は進化の過程で制御の仕組みや生理機能の異なる複数のPGDHを持つようになりましたがゼニゴケが持つ、単一のPGDHの機能を調べることで、陸上植物全般が持つPGDHの機能解明につながる可能性があります。そこで本研究では、PGDHの機能を喪失したゼニゴケ変異株を作製することで、非維管束植物におけるPPSB経路の生理学的意義の解明に挑みました。
注1)2017年6月14日プレスリリース「セリン生合成の新しい制御機構を発見」
注2)Okamura, E., Ohtaka, K., Nishihama, R., Uchida, K., Kuwahara, A., Mochida, K. and Hirai, M.Y. (2021) Diversified amino acid-mediated allosteric regulation of phosphoglycerate dehydrogenase for serine biosynthesis in land plants. Biochem. J., 478: 2217-2232, DOI:10.1042/BCJ20210191.
研究手法と成果
共同研究グループは、CRISPR-Cas9[6]を用いたゲノム編集技術を使い、PPSB経路に欠かせないPGDHの機能を喪失したゼニゴケ株であるMppgdh変異体を作製しました(図1)。この系統の表現型(形態や特徴)を解析することで、PPSB経路とそれにより合成されるセリンが、植物の生体内でどのような生理機能を発揮しているのかを突き止めることができます。

図1 CRISPR-Cas9によって作出したゼニゴケ変異体
ゲノム編集技術を用いて作出したMppgdh変異体の表現型。Mppgdh変異体(右)は、生育の初期段階から野生型(左)に比べて成長遅延が生じていた。写真は生育開始から14日目のもの。
ゼニゴケは、無性生殖と有性生殖の両方で繁殖できる植物です。太陽光などの遠赤色光を含む環境下では、有性生殖のために雄器托(ゆうきたく)[7]と雌器托(しきたく)[7]を形成して受精に備えます。共同研究グループは、Mppgdh変異体を遠赤色光条件下で生育させ、雄器托の解析を行いました。雄器托の形成過程を確認したところ、Mppgdh変異体の雄器托の外見には全く変化がありませんでした。しかし、Mppgdh変異体の雄器托からは精子の放出を確認できませんでした(図2右上)。この結果は、雄器托の中で進行する精子形成に異常が起きていることを示唆するものです。次に走査型電子顕微鏡を用いて、雄器托の内部にある造精器の細胞形態を観察しました。その結果、Mppgdh変異体では、精子の形成に異常が起きていました(図2右下)。
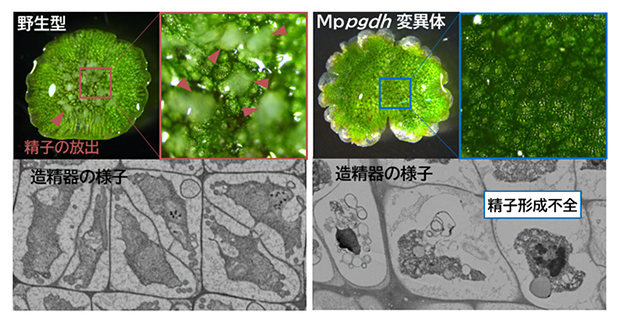
図2 雄器托におけるMppgdh変異体の表現型解析
野生型(左)と変異体(右)を遠赤色光環境下で生育させ、得られた雄器托を用いて表現型を解析した。野生型では水の滴下により精子が放出され、白いもやのようなもの(矢尻)を観察できた。一方、変異体では精子の放出を確認できなかった。内部の造精器の細胞形態を確認すると、分裂に異常が起こり、精子の形成不全が起きていた。
さらに、雌器托に注目した解析を行いました。雌器托には受精に欠かせない卵を形成する造卵器が存在しています。卵が精子と受精すると胞子体が発生し、その後に胞子が形成されます。Mppgdh変異体の雌器托を観察したところ、外見も、内部の造卵器および卵にも異常は見られませんでした。しかし、野生型の正常な精子との受精を試みたところ、Mppgdh変異体では受精は起こったものの胞子体が発達せず、胞子も形成できませんでした(図3)。この結果は、PPSB経路は、受精後の胞子体形成に必須であることを意味しています。

図3 雌器托におけるMppgdh変異体の表現型解析
野生型と変異体から得た雌器托に、野生型の成熟した精子を掛け合わせることで胞子体形成に異常がないかを確認した。左の野生型では大量の胞子が形成されたことで胞子体形成を確認できたが、右の変異体では胞子体の形成不全が起きた。
共同研究グループは、Mppgdh変異体の葉状体[8]についても表現型の解析を行いました。ゼニゴケの葉状体には、無性生殖を行う際に次世代の子孫となる無性芽が形成されます。Mppgdh変異体では無性芽の形成には異常が見られませんでした。この結果は、PPSB経路は有性生殖において重要な機能を果たしていることを示しています。
ここで、PPSB経路の異常が、ゼニゴケの代謝経路全般にどのような影響を及ぼしているのかを確かめるために、メタボローム解析[9]を行いました。解析の結果、Mppgdh変異体では、アミノ酸や核酸、呼吸において重要な代謝経路であるTCA回路の化合物、脂質など、数多くの代謝産物の内生量が変化しており、大規模な代謝かく乱が引き起こされていることが明らかになりました(図4)。この結果は、PPSB経路とそれによって合成されるセリンが、代謝の恒常性[10]、ひいては、植物の成長と発生になくてはならないことを意味しています。
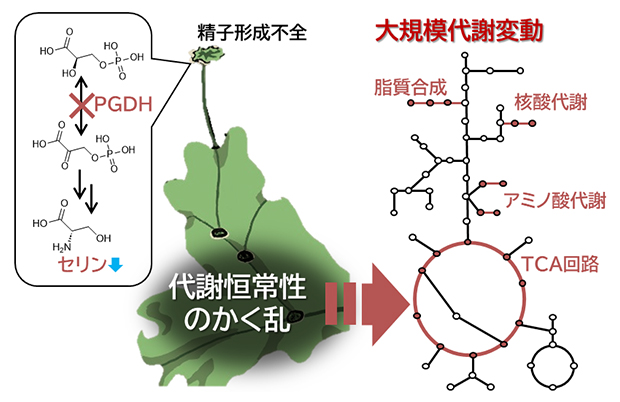
図4 PPSB経路の異常がもたらす代謝かく乱
PPSB経路の最初の段階に関わる酵素PGDHの欠損により、生体内でのセリン代謝の恒常性が乱れることを発見した。代謝恒常性のかく乱は、さまざまな代謝反応の変化を伴い、アミノ酸代謝や核酸代謝、TCA回路、脂質合成に影響を及ぼす。
今後の期待
今回の研究成果により、PPSB経路とそれによって合成されるセリンが、ゼニゴケの有性生殖に欠かせないことが示されました。PPSB経路は被子植物であるシロイヌナズナの配偶子形成にも関与しています。そのため、非維管束植物であるゼニゴケにおいて、セリン生合成に関わる酵素PGDHの働きが、次世代を生み出す有性生殖に必須であるという結果は、PGDHの生殖へ果たす役割が植物界全体に共通して広く保存されていることを示唆しています維管束植物と非維管束植物が進化の過程で分岐したのは約5億年前も昔のことです。このように非常に長い間、植物の繁栄にはセリン合成のPPSB経路が欠かせなかったと考えられます。
植物体内では複数のセリン合成経路が共存しているため、植物の生存におけるセリンの生理機能を完全に理解することは困難です。実際に、セリンの構造は1902年に解明されており、アミノ酸の一種として広く知られる代謝産物であるにもかかわらず、タンパク質構成成分である以外の生理的役割はよく分かっていませんでした。本研究で得られた知見は、この停滞に一石を投じ、セリンの生体内恒常性とその役割を解明する突破口になると考えられます。
このような研究は、代謝産物を利用した、植物の巧みな生存戦略を知るヒントとなります。それらの知恵を活用することで、植物が有用な代謝産物を作るようにデザインしたり、生育速度を早めたりする革新的な技術の開発につながることが期待できます。そのため、今回の研究成果は、国際連合が定めた17項目の「持続可能な開発目標(SDGs)[11]」のうち「2.飢餓をゼロに」と「9.産業と技術革新の基盤をつくろう」に貢献すると期待できます。
補足説明
1.ゼニゴケ
非維管束植物(コケ植物)のタイ類の一種。2017年に全ゲノム配列が解読され、遺伝子組換えや実験室での栽培が簡単なため、扱いやすいモデル植物として注目されている。
2.PGDH、リン酸化経路(PPSB経路)
PPSB経路は生体内においてセリンを合成する代謝経路。3-ホスホグリセリン酸から3段階の反応を経てセリンを合成する。PPSBはphosphorylated pathway of serine biosynthesisの略。PGDHはPPSB経路の最初の段階に関わる初発酵素で、3-ホスホグリセリン酸から中間産物である3-ホスホヒドロキシピルビン酸を合成する反応を触媒する。PGDHは3-phosphoglycerate dehydrogenaseの略。
3.シロイヌナズナ
被子植物のモデル生物として一般的なアブラナ科シロイヌナズナ属の一年草。植物の分子遺伝学的解析においてよく利用される。
4.配偶子
精子や花粉、卵などの、次世代を生むために必要な生殖細胞のこと。ゼニゴケでは、配偶子が接合することで胞子体が形成され、減数分裂し、次世代の胞子を生み出す。
5.フィードバック抑制
特定の化合物の合成経路において、最終産物の濃度が高くなると、その合成経路の酵素活性が抑制される仕組み。
6.CRISPR-Cas9
2020年にノーベル化学賞で注目を浴びたゲノム編集手法。標的の遺伝子配列を簡便に改変することができる。
7.雄器托(ゆうきたく)、雌器托(しきたく)
ゼニゴケの有性生殖に関わる生殖器官。雄器托の表面には造精器が存在し、精子を形成する。雌器托の先端には造卵器が存在し、卵を形成する。雨などにより水が雄器托に当たると、成熟した精子が雄器托から放出され、卵へと到達し、受精する。
8.葉状体
ゼニゴケの主要な植物体。盛んな細胞分裂と細胞伸長が行われ、地面に沿って大きく成長していく。葉状体の表面には無性生殖を行う器官である杯状体が形成される。杯状体の中には多数の無性芽が存在し、雨水などで流れ出ることで、新しい個体が発生する。
9.メタボローム解析
生体内の化学反応によって合成される代謝産物を、質量分析装置などを活用して網羅的に分析する研究手法。網羅的な脂質分析のことを、特にリピドーム解析と呼ぶ。
10.恒常性
外界などからのさまざまな刺激に対し、一定の生体内環境を維持する機能のこと。生物にとって極めて重要な機能であるため、生物はさまざまな方法で恒常性を維持している。
11.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、世界的に積極的に取り組まれている(外務省ホームページから一部改変して転載)。
共同研究グループ
理化学研究所 環境資源科学研究センター
代謝システム研究チーム
特別研究員 Wang Mengyao(ワン・ムンヤオ)
基礎科学特別研究員 多部田 弘光(タベタ・ヒロミツ)
客員研究員(研究当時)大髙 きぬ香(オオタカ・キヌカ)
(現 日本女子大学 理学部 助教)
テクニカルスタッフⅠ 桑原 亜由子(クワハラ・アユコ)
テクニカルスタッフⅠ(研究当時)明石 寛道(アカシ・ヒロミチ)
研究員 佐藤 諒一(サトウ・リョウイチ)
チームリーダー 平井 優美(ヒライ・マサミ)
(名古屋大学 大学院生命農学研究科 客員教授)
質量分析・顕微鏡解析ユニット
上級技師 豊岡 公徳(トヨオカ・キミノリ)
技師 佐藤 繭子(サトウ・マユコ)
テクニカルスタッフⅡ 若崎 眞由美(ワカザキ・マユミ)
統合メタボロミクス研究グループ
上級研究員(研究当時) 庄司 翼(ショウジ・ツバサ)
(現 客員主管研究員、富山大学 和漢医薬学総合研究所 教授)
三重大学 生物資源学研究科
准教授 岡咲 洋三(オカザキ・ヨウゾウ)
(理研 環境資源科学研究センター 統合メタボロミクス研究グループ 客員研究員)
東京理科大学 創域理工学部 生命生物科学科
教授 西浜 竜一(ニシハマ・リュウイチ)
埼玉大学 大学院理工学研究科
准教授 石川 寿樹(イシカワ・トシキ)
東京農工大学 工学研究院
テニュアトラック准教授 津川 裕司(ツガワ・ヒロシ)
東京工業大学 科学技術創成研究院
准教授 吉田 啓亮(ヨシダ・ケイスケ)
東京学芸大学 教育学部 生命科学分野
准教授 Ferjani Ali(フェルジャニ・アリ)
京都大学大学院 生命科学研究科
教授 河内 孝之(コウチ・タカユキ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究(研究領域提案型)「植物個体発生を支える代謝ネットワークの解明(研究代表者:平井優美、25113010)」「乾燥ストレスに対する植物の代謝アダプテーション機構の解明(研究代表者:平井優美、20H04852)」、科学技術振興機構(JST)革新的GX技術創出事業(GteX)「先端的植物バイオものづくり基盤の構築(チームリーダー:大熊盛也、JPMJGX23B0)」の助成を受けて行われました。
原論文情報
Mengyao Wang, Hiromitsu Tabeta, Kinuka Ohtaka, Ayuko Kuwahara, Ryuichi Nishihama, Toshiki Ishigawa, Kiminori Toyooka, Mayuko Sato, Mayumi Wakazaki, Hiromichi Akashi, Hiroshi Tsugawa, Tsubasa Shoji, Kouji Takano, Yozo Okazaki, Keisuke Yoshida, Ryoichi Sato, Ali Ferjani, Takayuki Kohchi, Masami Yokota Hirai, “The phosphorylated pathway of serine biosynthesis affects sperm, embryo, and sporophyte development, and metabolism in Marchantia polymorpha”, Communications biology, 10.1038/s42003-023-05746-6
発表者
理化学研究所
環境資源科学研究センター 代謝システム研究チーム
特別研究員 Wang Mengyao(ワン・ムンヤオ)
基礎科学特別研究員 多部田 弘光(タベタ・ヒロミツ)
研究員(研究当時)大髙 きぬ香(オオタカ・キヌカ)
(現 日本女子大学 理学部 助教)
チームリーダー 平井 優美(ヒライ・マサミ)
(名古屋大学 大学院生命農学研究科 客員教授)
東京理科大学 創域理工学部 生命生物科学科 教授 西浜 竜一(ニシハマ・リュウイチ)
東京学芸大学 教育学部 生命科学分野 准教授 Ferjani Ali(フェルジャニ・アリ)
京都大学大学院 生命科学研究科 教授 河内 孝之(コウチ・タカユキ)
報道担当
理化学研究所 広報室 報道担当
東海国立大学機構 名古屋大学広報課
東京学芸大学 総務課広報・基金室
京都大学 渉外部広報課国際広報室
東京理科大学 経営企画部 広報課